深圳市输入性寨卡病毒分离株的进化分析及生物学特性研究
阳 帆,黄亚兰,黄穗滨,熊玲红,张晓敏,李 玥,张仁利
寨卡病毒病是由寨卡病毒(Zika virus,ZIKV)引起,主要经媒介伊蚊叮咬传播的一种急性传染病, 也可通过血液传播、性传播和母婴垂直传播的方式感染人类[1-3]。寨卡病毒为黄病毒科黄病毒属的正链RNA病毒,基因组由内部单一的开放读码框(open reading frame, ORF)和两侧的非编码区构成,主要分为非洲型和亚洲型两种基因型。大多数寨卡病毒感染者表现为无症状或轻症感染,临床表现主要为发热、皮疹、关节肌肉痛和结膜炎等,但也有证据表明ZIKV感染可引起神经系统并发症如格林-巴利综合征(Guillain-Barre syndrome,GBS)、新生儿小头症(Microcephaly)等先天性出生缺陷综合症等[4-5]。自2015年寨卡疫情在巴西暴发以来,迅速在南美、中北美蔓延,截至2018年底,已扩散到全球86个国家和地区, 感染人数超过百万[6]。我国在2016年2月确诊了首例输入性寨卡病毒感染病例,此后广东、浙江、北京等地先后报告输入性寨卡病例共计20余例[7-8]。寨卡病毒全球广泛传播及其引起新生儿严重的先天异常使其由国际关注的突发公共卫生事件转变为长期公共卫生挑战。目前全球尚无安全有效防治寨卡病毒感染的疫苗和特异性抗ZIKV药物。
2019年12月,一名从柬埔寨回国的旅客在深圳机场口岸入关时有发热症状, 经过深圳市疾病预防控制中心确诊为寨卡病毒感染,现将实验室检测结果报道如下。此外,本研究利用细胞培养传代,成功从病人唾液和尿液标本中分离到了寨卡病毒。为进一步认识输入我国的寨卡病毒, 本文还从病毒基因组序列和遗传进化以及病毒对细胞的感染特性入手, 分析病毒的基因和生物学特性, 为我国寨卡疫情的防控提供基础数据。
1 材料与方法
1.1 病例发现与标本采集 莫某某,男,33岁,中国籍,职业为建筑工人,于2019年6月18日赴柬埔寨务工,12月8日乘机回国,经深圳机场口岸入境被发现有发热表现(体温37.9 ℃),无其他症状或体征,否认病人接触史和蚊虫叮咬史,无同行人员。同时采集患者咽拭子和血液标本,对其进行流感病毒通用型和登革、基孔、寨卡病毒检测,结果为流感病毒A+B阴性;9日傍晚,深圳海关实验室两次血液标本检测结果均为寨卡病毒核酸阳性。随即送往深圳市第三人民医院进行对症治疗和隔离,重新采样后送至深圳市疾病预防控制中心进行复核。按照《寨卡病毒病防控方案(第二版)》[9]的要求,患者住院后连续采集血液、唾液和尿液标本,直至病毒核酸检测结果为阴性。
1.2 主要试剂和仪器 BHK-21细胞(金黄色地鼠肾细胞)和Vero细胞(非洲绿猴肾细胞)由本实验室保存,复苏后用含10%胎牛血清的DMEM培养液(Gibco公司),于37℃、5%的二氧化碳条件下常规传代培养。病毒RNA核酸提取试剂盒(High Pure Viral RNA Kit)购自Roche公司,一步法RT-PCR扩增试剂盒(PrimeScript One Step RT-PCR Kit)购自TAKARA公司。商品化寨卡病毒核酸检测试剂盒(荧光RT-PCR法)购自江苏硕世生物科技股份有限公司,7500 荧光定量PCR仪和9700 PCR仪为美国ABI公司仪器,倒置显微镜Axio Vert A1为德国Zeiss仪器。
1.3 寨卡病毒RNA提取与核酸检测 取血清、唾液和尿液标本或细胞培养物各200 μL,按照病毒RNA核酸提取试剂盒说明书提取病毒RNA,最后用50 μL洗脱液洗脱病毒核酸,-80 ℃冰箱保存。采用商品化寨卡病毒核酸检测试剂盒进行核酸测定,按照说明书操作进行。
1.4 寨卡病毒分离鉴定 采用BHK-21和Vero细胞按照常规方法分离患者样本中寨卡病毒。将细胞培养至单层,患者标本用维持液作适量稀释后,接种细胞,置37 ℃ CO2培养箱培养。每日于倒置显微镜下观察细胞病变(CPE)情况。每7 d传代,盲传3代,如无CPE视为阴性;有CPE则转细胞瓶培养,待病毒增殖3/4的细胞发生病变时收取毒株进行荧光RT-PCR鉴定。
1.5 寨卡病毒空斑形成及病毒滴度测定 采用Vero细胞参照文献方法[10]稍作改动进行噬斑试验测定寨卡病毒滴度。用细胞维持液将寨卡病毒进行10倍倍比稀释(10-1~10-7),在单层致密Vero细胞的六孔培养板中加入不同稀释倍数的病毒悬液,500 μL/孔,37 ℃吸附1 h,每隔15 min轻轻摇动1次以保证液体均匀覆盖细胞面。吸附后弃病毒液,每孔加入3 mL琼脂盖(3%琼脂糖和细胞维持液1∶1混合液),37 ℃继续培养,在显微镜下每日观察细胞病变。观察到明显噬斑时加入0.5 mL固定液(4%甲醛),37 ℃固定2 h,然后弃固定液和营养琼脂盖,并用去离子水清洗2~3次。加入1 mL 1.5%的结晶紫溶液,37 ℃染色0.5 h,弃结晶紫溶液,并用去离子水清洗2~3次,观察形成的噬斑并计数,计算病毒空斑形成单位。
1.6 RT-PCR产物的扩增与序列测定 自行设计引物(表1)采用一步法RT-PCR扩增试剂进行寨卡病毒全基因组扩增,扩增产物送华大进行序列测定, 测序结果用DNASTAR Seqman软件进行拼接以获得全长基因组序列。
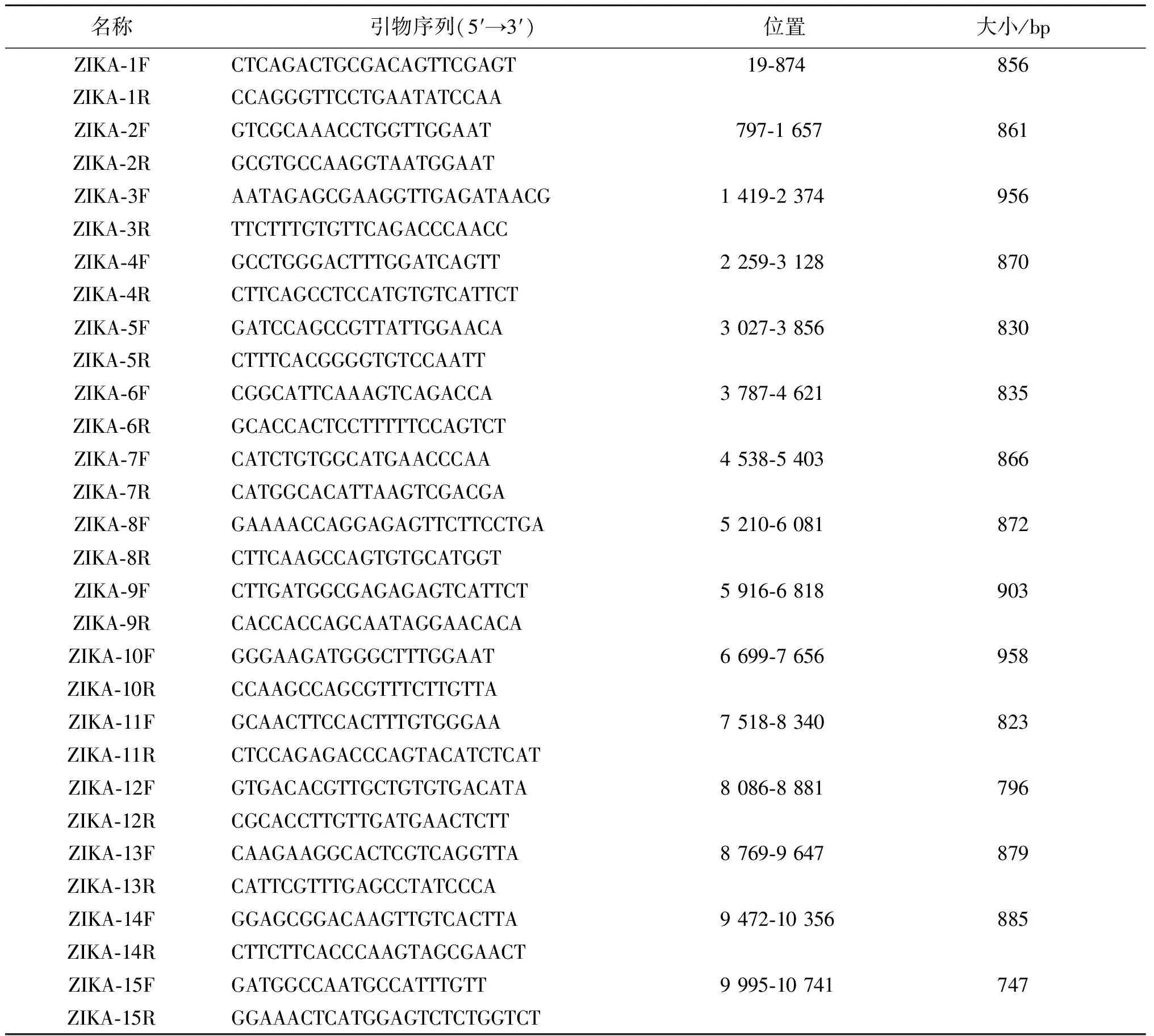
表1 本研究设计的扩增寨卡病毒基因组ORF引物Tab.1 Primers used for sequencing of ZIKV genome ORF in this study
1.7 序列分析与软件 采用DNASTAR软件MegAlign与GenBank数据库中筛选到的寨卡病毒株进行全编码区基因序列比对分析,用Mega6.0软件邻接法(Neighbor-Joining)构建系统进化树,Bootstrap值设定为1000。
2 结 果
2.1 病例样本寨卡病毒核酸检测 使用商品化检测试剂盒对不同时间段采集的患者血清、唾液和尿液样本进行寨卡病毒核酸荧光RT-PCR检测,患者血清、唾液和尿液样本均有典型扩增曲线,其中尿液样本Ct值约为22~35,唾液样本Ct值约为29,血清样本较弱,Ct值仅为35,且3种生物样本病毒核酸阳性持续时间不一致,具体见表2。
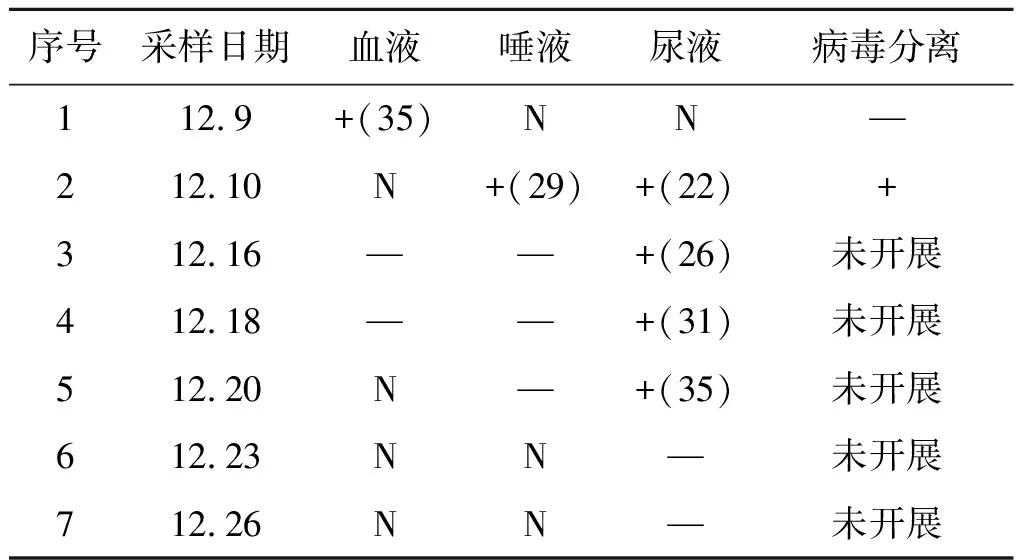
表2 寨卡病毒病患者病程中生物样本荧光RT-PCR和病毒分离结果Tab.2 Real time RT-PCR and virus isolation of biological samples from Zika virus patient in courses of disease
2.2 寨卡病毒分离鉴定 采用Vero和BHK-21细胞进行寨卡病毒分离。细胞盲传3代,每代均连续观察7 d。发现将唾液和尿液标本接种Vero细胞后第3代可观察到肉眼可见的CPE,细胞病变主要表现为细胞圆缩且间隔变大、脱落(图1)。提取Vero细胞第3代培养物进行寨卡病毒核酸检测,荧光RT-PCR结果呈阳性。表明我们从患者唾液和尿液标本中成功分离到了寨卡病毒,分别将其命名为ZIKV/S/SZ1901和ZIKV/U/SZ1901。这也是我们首次成功从唾液和尿液标本中分离到寨卡病毒。而采用BHK-21细胞分离病毒时未见CPE,但提取BHK-21细胞第3代培养物进行寨卡病毒核酸检测,荧光RT-PCR结果呈阳性,提示两分离株可在BHK-21细胞中得到扩增。

注:a. Vero细胞对照;b. 唾液分离株ZIKV/S/SZ1901接种Vero细胞(p3代第4 d);c. 尿液分离株ZIKV/U/SZ1901接种Vero细胞(p3代第4 d)图1 寨卡病毒株感染Vero细胞的细胞病变作用(×200)Fig.1 Cytopathic effects(CPEs)of Zika Virus in Vero cells(×200)
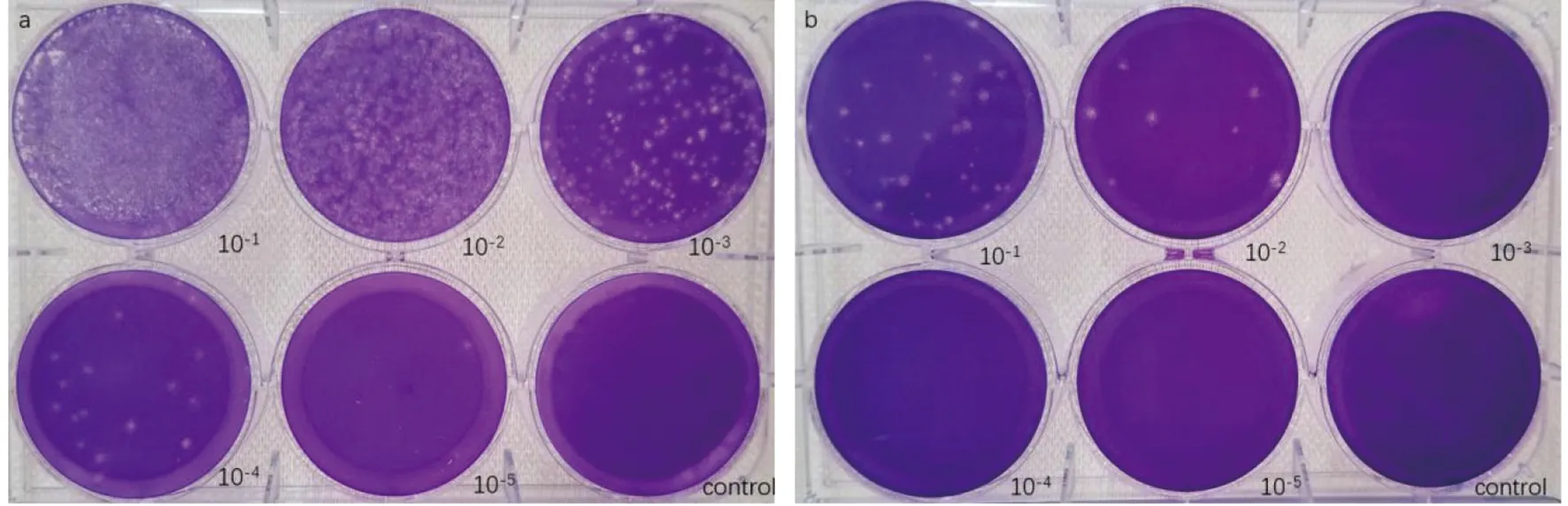
注:a. ZIKV/S/SZ1901毒株接种Vero细胞的第三代细胞液的滴度3.4×105 PFU/mL;b. ZIKV/U/SZ1901毒株接种Vero细胞的第三代细胞液的滴度1.4×103 PFU/mL图2 ZIKV/S/SZ1901和ZIKV/U/SZ1901毒株在Vero细胞的空斑形态Fig.2 Plaque morphology of ZIKV/S/SZ1901 and ZIKV/U/SZ1901 strains in Vero cells
2.3 寨卡病毒噬斑形态特征及病毒滴度 图2所示,从唾液和尿液中分离到的寨卡病毒株均可在Vero细胞产生明显的肉眼可见的空斑,空斑形态呈圆形,形态清楚,边缘整齐。根据两毒株稀释度以及空斑数量计算空斑的形成单位(PFU/mL)以测定病毒滴度,结果显示毒株在Vero细胞第3代培养液中的病毒滴度分别为3.4×105PFU/mL、1.4×103PFU/mL。
2.4 进化分析 为进一步对分离病毒的遗传特征进行分析, 利用合成的全基因分段扩增引物(表1)针对Vero细胞培养病毒株, 分段对病毒全基因组进行了扩增, 将扩增的基因片段分别测序, 获得了ZIKV/S/SZ1901和ZIKV/U/SZ1901病毒株的全长基因组序列。寨卡病毒唾液和尿液分离株两者序列一致,全编码区序列长度为10 272个碱基,编码3 424个氨基酸(GenBank序列号为MZ008356)。将SZ1901与GenBank筛选到的36株寨卡病毒株(表3)构建进化树显示,SZ1901属于亚洲基因簇系,与中国16个输入性分离病毒株核苷酸序列同源性均在98.4%以上;与2016年中国贵州和2018年江西蚊媒标本中分离到的寨卡病毒株同源性均在98.6%以上;与近几年东南亚分离株核苷酸序列同源性均在99.5%以上,其中与2017年从泰国输入至日本的ZIKV/Hu/Thai/KngSG/17-D501株亲缘关系最为接近,核苷酸同源性为99.6%,氨基酸同源性为99.8%;与1966年第1株分离自亚洲地区马来西亚的寨卡病毒株P6-740核苷酸同源性为95.3%,氨基酸同源性为98.9%;与2010年从亚洲柬埔寨分离到的祖先寨卡毒株FSS13025核苷酸同源性为98.1%,氨基酸同源性为99.6%,见图 3。此外,我们还发现SZ1901分离株寨卡病毒遗传综合征(Congenital Zika virus syndrome,CZVS)相关氨基酸变异位点分别为prM139(S)、E683(E)、E763(M)、E777(M)和NS5 2634(M),且NS1基因为A188V的突变。

表3 用于进化分析的国内外寨卡毒株核苷酸序列信息表Tab.3 Nucleotide sequence information of Zika virus strains at home and abroad

图3 寨卡病毒深圳分离株SZ1901全基因组进化树图Fig.3 Phylogenetic tree of full coding region of ZIKV SZ1901 strain
3 讨 论
2019年12月9日,深圳海关报告1例从柬埔寨归国的疑似寨卡病毒病患者,后经深圳市疾病预防控制中心和广东省疾病预防控制中心逐级复核,遂被确诊。根据流行病学史、临床表现和实验室检测结果,广东省卫计委10日晚通报发布该确诊病例为2016年至今中国内地累计报告的第30例输入性寨卡病毒病病例。寨卡病毒病的传播媒介主要是埃及伊蚊,其次为白纹伊蚊、非洲伊蚊和黄头伊蚊等[11]。深圳市广泛分布白纹伊蚊,且与美洲、非洲、东南亚和太平洋岛国等流行地区旅游、国际贸易和涉外劳务往来密切,一旦在夏秋季白蚊伊蚊密度高的时候出现输入性病例,存在ZIKV本地传播甚至引起局部聚集性病例的风险。因此,应加大对疫区归国人员的宣传教育,建立输入性寨卡病例发现机制,提高实验室检测能力,才能有效控制寨卡病毒病疫情在我市扩散和暴发风险。
目前,寨卡病毒感染后症状不易与登革热、基孔肯雅热等区分,且由于寨卡病毒和登革病毒等黄病毒属之间存在血清学交叉反应,实验室鉴别诊断主要以病原学检测(包括病毒分离培养和核酸检测)为准。寨卡病毒的分离培养为诊断的金标准,但需时较长。因此常采用荧光RT-PCR方法快速进行寨卡病毒核酸检测来对病例确诊。患者入境时血清样本寨卡病毒核酸检测为弱阳性,这表明此时患者的病毒血症期快要结束。而后通过对该病例的持续采样检测结果分析,唾液和尿液样本中寨卡病毒载量较高,且尿液中的寨卡病毒比唾液和血液中存在时间长,这与既往文献报道情况类似[12-15]。寨卡病毒病症状较轻,早期发现较困难;病例或隐性感染者被发现时大部分血清检测寨卡病毒已经为阴性,因此建议除血清标本外应尽量同时采集唾液和尿液样本开展核酸检测以免漏检。
寨卡病毒的分离培养通常采用C6/36、BHK-21和Vero细胞,样本类型包括血清、唾液、尿液和精液,CPE情况和分离效果也各不相同。本研究常规采用Vero和BHK-21细胞进行寨卡病毒的分离,接种唾液和尿液标本后在Vero细胞上第3代第4 d观察到出现典型的CPE,且可形成肉眼可见的空斑,与文献报道一致[16-19]。而采用BHK-21细胞进行寨卡病毒分离时,尽管未观察到CPE,但在BHK-21细胞第3代培养物中检测到高滴度寨卡病毒核酸,可能因实验室保存的BHK-21细胞代次较高,对寨卡病毒的敏感性降低,而寨卡病毒对Vero细胞更加敏感,具体影响因素有待于进一步深入研究。
从构建的进化树可以看到,其中共有20条序列分离自中国,分为4个分支。研究表明寨卡病毒的分子进化与病毒的地理分布有着密切的关系。目前中国的寨卡病毒感染病例均为输入性病例,分别来自南美洲、大洋洲、东南亚等地。其中SZ-WIV01、SZ01、SZ02、SMGC-1、Zhejiang04和ZJ03等分离自到萨摩亚旅游归国的病例,与2016年中国贵州和2018年江西蚊媒标本中分离到的寨卡病毒株同源性较高,在同一个小分支上; GD01、GDZ16001、GZ01、GZ02、Z16019分离自南美洲如委内瑞拉到中国的输入性病例,可能与有较多广东人在南美务工以及去南美短期旅行有关;另一分支上云南报道的2019YNZIKV02[20]等分离自缅甸到中国的输入性病例;而本次输入性疫情的国家柬埔寨是寨卡病毒流行区,流行病学调查显示,该病例为在柬埔寨居留期间感染的寨卡病毒,该病毒株SZ1901与2017年从泰国输入至日本的ZIKV/Hu/Thai/KngSG/17-D501株高度同源,同属于亚洲基因族系,在分子水平上进一步证实该病例为输入性寨卡病例。文献报道寨卡病毒基因组中5个氨基酸位点的替代(S139N、D683E、V763M、T777M、M/T2634V)与2015年以后流行的寨卡病毒引起寨卡病毒遗传综合征、吉兰-巴雷综合征等有关[18]。此外研究还发现病毒NS1蛋白第188位氨基酸由A变异为V可导致寨卡病毒的传播和感染的增加[21]。此次分离株这6个氨基酸位点中E基因上3个位点和NS1第188关键位点发生变异,而prM和NS5基因关键位点未发生相应变异。寨卡病毒在人群中的大规模暴发正加速寨卡病毒的变异以更好地适应新宿主,其变异位点的功能值得重点关注,该毒株氨基酸变异位点是否导致其致病性和传播效力等生物学特性发生变化仍未可知,但病毒基因的多样性对寨卡的防控提出了挑战,这也是我们下一步研究的重心。
综上所述,本次疫情我们从患者流行病学史、临床表现和实验室检测结果,确诊该病例为从柬埔寨输入性寨卡病毒感染病例。首次成功从唾液和尿液标本中分离到寨卡病毒,接着从细胞病变、空斑试验等生物学特征对唾液和尿液分离株进行比较研究,发现不仅两株病毒的敏感细胞以及病变时间存在差异,而且病毒株在Vero细胞的空斑形成单位不同。通过进一步的分子遗传进化分析以及氨基酸位点差异比对,发现该寨卡病毒株具有引起寨卡病毒感染所致畸形综合征等的分子基础,同时也会造成蚊虫寨卡病毒感染率增加,为深入了解病毒致病机制和研发安全有效的寨卡病毒疫苗和药物奠定了基础。
利益冲突:无
引用本文格式:阳帆,黄亚兰,黄穗滨,等. 深圳市输入性寨卡病毒分离株的进化分析及生物学特性研究[J].中国人兽共患病学报,2021,37(11):977-984. DOI:10.3969/j.issn.1002-2694.2021.00.143

