发根农杆菌诱导单面针毛状根及PCR 检测研究
吕思航,苗卓文,刘修霆,冯思晴,孙吉康
(中南林业科技大学生命科学与技术学院,湖南长沙 410004)
单面针(Zanthoxylum dissitum Hemsl.)是芸香科花椒属木质藤本植物,普遍分布于我国南方地区海拔500~1200m 的山地林下、林缘、灌丛中[1]。2013 年9 月2日,环境保护部和中国科学院联合编制发布的《中国生物多样性红色名录——高等植物卷》显示,芸香科花椒属16 种花椒中,1 种濒危、9 种近危、6 种易危。单面针属近危物种,影响野生单面针资源存量的主要原因包括:生态环境恶化、人为掠夺性采伐、种子萌发率低下。
单面针中富含生物碱、黄酮、香豆素等生物活性成分,是妇科千金胶囊的主要成分,同时,具有活血散瘀、续筋接骨的作用[2-3]。单面针根茎是其主要用药部位,但单面针植株根系分支少、短,根系不发达且生长缓慢。此外,人工栽培单面针药材存在生长周期长、产量低、药材品质低下等问题。
20 世纪80 年代,White 等人[4]发现,发根农杆菌通过伤口,将Ri 质粒上的T-DNA 插入植物基因组,其所携带的rol B 等基因在宿主细胞中整合表达,从而诱导植物长出毛状根。许多专家学者发现,毛状根中可以提取许多次生代谢物质,其正是药用植物发挥医药疗效的基础物质。诱导产生的毛状根具有生长速度快、分化程度高、生理生化和遗传性稳定、操作控制简单、不需要外源植物激素等特点。目前,许多药用植物已经成功培育出毛状根,如颠茄、丹参、地黄、何首乌、金铁锁、车前叶蓝蓟、黄岑等[5]。
但迄今对单面针的毛状根诱导培养技术未见报道。拟利用发根农杆菌C58C1 和ATCC10060 转化单面针不同外植体以诱导产生毛状根,建立单面针毛状根诱导技术。
1 试验材料与方法
1.1 试验材料
使用单面针无菌苗来自湖南省张家界种子萌发,发根农杆菌菌株C58C1 和ATCC10060 由本试验室保存。
1.2 试验方法
1.2.1 单面针无菌苗培养。挑选生长活力好的单面针种子,敲除外壳,将种子浸泡于540mg/L GA3溶液中5.5h;在超净工作台内,0.1%升汞消毒3.5min,无菌水冲洗5次;接种于MS 固体培养基内,置于25℃人工气候培养箱内暗培养,至子叶完全长出后转移至光培养。置于16/8h 光照周期环境,光照强度为60 μmol·m-2s-1,培养45d 后得到单面针无菌幼苗。
1.2.2 活化发根农杆菌。保存在-80℃超低温冰箱中的发根农杆菌,取100μL 加入30mL 含有50mg/L 利福平的YEB 液体培养基中,于30℃、120r 摇床培养13~15h,测菌液OD600 值达0.5~0.7。取20mL 菌液加入20mL含有100 μm AS(乙酰丁香酮)的YEB 液体培养基中,添加利福平至浓度为50mg/L,培养1.5~2h,至菌液OD600 值达0.5~0.7。将菌液倒入灭菌的50mL 离心管中,以5000r 离心8~12min,弃上清液,加入40mL 含有100 μm AS 的MS 液体培养基中,重悬沉淀至无絮状物,这时培养基中活化的菌液达到了对数生长期,即可用于侵染。
1.2.3 外植体选取及处理。分别取无菌苗的叶片(划伤)、叶柄(带叶片),于MS 空白固体培养基中,在25±2℃的人工气候箱中暗培养2d。
1.2.4 外植体侵染与培养。将预培养的外植体浸入活化好的菌液在摇床中以30℃、120r 的条件震荡10min,无菌水冲洗1~2 次,后将外植体取出后,用无菌滤纸吸干表面水分,将处理好的外植体移入MS+AS(乙酰丁香酮100μm)固体培养基中,在25±2℃的人工气候箱中培养2d,后置于MS+Cef(头孢霉素500mg/L)固体培养基中暗培养,每隔3~10d 更换新鲜培养基,直至毛状根长出。1.2.5 毛状根rol B 基因的PCR 检测。提取单面针幼苗根、单面针毛状根DNA 及C58C1 农杆菌质粒,利用引物5'-GCT CTT GCA GTG CTA GATTT-3' 和5'-GAA GGT GCAAGC TAC CTCTC-3'进行PCR。PCR 反应程序为:94℃预变性5min,按94℃变性30sec、55℃退火40sec、72℃延伸1min 的程序进行35 个循环,循环结束后,在72℃下延伸8min 结束反应,4℃保存。扩增产物在1.5%的琼脂糖凝胶上电泳25~30min,溴化乙锭染色,凝胶成像系统观察和拍照记录(120V 电压,25 min),对获得的毛状根进行分子鉴定。
2 结果与分析
2.1 不同外植体对单面针毛状根发根情况的影响
在侵染10min 的条件下,选择发根农杆菌C58C1进行侵染,研究比较不同外植体,即单面针叶柄(带叶片)和单叶片(划伤),对诱导毛状根发根情况的影响,试验结果(见表1、图1)。

表1 外植体不同对单面针毛状根发根情况的影响

图1 C58C1 诱导的单面针毛状根
从表1 中可见,单叶片(划伤)作为外植体没有发根出现,选取叶柄(带叶片)作为外植体时,经过35d 诱导培养后开始发根,其发根率可达25%。故选取叶柄(带叶片)作为外植体诱导单面针毛状根最为合适。图1 显示,单面针毛状根为乳白色,失去向地生长特性,而且生长较为迅速,需5d 即可长至1~1.5cm。
2.2 发根农杆菌菌种不同对单面针毛状根发根情况的影响
根据2.1 相关内容,以单面针叶柄(带叶片)为外植体,侵染时间为10min。分别选择发根农杆菌C58C1 和ATCC10060 进行侵染,目的是为找到最优的侵染菌种。
从表2 试验结果可见,发根农杆菌C58C1 的诱导成功率明显高于ATCC10060 菌株,因此,选择发根农杆菌C58C1。

表2 发根农杆菌菌种不同对单面针毛状根发根情况的影响
3 毛状根PCR 检测
分别以C58C1 发根农杆菌Ri 质粒、单面针幼苗根和单面针毛状根的基因组DNA 为模板,以前述引物对rol B 基因进行PCR 检测(见图2)。结果表明,在单面针毛状根基因组DNA 和C58C1 质粒中,能扩增到400bp的特异性DNA 片段,而在幼苗根DNA 中扩增失败。因此,证明发根农杆菌中的Ri 质粒已导入单面针毛状根中。
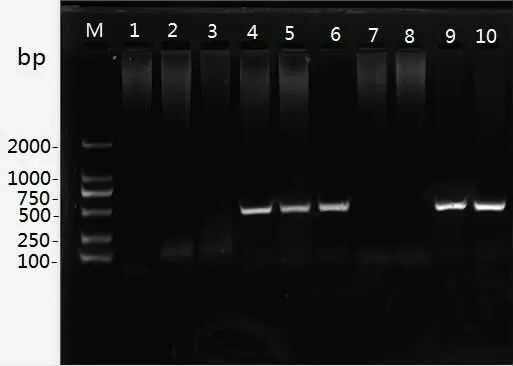
图2 单面针毛状根rol B 基因PCR 检测
3 结语
通过毛状根提取次生代谢物被广泛应用于各种植物来源的药物生产[6]。毛状根的诱导培养受很多物理、化学因素影响,如外植体、发根农杆菌种类、预培养及共培养时间、外源激素等[7]。目前,对单面针的遗传转化还没有报道,选择不同的外植体部位进行条件的优化,是因为农杆菌侵染时发根性与外植体的不同而有所不同。
本研究利用2 种发根农杆菌C58C1 和ATCC10060转化单面针不同外植体部位,确定发根农杆菌C58C1转化单面针叶柄(带叶片)对毛状根的诱导成功率最高,单面针毛状根失去向地性而且生长迅速。采用PCR 对成功诱导出来的单面针毛状根进行PCR 分子验证,证明发根农杆菌C58C1 菌株中Ri 质粒T-DNA 片段已整合进毛状根基因组中。本研究成功建立单面针毛状根诱导技术,为今后单面针毛状根的扩大培养及其次生代谢产物活性成分研究奠定了基础。

