禽腺病毒4型Fiber-2蛋白原核表达及间接ELISA的构建
潘静,孟凯,秦晓冰
(1.青岛农业大学动物医学院/山东省预防兽医学重点实验室,山东 青岛 266109;2.山东省农业科学院家禽研究所,山东 济南 250100)
2015年7月以来,以包涵体肝炎和心包内出现淡黄色透明液体为主要临床症状的“鸡心包积水综合症”(hydropericardium-hepatitis syndrome,HHS)在中国大面积暴发流行,该病是由禽腺病毒4型(fowl avianadenovirus serotype 4,FAdV-4)引起的急性传染病,对我国家禽绿色健康养殖构成巨大的威胁和挑战[1]。被FAdV-4感染的家禽出现急性死亡,死亡高峰集中在1周之内,死亡家禽出现典型的心包积液以及包涵体肝炎症状。此外,FAdV-4感染能够导致宿主的免疫抑制,由此导致的免疫失败、继发感染、混合感染进一步加剧了HHS的危害[2]。目前亟待有效检测该病毒的商业产品。FAdV-4包括3种主要结构蛋白,分别为纤突蛋白Fiber、六邻体蛋白Hexon和五邻体基座Penton[3]。其中FAdV-4的基因组中有2个Fiber基因开放阅读框,能够编码2个Fiber蛋白——Fiber-1和Fiber-2[4]。纤突蛋白Fiber-2和六邻体蛋白Hexon可作为免疫原性蛋白起到一定的保护作用,通过比较其保护效率发现Fiber-2蛋白的免疫原性和保护原性最好[5]。
血清学诊断技术已被用于家禽FAdV感染的检测,其进展主要集中在ELISA检测技术的改进上。早期间接ELISA采用全病毒作为包被抗原,但病毒抗原的制作繁琐、低效且灵敏度和特异性低。而基于重组蛋白的ELISA方法更灵敏、特异和准确,易形成标准化并适于大规模运用[6]。
本研究以从山东省某肉鸡场分离到的一株FAdV-4毒株(命名为FAdV-4 SDJN0105株,于2021年1月29日保藏于武汉大学菌种保藏中心,保藏号为CCTCC No:V202114)为模板扩增Fiber-2基因,通过原核表达Fiber-2蛋白作为包被抗原,优化反应条件,建立了FAdV-4间接ELISA抗体检测方法,丰富了当前检测FAdV-4的方法,为定量测定免疫鸡体内抗体水平提供了参考依据。
1 材料与方法
1.1 病毒、血清、载体及试验动物
禽腺病毒4型毒株SDJN0105株由本实验室分离;FAdV-4阳性血清和阴性血清由本实验室利用SPF鸡制备和保存;鸡传染性法氏囊病病毒(IBDV)、鸡传染性支气管炎病毒(IBV)、鸡新城疫病毒(NDV)、禽白血病病毒(ALV)、H5和H9亚型禽流感病毒阳性血清由本实验室保存;FAdV-8b阳性血清由济南飞智生物技术有限公司惠赠;表达载体pET-30a(+)购自上海捷瑞生物工程有限公司;大肠杆菌BL21(DE3)购自北京全式金生物技术有限公司;SPF鸡购自济南斯派福瑞禽业科技有限公司。
1.2 主要试剂
DL5000 DNA Marker、DL2000 DNA Marker、限制性内切酶NdeⅠ和Hin dⅢ、Taq DNA聚合酶购自宝日医生物技术(北京)有限公司;质粒小提试剂盒、DNA胶回收纯化试剂盒购自天根生化科技(北京)有限公司;Bradford蛋白浓度测定试剂盒、SDS-PAGE电泳液、5×蛋白上样缓冲液、SDS-PAGE凝胶快速配制试剂盒、脱脂奶粉、BSA、一抗稀释液购自碧云天生物技术有限公司;明胶购自Sigma-Aldrich(上海)贸易有限公司;ECL发光液购自环亚生物科技有限公司;蛋白Marker购自赛默飞世尔科技(中国)有限公司;无缝克隆试剂盒购自北京全式金生物技术有限公司;HRP标记的兔抗鸡二抗购自Proteintech中国公司。
1.3 包被抗原的制备
1.3.1 SDJN0315株FAdV-4基因组提取 将病变鸡的肝组织剪碎研磨,离心过滤后,稀释1 000倍接种LMH细胞,72 h冻融细胞3次,接种下一代细胞,如此盲传3代,收集细胞上清,用病毒基因组提取试剂盒提取FAdV-4基因组DNA,于-80℃保存。
1.3.2 Fiber-2基因克隆与优化 根据NCBI上Fiber-2基因保守区序列设计一对Fiber-2全长扩增引物,上游引物:5′-ATGCTCCGGGCCCCTAAAAGAAGACATTC-3′,下游引物:5′-TTACGGGAGGGAGGCCGCTGGACAGC-3′。以FAdV-4基因组DNA为模板,PCR克隆Fiber-2基因。利用密码子优化软件MaxCodonTMOptimization Program(V13)对Fiber-2核苷酸序列进行优化,使之更易在大肠杆菌中表达。由生工生物工程(上海)股份有限公司合成含目的基因的pUC57-Fiber-2质粒,并用无缝克隆引物扩增优化后的Fiber-2基因,无缝克隆上、下游引物,分别为5′-TGGTGCTCGAGTGCGGCCGCAAGCTTATGCTCCG GGCCCCTAAAAGA-3′和5′-GGCCATGGCTGAT ATCGGATCCAATTCTTACGGGAGGGAGGCCGCTG GACAG-3′。本试验所用引物均由生工生物工程(上海)股份有限公司合成。
1.3.3 pET-30a(+)-Fiber-2重组质粒的构建 将pET-30a(+)质粒经限制性内切酶NdeⅠ和Hin dⅢ酶切,经核酸电泳鉴定正确后用DNA胶回收纯化试剂盒回收线性载体质粒。将线性载体质粒pET-30a(+)、目的基因Fiber-2用无缝克隆试剂盒连接,转化到DH5α感受态细胞,挑取单克隆菌落摇菌提质粒,经PCR、琼脂糖凝胶电泳鉴定后,送北京六合华大基因科技有限公司测序。
1.3.4 Fiber-2蛋白表达纯化与鉴定 将测序正确的重组质粒pET-30a(+)-Fiber-2转化到BL21(DE3)感受态细胞,挑取单克隆菌落培养,测序鉴定阳性后对其进行诱导表达。当菌液OD600值达到0.8时,加入IPTG,使之终浓度为0.2 mmol/L,15℃诱导16 h,离心收集菌体。超声裂解,4℃离心3 min,分别取上清和沉淀,沉淀用等量PBS重悬,分别取出80μL,加蛋白上样缓冲液煮沸后进行SDS-PAGE电泳,分析蛋白的表达方式。将表达产物通过Ni-IDA亲和层析柱进行纯化,用BCA蛋白浓度测定试剂盒测定目的蛋白浓度。纯化后的蛋白用Western-Blot试验鉴定其免疫原性,一抗用鼠源His单克隆抗体孵育,二抗用羊抗鼠抗体孵育。
1.4 Fiber-2间接ELISA方法的建立
采用方阵法优化抗原最佳包被量和血清稀释梯度。用pH 9.6、0.05 mol/L PBS作包被液稀释Fiber-2蛋白,使其浓度分别为1、2、4、8、10 μg/mL,包被96孔酶标板,每个浓度包被3个孔,100μL/孔,37℃放置1 h后4℃包被过夜。次日弃去孔内液体,用PBST洗涤,200μL/孔,静置1 min后弃去拍干,重复5次。用1%BSA作封闭液,100μL/孔,37℃封闭1 h,洗涤,同上。将FAdV-4阴性血清、阳性血清分别按1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200、1∶6400、1∶12800稀释加入96孔板中,100μL/孔,每个梯度3个重复,混匀,37℃温育30 min。洗涤拍干加入1∶10000稀释的HRP标记的兔抗鸡二抗,100 μL/孔,37℃温育30 min。洗涤拍干加入TMB底物显色液,37℃避光反应10 min。加入2 mol/L浓硫酸终止液,50μL/孔,15 min内读取OD450值,并计算阳性与阴性OD450的比值(P/N值)。阳性OD450值接近1.0,阴性OD450小于0.2,且P/N值最大时为最佳抗原包被量和血清稀释梯度。
最适抗原浓度包被96孔板后,从不同包被方式(37℃包被1 h、37℃包被3 h、4℃包被过夜)中确定最佳包被方式。以同样的方法确定最佳封闭液(0.5%BSA、1%BSA、5%脱脂奶粉、1%明胶),最佳封闭时间(30 min、1、2 h),待检血清和二抗最佳孵育时间(30 min、1、2 h),最佳底物显色时间(5、10、15 min)。
1.5 阴阳性临界值的确定
采取50只SPF鸡的阴性血清,根据建立的ELISA方法对50份血清进行OD450值检测,计算平均值)和标准方差(SD),阴阳性临界值的判定为:大于等于+3SD)为阳性,小于为阴性[7]。
1.6 特异性试验
利用建立的ELISA方法,以FAdV-4阳性血清为阳性对照,阴性血清为阴性对照,PBS为空白对照,以检测阳性(经试剂盒鉴定)的NDV、IBV、IBDV、H5、H9、ALV、FAdV-8b血清为试验组,均设3个重复孔,验证该方法的特异性。
1.7 重复性试验
批内重复性检测:用制备的同一批次ELISA试剂盒检测5份FAdV-4阳性血清和2份FAdV-4阴性血清,每个样品3次重复,计算同一份血清样品OD450值得变异系数,确定间接ELISA方法的批内重复性。
批间重复性检测:对上述7份血清用不同批次的ELISA试剂盒进行检测,每个样品3次重复,计算同一份血清样品OD450值得变异系数,确定间接ELISA方法的批间重复性。
1.8 临床样品检测
利用建立的间接ELISA方法以阳性血清为阳性对照,以阴性血清为阴性对照,对30份疑似感染禽腺病毒4型鸡的血清进行检测,测定OD450值,同时利用PCR方法检测相应肝脏组织,比较这两种方法对FAdV-4感染的检出率,间接判断建立的间接ELISA方法的准确性。
1.9 稳定性检测
将同一批次试剂盒4℃保存,分别在6、12、18个月后再次鉴定新鲜的血清样品,检测结果同PCR方法检测相应肝脏组织比较,确定该试剂盒的保质期。
2 结果与分析
2.1 pET-30a(+)-Fiber-2重组蛋白的表达纯化与鉴定
以优化的含目的基因的pUC57-Fiber-2为模板,用无缝克隆引物扩增Fiber-2基因,经核酸电泳检测得到1 440 bp的条带(图1),胶回收得到纯化的目的片段。用无缝克隆试剂盒将目的片段和线性载体连接转化到表达菌,挑取5个菌落摇菌提质粒测序后与优化的Fiber-2序列进行比对,同源性为100%。将含重组质粒的BL21(DE3)菌液进行诱导表达后超声破碎,制备上清与沉淀两个样品做SDS-PAGE电泳,结果(图2)显示在上清与沉淀中均有重组蛋白的表达,蛋白分子量为60 kDa。考虑蛋白降解、变性、复性困难等因素,只将上清中表达的蛋白做纯化处理,蛋白纯度为90%,浓度为0.24 mg/mL。Western-Blot试验结果(图3)显示其免疫原性良好。
图1 优化的Fiber-2基因克隆结果

图2 SDS-PAGE分析重组蛋白上清纯化结果

图3 Western-Blot分析重组蛋白免疫原性
2.2 间接ELISA方法的建立
通过方阵优化法确定Fiber-2抗原最佳包被量为4μg/mL;最适宜包被条件为37℃包被1 h;最佳封闭液和封闭时间为0.5%BSA封闭1 h;待检血清最佳稀释度为1∶400,孵育时间为30 min;HRP标记的兔抗鸡二抗最佳孵育时间为30 min;最佳显色时间为10 min。
2.3 ELISA阴阳性临界值的确定
50份FAdV-4抗体阴性血清样品OD450值的平均值()为0.206,标准方差(SD)为0.038,根据公式得出阴阳性的临界值为0.320。因此,当待检血清样品OD450值≥0.320即可判为阳性。
2.4 特异性试验结果
如表1所示,间接ELISA方法测定的NDV、IBV、IBDV、H5、H9、ALV、FAdV-8b血清OD450值均小于0.32,为阴性,说明本试验建立的间接ELISA方法具有很好的特异性。

表1 特异性试验结果
2.5 敏感性试验结果
结果如表2所示,阳性血清按1∶6400稀释后结果仍为阳性,说明本试验建立的间接ELISA方法具有很好的敏感性。

表2 敏感性试验结果
2.6 批内与批间重复性试验结果
用建立的ELISA方法对5份FAdV-4阳性血清和2份FAdV-4阴性血清进行检测,结果(表3)表明,批内和批间变异系数均小于5%,表明本试验建立的间接ELISA方法具有很好的重复性。
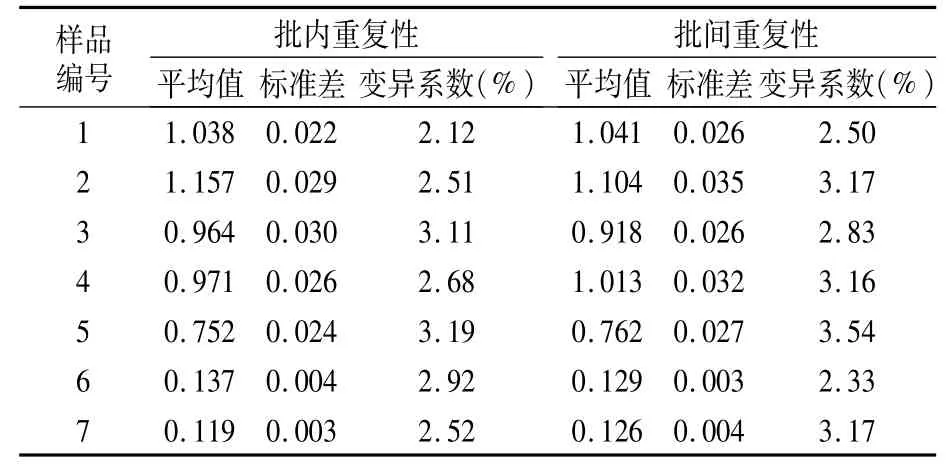
表3 重复性试验结果
2.7 临床样品检测结果
用建立的间接ELISA方法对30份疑似感染FAdV-4鸡的血清进行检测,结果显示28份血清阳性,2份血清阴性,与PCR鉴定结果完全一致,说明本试剂盒准确性高,结果可靠。
2.8 稳定性结果
在与PCR结果100%符合的条件下,4℃保存12个月的试剂盒结果仍可靠,证明其稳定性好,保质期长。
3 讨论与结论
新型FAdV-4自2015年在我国暴发以来,给禽养殖业带来了严重的危害,病鸡主要表现为心包内有积液,肝脏出血,虎斑肾。目前预防该疾病的疫苗是FAdV-4灭活苗,但是免疫效果不明显,还需要开发新型有效、成本低廉的疫苗[9]。检测鸡体内特异性抗体水平是评估疫苗免疫有效性的一个重要指标,酶联免疫吸附试验具有通量大、操作简便、结果易于判定的优点,并且高效的ELISA试剂盒可快速诊断疾病,净化种群。研制出准确度高的ELISA试剂盒是当前养鸡业和科学研究领域的迫切需求[10,11]。
杆状病毒表达系统表达的蛋白虽然具有最接近病毒的天然蛋白结构的优点,但操作程序繁琐,成本也较高[12]。大肠杆菌表达系统表达周期短、易于培养和操作,为了降低ELISA试剂盒的成本,需要用便宜、产量高的大肠杆菌表达系统表达目的蛋白[13,14]。
ELISA一般以全病毒或病毒相关蛋白、病原特异性抗体作为包被抗原或抗体,对血清抗体及抗原进行检测[15]。有文章指出,可用FAdV-4病毒作为包被抗原建立间接ELISA方法,但用全病毒包被增加了散毒的危险,不利于生物安全[16]。谢泉[17]利用Hexon蛋白作为包被抗原建立了间接ELISA方法,但阳性血清检出率不高,可能是Hexon蛋白对机体刺激性不够,未能产生相应抗原[18]。FAdV-4的短纤维蛋白是一种保护性抗原,具有诱导机体产生中和抗体的能力[19]。唐秋霞[5]比较了腺病毒4种免疫原蛋白的免疫原性,表明Fiber-2蛋白的免疫原性更高,和刘建勋等[20]的研究结果一致。
TMB作为底物与HPR作用后显蓝色,对人体安全,对光照条件的要求不高,故选TMB作为本方法的显色底物[21]。间接法ELISA检测方法使得信号放大,灵敏度高,而且对试剂要求小。本研究以原核表达的Fiber-2蛋白为包被抗原,建立了检测抗体的间接ELISA方法。该方法特异性强,可重复性好,保质期长,具有良好的稳定性和准确性,可用作商品化ELISA试剂盒应用于临床检测、诊断和科研中。

