铁质文物腐蚀产物β-FeOOH的产生及危害
张 然
(中国国家博物馆, 金属文物保护国家文物局重点科研基地(中国国家博物馆),北京 100079)
氯化物是引发铁质文物腐蚀,导致铁质文物不稳定的重要原因之一。确定氯化物的种类和性质,进而选择有效的方法进行控制、脱氯或转化处理,是铁质文物保护过程中的关键。四方纤铁矿(β-FeOOH)的晶体结构中可容纳氯离子,是铁质文物腐蚀产物中最常见的含氯腐蚀产物。1977年,在意大利Pianetto Forli的高卢墓葬出土的铁矛头、铁斧上发现β-FeOOH,这是文献记载的首次在铁质文物上发现β-FeOOH[1]。该铁器上存在“活性腐蚀区域”,在相对湿度较高的环境中该区域能不断产生新鲜的腐蚀产物。比较活性区域和非活性区域的腐蚀产物发现,活性区域含有β-FeOOH,而非活性区域没有,因此β-FeOOH能够促进铁质文物的腐蚀,其晶体具有隧道结构,隧道中含有Cl-,被释放出来对铁质文物造成腐蚀。自此之后,人们开始研究β-FeOOH在铁质文物腐蚀过程中的角色及其处理对策。大多数学者认为β-FeOOH是一种对铁质文物危害极大的腐蚀产物,是活性腐蚀的主要特征之一[1-3],是铁器出土后迅速损坏的主要原因[4-7],其生成过程与青铜器上发生的“青铜病”极为类似[8]。学者们称其为铁质文物的“有害锈”[9]、腐蚀的“催化剂”[10]、Cl-的“储蓄器”[5]等。但也有学者对此有不同认识。STÅHL等[11]认为β-FeOOH只是铁质文物在氯化物含量高的环境中的腐蚀特征,是腐蚀的结果而不是原因,其本身不会对铁质文物构成威胁。造成这种分歧的主要原因是不同方法、不同环境中产生的β-FeOOH,Cl-含量差别很大,而Cl-的存在形式也有明显区别。文献记载β-FeOOH中的Cl-质量分数从0.87%~17%不等[12]。β-FeOOH的晶体内部隧道结构中有Cl-,而晶体表面通常也吸附Cl-[13]。近年来同步辐射分析技术的应用证明了这两种Cl-的存在与区别[14-15]。因此,要进一步了解β-FeOOH对铁质文物的危害,应当区分两种不同的Cl-,分别研究其在腐蚀中的作用,进而提出相应的处理方法。
近年来,在沧州铁狮子[16]等室外铁器,天津、厦门、蓬莱、绥中、黄骅、海南、宁波、华光礁I号沉船等地海洋出水铁器[16-23]以及陕西、自贡、河南、深圳、济南、广西等地出土铁器[24-30]的腐蚀产物中均发现了β-FeOOH。因此,了解β-FeOOH的产生过程及其对铁质文物的危害,并进一步研究其腐蚀控制或转化处理的方法,对我国的铁质文物保护具有重要意义。
1 β-FeOOH的结构、氯含量和存在形式
1.1 β-FeOOH的晶体结构
图1是β-FeOOH的晶体结构[31],它与锰钡矿(BaMn8O16)的结构类似。早期的研究认为β-FeOOH和锰钡矿同属四方晶系[32-34],而近期的结构测定结果则表明它应当属于单斜晶系,I2/m空间群[11,35]。每个晶胞中都含有8个FeOOH。β-FeOOH中的阴离子按照体心立方排列,Fe3+位于八面体中心,周围是6个O2-或OH-离子,八面体共用边形成双链,双链与相邻链之间共用角,从而形成了一个向b轴方向延伸的三维双排八面体隧道型空穴结构[11,32-35]。
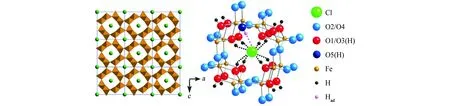
(a) 9个晶胞 (b) 隧道结构 图1 β-FeOOH的晶体结构[31]Fig. 1 Crystal structure of β-FeOOH: (a) 9 unit cells; (b) tunnel structure
隧道中只能容纳一排阴离子(通常是Cl-)。很多人认为这是维持β-FeOOH结构的重要因素[11,15,35-37]。根据估算,隧道的直径为0.35 nm,而Cl-的直径为0.36 nm,二者几乎相同[38]。Cl-周围的OH-指向Cl-,形成O-H…Cl的弱氢键[11,31,35]。尽管也有不含Cl-的β-FeOOH存在[39],但目前为止,在铁质文物锈蚀产物中发现的β-FeOOH几乎都含有Cl-。
Cl-是阴离子,因此β-FeOOH中需要额外的阳离子来平衡电性。研究表明,这里的阳离子只能是H+。H+与部分O2-结合为OH-。β-FeOOH内存在两种铁氧八面体[35,38],分别为FeO3(OH)3和FeO2(OH)4,后者多出的H+(图1中的Had[31])就是为了平衡Cl-电性的。在酸性溶液中,β-FeOOH会吸收HCl,而在碱性溶液中则会释放HCl。H+和Cl-等量进出β-FeOOH结构,而其他阳离子如Na+则无法进入β-FeOOH结构[31,40-41]。
1.2 β-FeOOH的氯含量和存在形式
β-FeOOH通常在Cl-含量较高的环境中生成。除隧道结构中的Cl-外,晶体表面通常也吸附Cl-。REGUER等[14-15]使用X射线吸收光谱(XAS)和X射线衍射(XRD)证明了Cl-的两种不同存在形式。
β-FeOOH晶体有纺锤状和棒状两种基本形态,这两种形态都是细长的形状。β-FeOOH的晶体尺寸非常小[11]:一般纺锤状β-FeOOH长度不超过0.5 μm,宽度不超过0.1 μm,比表面积为20~60 m2/g;棒状β-FeOOH长度约50 nm,宽度约6 nm,比表面积为100~150 m2/g[42]。较大的比表面积可以吸附较多的Cl-。
β-FeOOH中Cl-含量并不是固定的。合成的β-FeOOH中Cl-质量分数为0.87%~17.00%[12],而铁质文物锈蚀生成的β-FeOOH中Cl-质量分数通常在3.0%~14.8%[43]。Cl-含量与其形成过程、环境以及形成后的洗涤过程有关。CHAMBAERE等[36]发现,由0.06 mol/L FeCl3溶液制备的β-FeOOH中Cl-含量明显低于由0.1 mol/L FeCl3溶液制备的β-FeOOH中Cl-含量。β-FeOOH表面吸附的Cl-可以用水洗涤溶解掉。REGUER等[14-15]通过FeCl3水解制备β-FeOOH,经过不同次数的洗涤获得Cl-质量分数在4%~12%的多个β-FeOOH样品。
β-FeOOH的每个晶胞中有容纳2个Cl-的位置,因此理论上晶体内部Cl-含量最大时,相应化学式可表示为FeO0.75(OH)1.25Cl0.25[44]。但β-FeOOH的隧道结构中相邻的两个Cl-位置间距是0.30 nm,小于Cl-半径的两倍(0.36 nm)。因此,Cl-无法占据全部位置。近期的研究发现,β-FeOOH的隧道结构中Cl-通常占据隧道2/3的位置,而另外1/3则空着。Cl-在晶胞中的位置由(0,0,0)偏移至(0,0.11,0),使得相邻两个Cl-的距离为0.37 nm[11,35],相应的化学式可表示为FeO0.833(OH)1.167Cl0.167[11]。ELLIS等[37]推测隧道中Cl-只能沿隧道方向进出,不能突破隧道壁,取代它的其他离子从隧道一端进入,而Cl-从另一端脱出,且隧道内Cl-含量无法降低到2%以下;CHILDS等[38]估算隧道狭窄处直径只有0.27 nm,小于Cl-直径,因此隧道中的Cl-难以移动和脱除。
2 β-FeOOH在铁质文物腐蚀中的生成过程
β-FeOOH是海洋出水铁器的主要腐蚀产物之一,在出土铁器上也常有发现。它不是铁器最初的腐蚀产物,而是在铁器出土、出水接触空气后才大量生成的[5,45]。铁器上能够转化成β-FeOOH的腐蚀产物有FeCl2、FeCl3、FeOCl、Fe2(OH)3Cl、绿锈等。
2.1 氯化亚铁(FeCl2)水解氧化生成β-FeOOH
1982年,TURGOOSE[7,8,46]提出了铁质文物的腐蚀模型。在埋藏环境中铁质文物的主要含氯腐蚀产物为FeCl2,它以酸性溶液的形式集中在铁基体与锈层中间,以及锈层的孔洞、缝隙中。当铁质文物出土后,FeCl2在空气中发生氧化和水解,生成FeOOH,如式(1)所示。

(1)
反应生成的FeOOH可能是α-FeOOH、β-FeOOH或γ-FeOOH。FeCl2·4H2O晶体或高含量FeCl2溶液的氧化产物为纯β-FeOOH;而Cl-或Fe2+含量较低时,则有α-FeOOH、γ-FeOOH产生[47-49]。
该反应的进行需要水的参与,因此在一定湿度下才会发生。TURGOOSE[46]、WATKINSON和LEWIS[50-52]、THICKETT[6]等使用铁粉和FeCl2·4H2O进行混合,研究了湿度对该反应的影响。结果表明:在20 ℃,相对湿度(RH)低于18%时,氯化亚铁以FeCl2·2H2O形式存在,不会发生氧化;当RH大于20%时,氯化亚铁以FeCl2·4H2O形式存在,并发生氧化生成β-FeOOH;随着RH的提高,反应速率增大。
THICKETT等[6,43,53]还研究了各种因素对该反应的影响,发现空气污染物中的乙酸、甲酸、甲醛,土壤中的腐殖酸,锈层中的可溶性氯化物、CuCl,以及已生成的β-FeOOH都会对该反应有明显的促进作用,SO2、NO2的促进作用很轻微,而锈蚀产物中的α-FeOOH则有抑制作用。
FeCl2的氧化是铁器中β-FeOOH的主要生成途径[52],是铁器出土或出水后最关键的过程。铁粉和FeCl2混合生成β-FeOOH的过程与文物上β-FeOOH的生成过程比较相似[54],因此常用于模拟铁器上β-FeOOH的生成。当RH低于FeCl2的潮解点(约55%)时,氯化亚铁以FeCl2·4H2O晶体形式存在,氧化生成细长的β-FeOOH晶体;而RH高于FeCl2的潮解点时,FeCl2潮解形成溶液,通常以小液滴形式出现在铁器表面。液滴表面氧化,产生壳状的β-FeOOH[49,55]。
2004年,在山西蒲津渡4号铁人的臂弯处发现盐晶以柱状透明的形式从孔洞中钻出,形如“豆芽”,如图2(a)所示。经检测,该盐柱成分为FeCl2·4H2O,在空气中氧化后,由半透明白色转变为草绿色,如图2(b)所示,最终转变为棕褐色,如图2(c)所示,氧化产物为β-FeOOH[56]。THICKETT等[57-58]在新出土铁车轮框的腐蚀坑底部发现了FeCl2晶体,接触空气后其氧化为β-FeOOH。这是铁器上FeCl2氧化产生β-FeOOH的重要实例。在FeCl2的氧化过程中可能产生中间产物FeCl3、FeOCl。
2.2 三氯化铁(FeCl3)水解生成β-FeOOH
FeCl3水解产生β-FeOOH,这是实验室中制备β-FeOOH的主要方法[59],反应式如式(2)所示。

(a) 原始盐柱 (b) 氧化6 h后 (c) 氧化108 h后图2 蒲津渡铁人上的盐柱Fig. 2 Salt crystal pillars on iron man sculpture in Pujindu site: (a) original salt crystal pillars; (b) after oxidation for 6 h; (c) after oxidation for 108 h

(2)
含有氯化物的出土或出水铁器在湿度较高的环境中,表面会出现黄色至褐色的液滴,这种现象被称为“weeping”或“sweating”[2,4,10],在济南魏家庄出土铁釜[28-29]、山东齐国故城遗址博物馆馆藏汉代铁戟[60]、大英博物馆馆藏铁器[55]上均发现了这种现象,而液滴表面固态产物是β-FeOOH。早期人们认为液滴是FeCl3溶液[45,61],之后的研究表明溶液中Fe2+、Cl-、H+含量较高,Fe3+含量相对较低[4,7,62]。溶液主要成分是FeCl2,部分氧化为FeCl3,且氧化和水解产生盐酸,使溶液具有很强的酸性。
TURGOOSE[7-8]认为,在新出土铁器的孔洞、缝隙溶液中主要含有FeCl2,FeCl3可忽略不计。出土后,FeCl2按(1)式所示发生氧化,不断产生H+使溶液酸性增强。当酸性达一定程度后,能使锈层中原有的腐蚀产物溶解,生成FeCl3。他强调FeCl3的出现是锈蚀的结果而不是原因。
THICKETT等[57-58]发现,铁器上的FeCl2晶体在空气中暴露几天后会转变为FeCl3,随后转变为β-FeOOH。他们将铁片埋于含有NaCl和HCl的沙土中进行了模拟试验,发现铁片表面有浅黄色晶体,晶体边缘为暗棕色。检测表明,晶体中心为FeCl2,其外侧为 FeCl3,而棕色边缘为β-FeOOH[53]。GUGGENHEIMER[63]也发现,在氧气含量较低的环境中,铁粉/FeCl2混合物的氧化产物为FeCl3和β-FeOOH的混合物。这些研究结果都表明FeCl2先氧化生成FeCl3,随后水解为β-FeOOH。
2.3 氧基氯化铁(FeOCl)水解生成β-FeOOH
FeOCl为FeCl3初步水解的产物[64-65],见式(3),进一步水解则生成β-FeOOH[65-66],见式(4)。

(3)

(4)
20世纪70年代,FeOCl被一度认为是海洋出水铁器的主要含氯腐蚀产物[67],在盐矿等环境中的部分铁器上也检测出了FeCl2、FeCl3、FeOCl和β-FeOOH等多种含氯腐蚀产物[68-69]。但在20世纪80年代,ARGO[70]对铁器腐蚀产物分析后发现,样品中只有β-FeOOH而没有FeOCl。GILBERG等[45]指出,先前被认为是“FeOCl”的XRD谱峰实际上是Fe3O4、β-FeOOH或Fe3C的XRD谱峰,不能证明FeOCl的存在。TURGOOSE[7]也认为,FeOCl的合成都是在200 ℃以上高温中进行,在文物自然腐蚀过程中很难达到这么高的温度。但不排除FeOCl为腐蚀过程中间产物。WANG[49]发现,在铁片/FeCl2的腐蚀氧化过程中,FeOCl作为中间产物生成,随后转化为β-FeOOH。欧阳维真[65]对铁片进行了模拟闭塞电池的恒电流试验,在腐蚀产物中检测出FeOCl和β-FeOOH。在华光礁出水铁器腐蚀产物中也检测出FeOCl[66]。
2.4 碱式氯化亚铁Fe2(OH)3Cl氧化生成β-FeOOH
Fe2(OH)3Cl通常在含Fe2+、Cl-的弱酸性、中性溶液中产生[71]。RÉMAZEILLES等[72]绘制了Cl-活度为0.35(模拟海水)时Fe-H2O体系的E-pH图,见图3(图中实线为Cl-活度0.35,虚线为Cl-活度1.0)。由图3可见,在缺氧、弱酸性到中性(pH为6.0~7.5)的溶液中,当Fe2+活度达到0.01时Fe2(OH)3Cl是稳定物相,会被溶解氧氧化成β-FeOOH。
Fe2(OH)3Cl氧化产生β-FeOOH,见式(5)。从反应式上看,Fe2(OH)3Cl的氧化不一定需要水参与,在干燥空气中也可以进行,这与FeCl2的氧化有一定区别[33,45,71]。Fe2(OH)3Cl氧化为β-FeOOH的过程有两种方式:其一为快速氧化,无中间产物,适用固相重排机制;其二为溶液中的缓慢氧化,Fe2(OH)3Cl首先氧化生成绿锈GR(Cl-),再进一步氧化生成β-FeOOH,包含溶解-再结晶过程[48,73-75]。
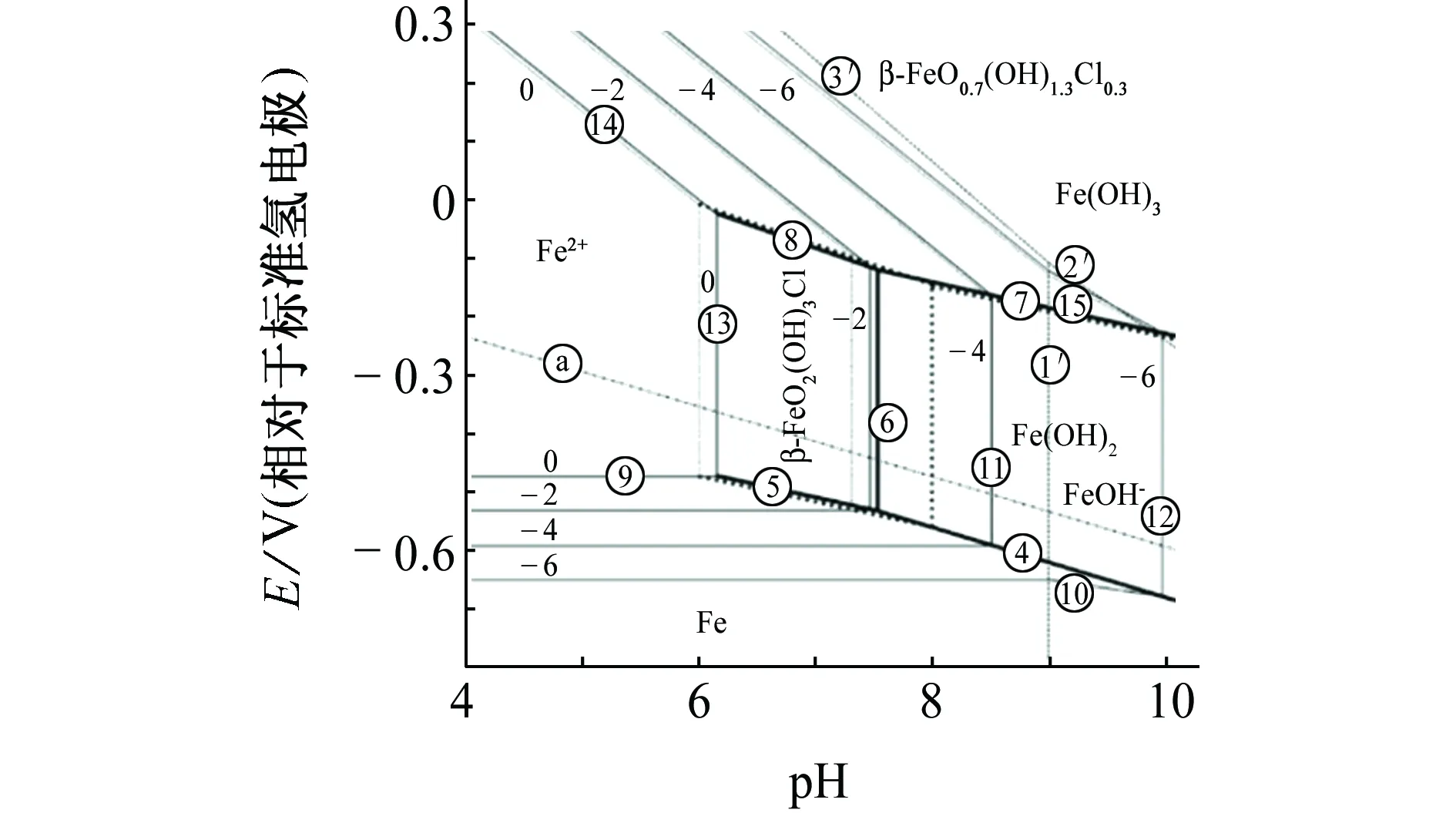
图3 氯化物溶液中Fe-H2O体系的E-pH图(25 ℃)[72]Fig. 3 E-pH diagram of Fe-H2O system in chloride aqueous solution (25 ℃)[72]

(5)
近年来,在法国的出土[76-78]、出水[72]铁器及英国出水[79]铁器上均发现了Fe2(OH)3Cl,其通常位于锈层内层或孔洞中,紧邻铁基体,是出土出水时的主要含氯腐蚀产物,而外层则是其氧化产物β-FeOOH,并未发现中间产物,因此推断Fe2(OH)3Cl的氧化过程为固相转化,主要发生于出土出水后干燥过程中[74-75]。当铁器在空气中保存一段时间后,Fe2(OH)3Cl会全部氧化为β-FeOOH[80]。
2.5 绿锈氧化水解生成β-FeOOH
绿锈(GR)是一系列既含有Fe(II)又含有Fe(III)化合物的统称,根据其所含的阴离子不同,可分为GR(Cl-)、GR(SO42-)、GR(CO32-)等。它的生成方式包括溶液中Fe2+氧化、Fe(OH)2或Fe2(OH)3Cl氧化、Fe2+与Fe3+混合溶液直接沉淀、金属铁的阴极极化等,在空气中绿锈会进一步氧化为FeOOH,其中只有GR(Cl-)氧化可能生成β-FeOOH[32,81-82]。
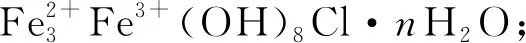
在溶液中,Fe2(OH)3Cl、GR(Cl-)的生成和氧化与Fe2+、Cl-、OH-含量有关。在不同含量FeCl2和NaOH混合溶液中,OH-的起始浓度为0.4 mol/L,Cl-和Fe2+浓度比为2时,改变R′值,见式(6),产生不同的中间产物及最终产物,见图4[83]。当R′≥1.40时,Fe2(OH)3Cl生成;R′≥1.10时,GR(Cl-)生成;只有当R′>1.75时,最终产物中才有β-FeOOH。随着R′增大,产物中β-FeOOH比例上升,当R′>8时最终产物为纯β-FeOOH[48,73,74,83-84]。
R′=[Cl-]/[OH-]=2[FeCl2]/[NaOH]
(6)
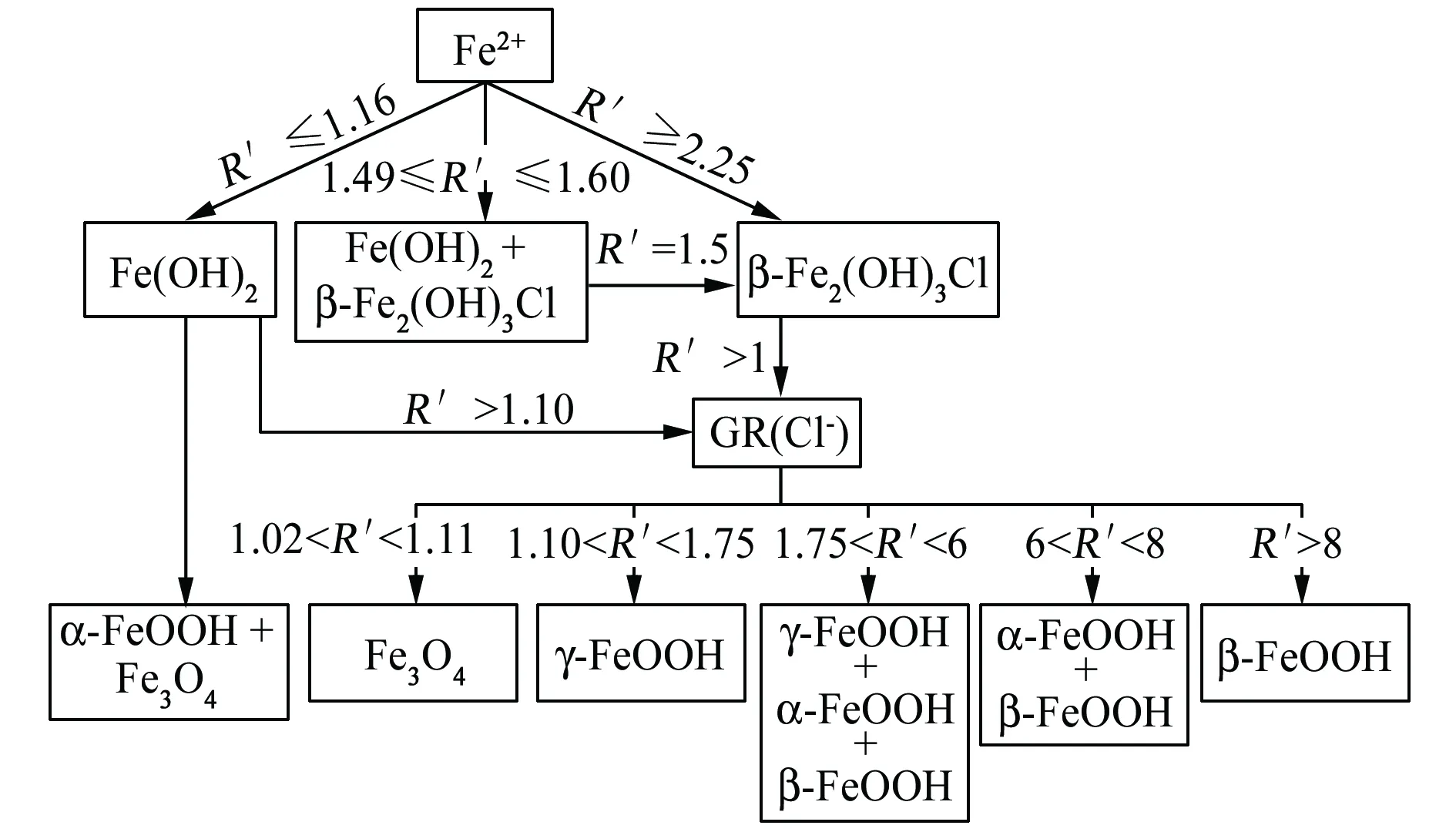
图4 在含Cl-溶液中Fe2+氧化过程及相形成[83]Fig. 4 Oxidation process and phase formation of ferrous ion in chloride medium[83]
Fe2+含量同样对氧化产物有影响。当Cl-浓度为3.2 mol/L,OH-浓度为0.4 mol/L时,若Fe2+浓度为1.6 mol/L,则最终产物为纯β-FeOOH;而当Fe2+浓度为0.3 mol/L时,则产物为α-FeOOH和γ-FeOOH。因此,溶液中高浓度的Fe2+和Cl-都是产生β-FeOOH 的必要因素[48]。
综上所述,在铁质文物腐蚀过程中,β-FeOOH的生成途径见图5。它可由FeCl2水解氧化生成(过程中可能有中间产物FeCl3、FeOCl),也可由Fe2(OH)3Cl氧化生成(过程中可能有中间产物绿锈),其生成环境中需有较高含量的Cl-和Fe2+,因此通常在铁器点腐蚀、缝隙腐蚀区域生成。
3 β-FeOOH对铁质文物的危害
Cl-是促进铁质文物腐蚀,导致其损坏的重要因素。作为铁质文物出土出水后的主要含氯腐蚀产物,β-FeOOH通常被认为是一种对铁质文物危害极大的有害锈。其对铁质文物产生危害的主要原因在于β-FeOOH晶体的生长,β-FeOOH作为反应物参与腐蚀过程,以及β-FeOOH中的Cl-。β-FeOOH表面吸附的Cl-和晶体隧道结构中的Cl-在腐蚀中的作用有明显区别[85],因此有必要分开讨论。
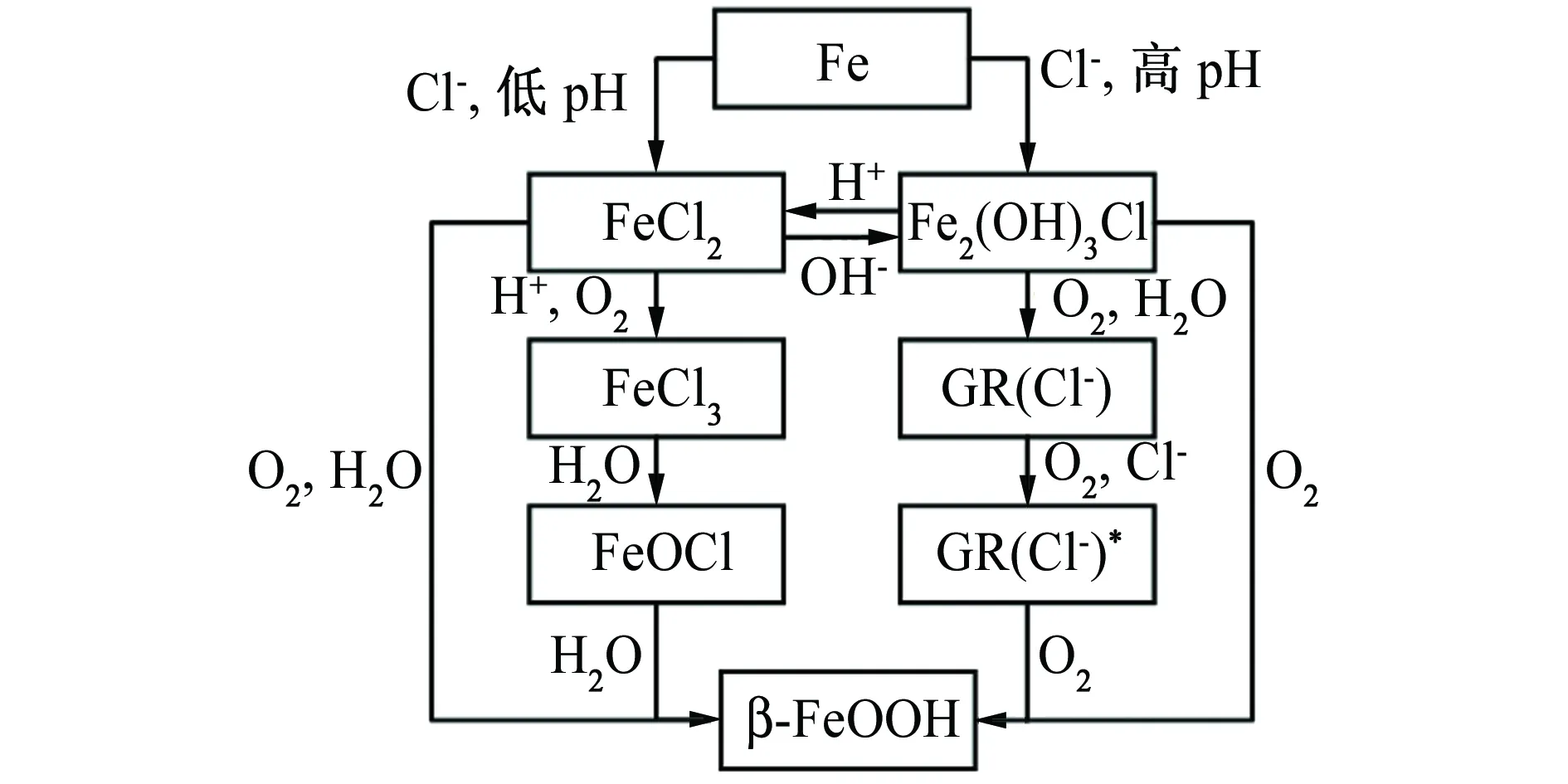
图5 β-FeOOH在铁质文物腐蚀中的生成途径Fig. 5 The formation pathway of β-FeOOH in corrosion of iron cultural relics
3.1 β-FeOOH晶体的生长
β-FeOOH晶体通常为细长针状结构,密度较低。1 mol β-FeOOH的体积约为25 cm3,这大约是1 mol金属铁的3倍[86], 因此其生长过程也是体积剧烈膨胀的过程。出土铁器中的FeCl2以溶液形式存在于锈层孔洞、缝隙中,当接触空气后迅速氧化水解产生β-FeOOH,给锈层造成压力,导致锈层出现层状剥离、裂缝甚至断裂。这是铁器出土后迅速损坏的主要原因[4,7,8,46,87]。
THICKETT[6]调研了284件铁质文物的损坏原因,发现其中78%的主要损坏原因是β-FeOOH生长;PINGITORE等[88]对克罗托内国家考古博物馆20年前修复的一批铁质文物进行调研,结果发现β-FeOOH往往在铁基体与锈层中间产生,这导致了铁质文物在修复后仍然会快速损坏。
3.2 β-FeOOH作为反应物参与腐蚀过程
在潮湿的大气环境中,β-FeOOH在腐蚀过程中可以作为阴极去极化剂,接受电子并和Fe2+反应生成Fe3O4[65,89-91],如式(7)所示。在缺氧环境中,β-FeOOH也会直接与Fe2+反应生成Fe3O4,如式(8)所示。其反应机制为溶解-再结晶。在α、β、γ三种FeOOH中,β-FeOOH溶解度最大,发生此反应的转化率也最高,经常在铁质文物腐蚀过程中发生,这是含氯环境中Fe3O4在铁质文物的锈蚀产物中含量高的原因之一[92]。

(7)

(8)
3.3 β-FeOOH晶体表面吸附的Cl-
ZUCCHI等[1]早在1977年首次在铁质文物上发现β-FeOOH时就提出,β-FeOOH释放出Cl-是铁器加速腐蚀的原因,GILBERG等[45]也持此观点,但他们并没有区分β-FeOOH晶体表面吸附的Cl-和隧道结构中的Cl-。近年来的研究表明,晶体表面吸附的Cl-才是促进出土、出水铁质文物腐蚀的主要原因。
β-FeOOH晶体表面除吸附Cl-外,也会吸附H+,从而使表面部分质子化[93-94]。由式(1)~(5)可发现,β-FeOOH的生成伴随着HCl的生成。HCl部分进入β-FeOOH的隧道结构,当隧道中的HCl达到饱和后,多余的HCl吸附在β-FeOOH晶体表面[95]。因此β-FeOOH表面吸附的Cl-对铁质文物的危害主要有以下几点[7,8,46]:
HCl作为强酸,可造成铁锈层的局部溶解,使其强度下降,裂缝增大,且同等pH下,HCl比其他酸更容易溶解铁锈。
HCl会直接腐蚀铁基体,如式(9)所示。将式(1)和式(9)相加,得式(10)。由式(10)可以看出,Cl-在反应过程中实际起到催化剂的作用,HCl不断消耗又不断重新生成,因此这一过程被称为“酸再生循环”过程[96]。这一过程也是铁质文物出土、出水后损坏的原因,如果不对其进行干预,可持续发生直至铁器损毁[10]。

(9)

(10)
β-FeOOH具有明显的吸湿性,可降低腐蚀发生所需的相对湿度。水分子通过氢键和弱电荷转移作用吸附在晶体表面[97]。WATKINSON等[50-52,98]发现,β-FeOOH的吸湿性与表面Cl-有关,未清洗的β-FeOOH即使在低湿度下也有明显的吸湿性,使表面形成富含HCl的电解质溶液,15%的RH就可造成铁粉腐蚀,RH在20%以上时则腐蚀明显加速,且同等RH下,β-FeOOH比FeCl2对铁粉腐蚀的促进作用更明显。只有将RH降至12%以下,腐蚀才不会发生。THICKETT等[6,43]进一步研究发现,β-FeOOH生成时湿度越高,其对腐蚀的促进越明显。例如,β-FeOOH在RH为80%条件下生成,其与铁粉、FeCl2混合后,即使将RH降低至13%,铁粉依然会发生腐蚀。
HCl具有挥发性,可能会对附近的其他金属器造成腐蚀。WATKINSON等[52,98]在试验时偶然发现,和β-FeOOH样品处于同一密闭空间内但未与其接触的不锈钢药匙和铝箔均发生了腐蚀,并生成含氯产物,他们认为这是β-FeOOH表面HCl挥发造成的。
3.4 β-FeOOH晶体隧道结构中的Cl-
相比晶体表面吸附的Cl-,隧道结构中的Cl-难以移动和释放。因此很多学者认为,它不会促进铁质文物的进一步腐蚀[11,15,75]。随着β-FeOOH的生成,游离的Cl-进入隧道结构,铁质文物的腐蚀速率下降,最终达到基本稳定,即腐蚀速率很低的状态[46]。虽然,对铁质文物进行脱氯处理难以将β-FeOOH隧道结构中的Cl-全部脱除,但残余Cl-也不会造成危害[99]。
WATKINSON等[52,98,100]发现,在RH为80%条件下,自制β-FeOOH使铁粉发生明显腐蚀;而将β-FeOOH用水清洗后,其成分仍为纯β-FeOOH,且含有2.0%~2.5%的Cl-,但其吸水性明显减弱,铁粉的腐蚀速率也明显降低,腐蚀接近停止。
如果β-FeOOH转化为其他晶型(如α-FeOOH),则其隧道结构中的Cl-会被释放,促进铁器腐蚀。GILBERG等[45]认为相对于α-FeOOH,β-FeOOH是亚稳定的,容易转化。COOK等[101]发现,在海洋大气环境中,短期暴露钢片表面有β-FeOOH,长期暴露钢片表面却没有,这是因为在长期暴露过程中β-FeOOH发生了转化。但WATKINSON等[50,52,98]经过试验发现,在密封玻璃瓶中保存23 a后,纯β-FeOOH样品的成分未发生变化。
环境中的酸性污染气体也会促进β-FeOOH的溶解[9]。THICKETT等[6,43,53]通过调研和试验发现,合成的β-FeOOH和铁质文物样品上的β-FeOOH都会缓慢的转化为α-FeOOH,湿度越高转化越快,而乙酸对转化有明显的促进作用。当β-FeOOH转化为α-FeOOH时,β-FeOOH隧道结构中的Cl-被释放出来,促进腐蚀,影响铁器的长期稳定性。
在高温下,β-FeOOH会脱水转化为α-Fe2O3,同时释放出HCl。STÅHL等[11]认为该反应在200 ℃以下不会发生。THICKETT[6]在一个38 a前从铁器上取下的β-FeOOH样品上发现了β-FeOOH向α-Fe2O3的转变,并认为常温下该反应也会发生,虽然反应缓慢,但不可忽略。
4 结论
β-FeOOH是铁质文物腐蚀损坏过程中的关键腐蚀产物。它既是铁质文物在(局部)高含量氯化物作用下的结果,又是造成铁质文物进一步持续腐蚀的原因。β-FeOOH往往在铁质文物出土、出水后由FeCl2、Fe2(OH)3Cl等中间产物氧化水解生成,其过程与青铜器表面发生的“青铜病”类似,对铁质文物造成物理、化学两方面的损害。β-FeOOH的晶体表面和隧道结构中都有Cl-(HCl)。晶体表面吸附的Cl-会直接促进铁质文物腐蚀,并使腐蚀循环发生;虽然隧道结构中的Cl-相对稳定,不会直接参与腐蚀过程,但也难以脱除,在环境因素影响下β-FeOOH转变为其他物相而被释放,从而促进腐蚀,因此在铁质文物的长期保存过程中仍是隐患。
因此,对含有β-FeOOH的铁质文物进行有针对性的保护处理,是铁质文物保护中的关键步骤,也是铁质文物保护研究中的关键问题。目前主要有两种思路:一是预防性保护,即通过控制温度、相对湿度、氧气含量等环境因素阻止β-FeOOH的产生并阻止已生成的β-FeOOH对铁质文物的腐蚀;二是干预性保护,即脱除β-FeOOH中的氯离子甚至将其转化为其他物相,以消除其对铁质文物的威胁。近年来相关研究亦有大量成果,将另行撰文综述。

