MC1R过表达重组腺相关病毒的构建及对小鼠长期记忆的影响
王晓兵 龚志婷 姜乐 马文豪 贺尔姝 郑晓烨 张本斯 张丽梅



摘要:目的:构建携带MC1R基因的重组腺相关病毒并探究小鼠海马齿状回中过表达MC1R基因对小鼠长期记忆的影响。方法:获取小鼠目的基因MC1R。使用限制性内切酶EcoRI和HindIII双酶切AAV载体质粒pAAV-CaMKIIα-eGFP-Dnmt3a及目的基因,使用T4DNAligase进行连接,连接产物转化stbl3感受态细胞并筛选阳性克隆pAAV-CaMKIIα-eGFP-MC1R,并进行测序验证。将构建的pAAV-CaMKIIα-eGFP-MC1R、PAAV-DJ/8、pHelper质粒转染至HEK293T细胞进行病毒包装及纯化并利用Q-PCR检测病毒滴度。纯化后的病毒通过立体定位注射到小鼠海马齿状回中,表达14天以上后,验证该病毒是否能够提高小鼠海马区的MC1R基因表达,并检测小鼠在旷场实验及条件性恐惧实验中的行为学改变。结果:rAAV-CaMKIIα-eGFP-MC1R过表达病毒构建成功,滴度约为1.1*1010,立体定位注射到小鼠海马齿状回中至少14天后小鼠海马齿转回中能表达绿色荧光蛋白,并能显著提高小鼠海马中MC1R基因的表达。进一步的,过表达MC1R基因对小鼠旷场实验中的自发活动、焦虑状态均无影响,但显著提高条件性恐惧实验中的僵立水平。结论:本研究成功构建了重组腺相关病毒rAAV-CaMKIIα-eGFP-MC1R,通过立体定位注射,该病毒显著提高小鼠海马齿状回中MC1R基因的表达,并增强小鼠的长期记忆。我们的结果说明MC1R基因可能是一个记忆损伤类疾病如阿尔兹海默症的一个潜在治疗靶点。
关键词:MC1R;腺相关病毒;海马齿状回;
【中图分类号】G644.5 【文献标识码】A 【文章编号】2107-2306(2021)12--03
前言:黑素皮质素1受體(MC1R)是一种环腺苷单磷酸刺激g蛋白偶联受体(GPCR)[1-4],同时是MSH(α、β、γ)和ATCH的受体[1,2,5-7],调节黑色素的形成,通过控制cAMP信号从而影响黑色素细胞,通过黑色素合成途径调节皮肤生理。研究发现MC1R基因的改变与阿尔兹海默症、帕金森病有密切的相关性,最新研究表明,激活MC1R在不同的通路中可以减轻IHC所致的神经炎症、在自身免疫性脑脊髓炎(EAE)小鼠模型中发挥神经保护作用、以及减弱蛛网膜下腔出血的症状。WeilinXu等人发现,在IHC后的小胶质细胞、星形胶质细胞、表皮细胞中均有表达,并且通过激活MC1R可以减少小胶质细胞的数量。以上实验均表明,黑素皮质素-1受体(MC1R)不仅与神经系统疾病密切相关,并且MC1R的激活在几种神经疾病中均有明显的抗炎和神经保护作用。Genecard数据库中表明MC1R在神经系统中尤其是大脑中的表达水平较高,但是在大脑中明确的生理功能以及作用机制并不清楚。由于以上众多的研究已经证明MC1R在大脑、脊髓中都有发挥作用,本研究采用腺相关病毒PAAV,构建含有小鼠MC1R基因的腺相关病毒载体(rAAV-CaMKIIα-eGFP-MC1R),通过感染小鼠大脑海马齿状回区域,验证MC1R基因的表达效果,为MC1R相关疾病,可能是包括阿尔兹海默症在内的长期记忆损伤等相关疾病提供治疗靶点。
一、材料与方法
(一)材料
大肠杆菌DH5α、Stbl3感受态购自康体生命公司;重组腺病毒构建系统(DJ/8包装系统)购自CELLBIOLABs公司(美国)、HEK293T细胞由中国科学院深圳先进技术研究院李红昌课题组惠赠;EcoRI、HindIII酶,T4DNA连接酶,TaqDNA聚合酶、DMEM/HighGlucose培养基、胰酶、胎牛血清、青霉素、链霉素等购自ThermoFisherScientific公司(美国);RNA提取试剂盒购自生工;逆转录试剂盒购自promega公司(美国);质粒DNA提取试剂盒购、AAV纯化试剂盒购自biomiga公司(美国);小鼠脑立体定位仪购自瑞沃德公司;冰冻切片机购自ThermoFisherScientific公司(美国);旷场、条件恐惧、软件及硬件均购自上海欣软公司。
(二)实验方法
1.目的基因的获取
腹腔注射水合氯醛麻醉C57小鼠后,灌注取脑,使用trizol提取的方法快速抽提总RNA,按照promega公司的逆转录试剂盒说明书使用所提取的总RNA逆转录为cDNA。
2.重组腺相关病毒(rAAV)表达载体pAAV-CaMKIIα-eGFP-MC1R的构建
PCR纯化产物和pAAV-CaMKIIα-eGFP-Dnmt3a(自己构建)使用EcoRI和HindIII在37℃水浴中进行双酶切,pAAV-CaMKIIα-eGFP-Dnmt3a所得酶切大片段,和PCR酶切所得目的基因在T4DNA连接酶的作用下连接22℃、2小时,所得连接产物转化stbl3感受态(连接产物),冰浴后放入无抗LB培养基复苏,复苏完成后,取适量已转化好的的感受态细胞涂抹于Amp+药液的LB平板上37℃培养过夜,24小时后挑选阳性单克隆的单个菌落,接种于含Amp+药液的培养液中培养24小时,提取质粒进行酶切鉴定,鉴定大小正确的质粒样品送到华大基因进行测序。
3.pAAV-CaMKIIα-eGFP-MC1R腺相关病毒的包装、纯化和滴度测定
首先,将携带目的MC1R基因的重组质粒pAAV-CaMKIIα-eGFP-MC1R、pAAV-DJ/8、pHelper,分别转化大肠杆菌感受态Stbl3,使用biomiga的质粒大提试剂盒进行质粒提取后用于病毒包装,使用高效转染试剂盒,将大提所得质粒pAAV-DJ/8,pHelper,以及pAAV-CaMKIIα-eGFP-MC1R按照1:1:1.5的比例转染至HEK293T细胞接种于10cm培养皿中,4-6小时后更换新鮮的完全培养基,48小时后,转染72小时后收细胞,按照biomigaAAV纯化试剂盒的方法纯化出腺相关病毒rAAV-CaMKIIα-eGFP-MC1R,采用荧光定量PCR(qPCR)的方法检测所得病毒溶液中包含目的片段的拷贝数,进而推知单位体积内有效病毒颗粒数,得出滴度。
qPCR引物序列如下:
AAVtest-F:5’-CGCAGCGTCACACAGAAG-3’
AAVtest-R:5’-GCAGGGTTGACAATGGAGAG-3’
4.rAAV-CaMKIIα-eGFP-MC1R功能鉴定
取C57/BL6小鼠放入麻醉箱用异氟烷麻醉,麻醉后,将小鼠放入脑立体定位仪的操作台上,用耳杆固定,后进行调平,用5微升量程33G针头的微量注射器(汉密尔顿)注射病毒,采用微量注射泵(上海欣软)控制注射速度。使用以下坐标将病毒注射到海马的dDG中,Bregma:AP=-2.1毫米;ML=±1.4毫米;DV=-1.9毫米。注射速度为150nl/min,rAAV-MC1R及AAV-GFP均为0.8~1.0μl,注射针保持在注射位置至少180秒,以允许病毒充分扩散。病毒表达至少14天后,进行行为学实验。
5.条件恐惧实验
实验开始前,所有小鼠从饲养间移出至行为学实验室,在实验室的适应间内至少放置1hr,实验开始后小鼠没有适应时间直接电击2s,间隔2min后再给与2s的电刺激,刺激结束1min后取出小鼠。一天后recall,放入同样的环境记录freezing值,实验最终将统计小鼠freezing时间占总时间的百分比。
二、结果
(一)目的基因的获取
结合primerblast程序设计引物,
上游引物:5-gaattcatgtccactcaggagccccagaagagtc-3’,
下游引物:5’-aagctttcaccaggagcacagcagcacctcc-3’,通过上海生工生物公司合成后,使用所提取的cDNA为模板进行PCR扩增得到目的基因,得到940bp左右的条带(见图1)
(二)线性化载体pAAV-CaMKIIα-eGFP-dnmt3a的双酶切
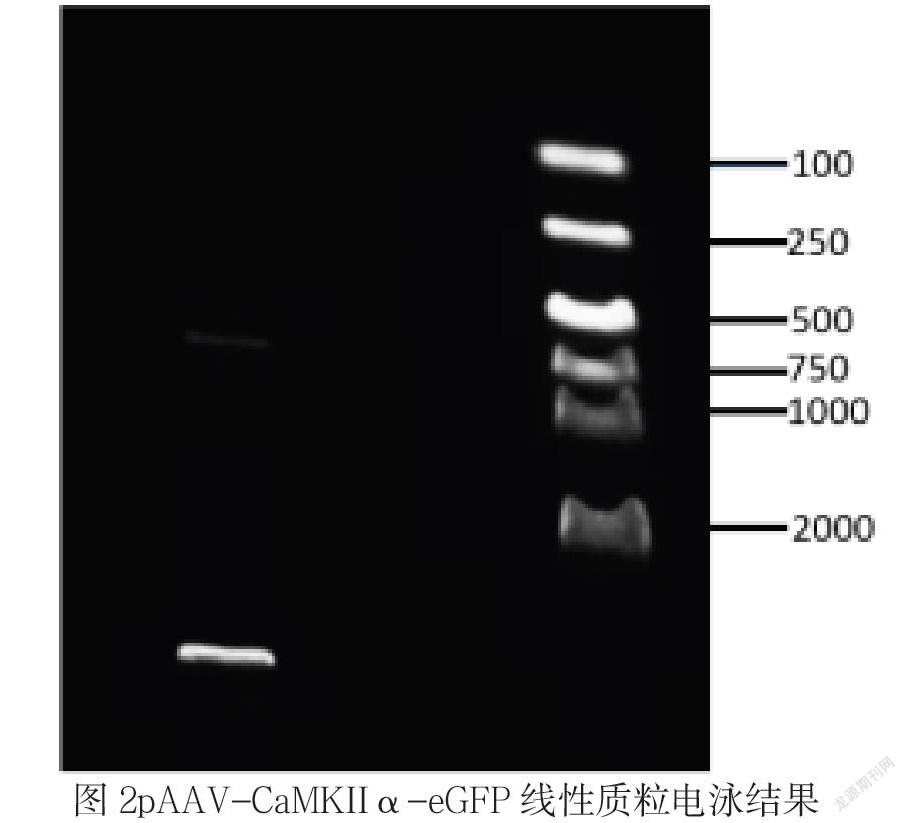
pAAV-CaMKIIα-eGFP-Dnmt3a(自己构建PMID29572461)使用EcoRI和HindIII在37℃水浴中进行双酶切,得到线性化质粒pAAV-CaMKIIα-eGFP(如图2)
(三)质粒酶切后鉴定结果
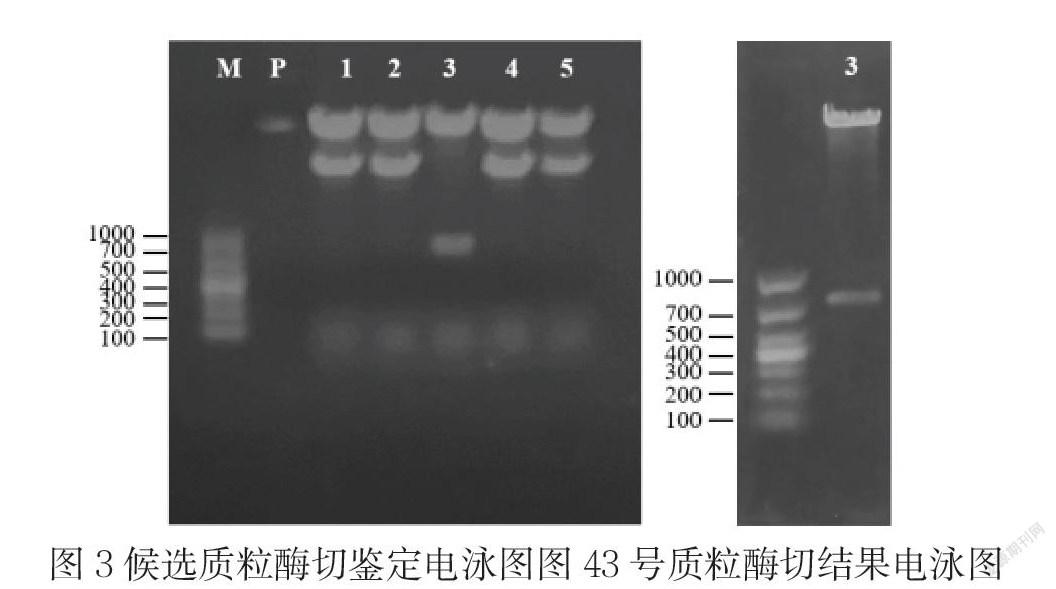
我们预选了5个候选质粒,进行酶切鉴定,其中只有3号质粒可以切出目的条带,进一步对3号质粒酶切结果进行电泳,确定条带大小正确后送华大基因测序(如图3、4)
(四)pAAV-CaMKIIα-eGFP-MC1R载体的构建
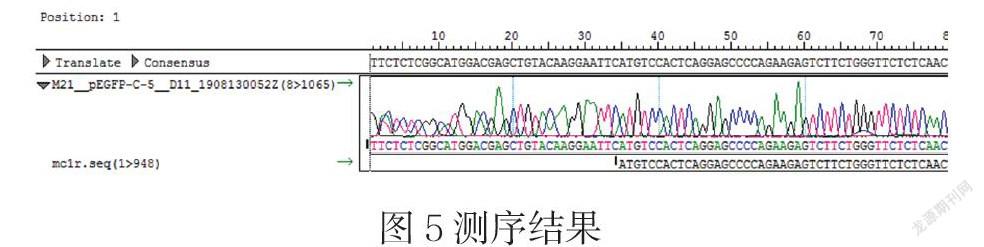
DNAMAN分析pAAV-CaMKIIα-eGFP-MC1R质粒中的MC1R基因序列与NCBI中提供的MC1R序列一致,(见图5),表明pAAV-CaMKIIα-eGFP-MC1R载体构建成功。
(五)pAAV-CaMKIIα-eGFP-MC1R包装、扩增及滴度测定
将制备的重组质粒pAAV-CaMKIIα-eGFP-MC1R转染293T细胞后,换液48小时后进行收病毒,取病毒浓缩液提取病毒DNA,进行Qpcr检测病毒滴度。
pAAV-CaMKIIα-eGFP-MC1R滴度为1.1*1010(见图6、7)
(六)rAAV-CaMKIIα-eGFP-MC1R功能鉴定
将构建成功的rAAV-CaMKIIα-eGFP-MC1R感染小鼠大脑海马齿状回,表达至少14天后,提取总RNA,Qpcr验证MC1R过表达成功,结果见图9、10(UnpairedttestPvalue<0.0001t,dft=7.831df=18)
小鼠大脑海马齿状回小鼠海马齿状回内的过表达结果
(七)条件恐惧结果
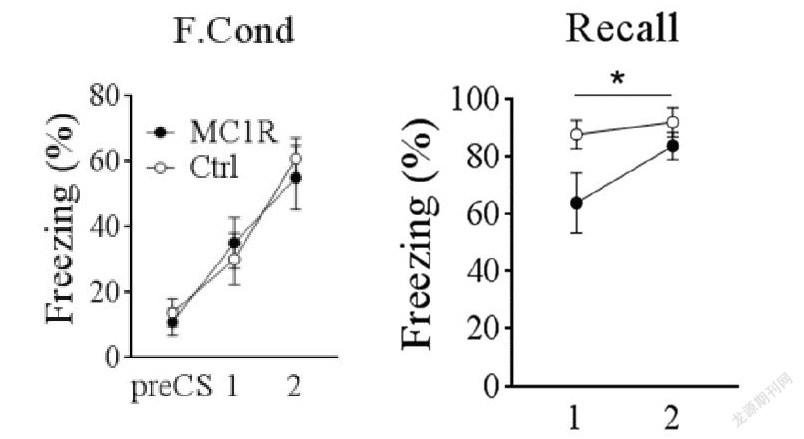
在条件恐惧实验中我们通过测试小鼠freezing值发现rAAV-CaMKIIα-eGFP-MC1R小鼠与对照组小鼠相比,如图8所示freezing值(n=6,6;Unpairedt-test,p=0.05)如图8所示(n=6,6;),说明rAAV-CaMKIIα-eGFP-MC1R小鼠记忆增强。
讨论:MC1R基因此前是作为控制动物毛色的基因存在,主要通过cAMP信号影响黑色素细胞的功能。自2001年来,MC1R在黑色素瘤、细胞生长和死亡、P53信号通路、DNA复制方面均有影响和作用。在神经系统中,脑出血后,通过NDP-MSH激活MC1RCREB/Nr4a1/NF-κB通路,可以减轻脑出血所致的神经炎症,以及血脑屏障的损伤。黑皮质素1受体的激活通过大鼠AMPK/TBK1/NF-κB通路抑制神经炎症,减轻蛛网膜下腔出血等早期脑损伤,。黑皮质素1受体通过AMPK/SIRT1/PGC-1α通路控制线粒体代谢减轻蛛网膜下腔出血后的早期脑损伤。用BMS-470539激活MC1R通过cAMP/PKA/Nurr1通路减轻大鼠新生儿缺氧缺血性脑损伤后的神经炎症。因此,在此基础上,我们提出MC1R可能会成为神经退行性变疾病领域新的治疗靶点。
近年來,MC1R基因被发现在神经系统中的作用越来越广泛,并且分子医学已经成为了近年来研究的热点,相对而言,重组腺相关病毒(rAAV)载体具有非致病性、广泛的组织嗜性和长期转基因表达等特点,被认为是最有发展前景的基因治疗载体。本文借助重组腺相关病毒为介导,成功构建了rAAV-CaMKIIα-eGFP-MC1R、以及rAAV-CaMKIIα-eGFP对照病毒,并在小鼠海马齿状回特异性表达MC1R基因,不仅能应用于科学研究,在将来的基因治疗中也有潜力。
在rAAV-CaMKIIα-eGFP-MC1R构建过程中,我们首先将小鼠MC1R基因定向克隆至pAAV-CaMKIIα-eGFP载体形成pAAV-CaMKIIα-eGFP-MC1R重组质粒,经测序后转染至293t细胞,经扩增收毒、纯化及浓缩后测定病毒滴度,感染小鼠大脑海马齿状回进行rAAV-CaMKIIα-eGFP-MC1R功能鉴定,Qpcr验证MC1R过表达成功,说明rAAV-CaMKIIα-eGFP-MC1R构建成功。后期我们通过旷场进行筛查,发现注射腺相关病毒的小鼠并没有表现出活动能力及探索能力的障碍以及出现焦虑样行为,我们认为病毒的注射并不会影响小鼠的探索、运动能力以及小鼠焦虑样行为;小鼠进行contextualfear条件恐惧实验时,表现出了明显的记忆提高,此实验结果说明,MC1R通过rAAV-CaMKIIα-eGFP-MC1R病毒载体,在大脑海马齿状回的高表达可能会成为阿尔兹海默症等神经退行性疾病的治疗靶点。
参考文献:
[1] MOUNTJOYKG,ROBBINSLS,MORTRUDMT,etal.Thecloningofafamilyofgenesthatencodethemelanocortinreceptors[J].Science(NewYork,NY),1992,257(5074):1248-51.
[2] JIMéNEZ-CERVANTESC,GERMERS,GONZáLEZP,etal.Thr40andMet122arenewpartialloss-of-functionnaturalmutationsofthehumanmelanocortin1receptor[J].FEBSletters,2001,508(1):44-8.
[3] NAKAYAMAK,SOEMANTRIA,JINF,etal.Identificationofnovelfunctionalvariantsofthemelanocortin1receptorgeneoriginatedfromAsians[J].Humangenetics,2006,119(3):322-30.
[4] PéREZ-OLIVAAB,OLIVARESC,JIMéNEZ-CERVANTESC,etal.Mahoguninringfinger-1(MGRN1)E3ubiquitinligaseinhibitssignalingfrommelanocortinreceptorbycompetitionwithGalphas[J].TheJournalofbiologicalchemistry,2009,284(46):31714-25.
[5] GANTZI,KONDAY,TASHIROT,etal.Molecularcloningofanovelmelanocortinreceptor[J].TheJournalofbiologicalchemistry,1993,268(11):8246-50.
[6] CHHAJLANIV,WIKBERGJE.MolecularcloningandexpressionofthehumanmelanocytestimulatinghormonereceptorcDNA[J].FEBSletters,1992,309(3):417-20.
[7] JIMéNEZ-CERVANTESC,OLIVARESC,GONZáLEZP,etal.ThePro162variantisaloss-of-functionmutationofthehumanmelanocortin1receptorgene[J].TheJournalofinvestigativedermatology,2001,117(1):156-8.
[8] OZDESLIKRN,OLINSKILE,TRIEUMM,etal.Humannonvisualopsin3regulatespigmentationofepidermalmelanocytesthroughfunctionalinteractionwithmelanocortin1receptor[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2019,116(23):11508-17.
[9] TELL-MARTIG,PUIG-BUTILLEJA,POTRONYM,etal.ACommonVariantintheMC1RGene(p.V92M)isassociatedwithAlzheimer'sDiseaseRisk[J].JournalofAlzheimer'sdisease:JAD,2017,56(3):1065-74.
[10] XUW,MOJ,OCAKU,etal.ActivationofMelanocortin1ReceptorAttenuatesEarlyBrainInjuryinaRatModelofSubarachnoidHemorrhageviatheSuppressionofNeuroinflammationthroughAMPK/TBK1/NF-κBPathwayinRats[J].Neurotherapeutics:thejournaloftheAmericanSocietyforExperimentalNeuroTherapeutics,2020,17(1):294-308.
[11] XUW,YANJ,OCAKU,etal.Melanocortin1receptorattenuatesearlybraininjuryfollowingsubarachnoidhemorrhagebycontrollingmitochondrialmetabolismviaAMPK/SIRT1/PGC-1αpathwayinrats[J].Theranostics,2021,11(2):522-39.
[12] WUX,FUS,LIUY,etal.NDP-MSHbindingmelanocortin-1receptoramelioratesneuroinflammationandBBBdisruptionthroughCREB/Nr4a1/NF-κBpathwayafterintracerebralhemorrhageinmice[J].Journalofneuroinflammation,2019,16(1):192.
[13] YUS,DOYCHEVADM,GAMDZYKM,etal.ActivationofMC1RwithBMS-470539attenuatesneuroinflammationviacAMP/PKA/Nurr1pathwayafterneonatalhypoxic-ischemicbraininjuryinrats[J].Journalofneuroinflammation,2021,18(1):26.
[14] RANG,CHENX,XIEY,etal.Site-DirectedMutagenesisImprovestheTransductionEfficiencyofCapsidLibrary-DerivedRecombinantAAVVectors[J].MoleculartherapyMethods&clinicaldevelopment,2020,17:545-55.
基金項目:国家自然科学基金项目:《小鼠海马背侧齿状回中的Dnmt3a表达调控恐惧记忆更新的机制探究》;项目编号:(No.81960255);云南省基础研究专项云南省基础研究项目-青年项目《Dnmt3a在早期应激所致抑郁中的作用和机制研究》;项目编号:No.202001AU070051;大理大学博士科研启动费项目,《小鼠海马齿状回在恐惧记忆更新中的作用研究》;项目编号:No.KYBS2018008。
作者简介:王晓兵(1994—),女,汉族,山东济南市人,研究生,无职称,单位:大理大学基础医学院人体解剖与组织胚胎学专业,研究方向:神经生物学

