基于炮制与配伍探究四逆散在抑郁模型大鼠体内代谢成分的差异
张雅婷,蔡 皓*,段 煜,裴 科,王梦晴,于 慧,刘 鑫,宋健涛,段奕辰
基于炮制与配伍探究四逆散在抑郁模型大鼠体内代谢成分的差异
张雅婷1, 2,蔡 皓1, 2*,段 煜1, 2,裴 科3,王梦晴1, 2,于 慧1, 2,刘 鑫1, 2,宋健涛1, 2,段奕辰1
1. 南京中医药大学药学院,江苏 南京 210023 2. 南京中医药大学 国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023 3. 山西中医药大学中药与食品工程学院,山西 晋中 030619
研究炮制与配伍对四逆散中主要有效成分在抑郁模型大鼠血浆、胆汁、尿液及粪便中代谢成分的差异。建立慢性不可预期温和应激(chronic unpredictable mild stress,CUMS)抑郁大鼠模型,造模结束后分别ig柴胡、白芍、柴胡-白芍药对、四逆散及含醋炙柴胡和醋炙白芍的四逆散提取物,并在连续ig 7 d后收集24 h尿液及粪便,再次ig收集血浆及胆汁。采用超高效液相色谱-四极杆飞行质谱(UPLC-Q-TOF/MS)技术对血浆、胆汁、尿液及粪便样本进行检测,并结合PeakViewTM和MetabolitePilotTM软件进行鉴定分析。依据代谢途径和离子碎片信息,推测柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、芍药苷、芍药内酯苷、苯甲酰芍药苷、氧化芍药苷、橙皮苷、橙皮素、柚皮苷、甘草苷、甘草酸以及甘草素在抑郁模型大鼠体内主要以原型、脱糖、脱氧、去甲基化、氧化、甲基化、葡萄糖醛酸化、硫酸化等形式存在。最终在柴胡组中鉴定了27种代谢产物,在白芍组中鉴定了30种代谢产物,在柴胡-白芍药对组中鉴定了52种代谢产物,在四逆散组中鉴定了118种代谢产物,在含醋炙柴胡和醋炙白芍的四逆散组中鉴定了168个代谢产物。在抑郁模型大鼠体内,配伍前后的“单味药-药对-复方”和炮制前后的“生品-醋炙品”的代谢产物存在较大差异。即经醋炙及配伍后,14种主要活性成分的原型及其代谢产物的分布更为广泛,且醋炙在一定程度上促进了某些成分参与肝肠循环,进一步为四逆散抗抑郁作用的药效物质研究奠定基础,同时也为阐明炮制与配伍机制提供科学依据。
四逆散;醋炙;配伍;代谢产物;UPLC-Q-TOF/MS;抗抑郁作用;慢性不可预期温和应激;柴胡;白芍;柴胡皂苷a;柴胡皂苷b2;柴胡皂苷c;柴胡皂苷d;芍药苷;芍药内酯苷;苯甲酰芍药苷;氧化芍药苷;橙皮苷;橙皮素;柚皮苷;甘草苷;甘草酸;甘草素
中药炮制是根据中医药理论,依照辨证施治用药的需要和药物的自身性质,以及调剂和制剂的不同要求,所采取的一项制药技术。有关单味药的炮制机制已有广泛研究,大量单味药的炮制内涵实质已被揭示。但“药有个性之特长,方有合群之妙用”,中药多以复方的形式给药,《神农本草经》中就有“上药一百二十种为君,主养命;中药一百二十种为臣,主养性;下药一百二十五种为佐使,主治病;用药须合君臣佐使”的记载。复方用药从多元的角度以“君臣佐使”为配伍原则,以“四气五味”“升降浮沉”以及“归经”为用药的依据和规律,因此,复方配伍用药是中医临床用药的最大特点。故在开展中药复方炮制配伍机制的研究中要以单味中药的研究为基础。而药对是中药配伍中的最小单元,组成简单,但具备中药配伍最基本的特点,是复方最小的组方单位。许多临床上常用的经典药对均出自不同的复杂复方,药对研究既是连接单味药与复杂复方之间的重要桥梁,更集中体现了复杂复方配伍的核心。因此,以药对研究作为切入点可以更好地阐明复杂复方中药味炮制前后的组方机制。
目前,对中药炮制前后“单味药-药对-复方”3个层次的炮制机制研究思路大多是运用中药化学和药理学的技术手段从炮制和配伍前后主要药效物质与量的改变以及药效学的角度进行阐述,从一定程度上初步揭示了中药炮制的内涵。而中药成分十分复杂,现代研究表明,中药均是通过与人体的相互作用而发挥疗效,必须进入体内才是中药的体内直接作用物质,而这样的物质才有可能是有效物质基础或有效成分[1-3]。中药体内药效物质是中药药性理论、中药炮制机制、中药配伍规律等中药理论研究的标志物,是中药深入研究的基石。因此,从体内代谢成分的角度探究中药发挥药效的物质基础则更为科学、合理和有效[4]。基于此,针对中药炮制配伍的研究现状,本研究创新性的以多成分和多靶点的组方为中心,向内以“单味药-药对-复方”3个层次进行拆方研究,向外以“生品-醋炙品”2个层面进行对比研究。
四逆散由柴胡、白芍、枳实和炙甘草4味药按1∶1∶1∶1的比例组成,最早记载于张仲景的《伤寒论》,具有疏肝解郁、和解表里的功效,目前临床所用的抗抑郁方大多以此经典方为基础[5-6]。方中的“柴胡-白芍”药对常以君臣药配伍于疏肝解郁类复方中[7-8],而醋炙尤以增强疏肝解郁的功效[9-12]。因此,本实验选取了四逆散中的柴胡皂苷a(saikosaponin a,SSa)、柴胡皂苷b2(saikosaponin b2,SSb2)、柴胡皂苷c(saikosaponin c,SSc)、柴胡皂苷d(saikosaponin d,SSd)、芍药苷、芍药内酯苷(albiflorin,Alb)、苯甲酰芍药苷(benzoylpaeoniflorin,Ben)、氧化芍药苷(oxypaeoniflorin,Oxy)、橙皮苷、橙皮素、柚皮苷、甘草苷、甘草酸及甘草素这14种主要抗抑郁活性成分为研究对象[13-20],探究炮制与配伍对四逆散在抑郁模型大鼠体内代谢成分的差异,为四逆散发挥抗抑郁作用的有效物质基础提供科学依据,并对炮制与配伍机制的阐明提供参考。
1 材料
1.1 动物
雄性Sprague-Dawley(SD)大鼠(200~220 g,SPF级),由南京市江宁区青龙山动物养殖场提供,生产许可证:SCXK(苏)2017-0001。
整个实验研究过程中的环境条件:湿度(50±10)%、温度(22±2)℃,所有动物实验遵循南京中医药大学实验动物伦理委员会有关实验动物管理和使用的规定,均符合3R原则。
1.2 仪器
UPLC系统,日本Shimadzu公司;Triple TOF 5600+串联飞行时间质谱仪,美国AB Sciex公司;电喷雾离子源(ESI),Analyst®TF 1.6 software工作站数据采集软件,美国AB Sciex公司;Intagral-3 Milli-Q超纯水净化系统,美国Millipore公司;数据采集所用软件为Analyst®TF 1.6 software(AB Sciex,Foster City,CA)。
1.3 化学药品、试剂及实验用饮片
对照品SSa(质量分数>99%,批号C-024-190605)、SSb2(质量分数>99%,批号C-051-181206)、SSc(质量分数>98%,批号C-025-181127)、SSd(质量分数>98%,批号C-026-181218)、芍药苷(质量分数>98%,批号S-010-180416)、Alb(质量分数>99%,批号S-011-181031)、Ben(质量分数>99%,批号B-024-180719)、Oxy(质量分数>98%,批号Q-019-181031)、甘草苷(质量分数>98%,批号G-009-181216)、甘草酸(质量分数>99%,批号G-004-181226)、甘草素(质量分数质量分数>98%,批号G-036-180507)、橙皮苷(质量分数>93%,批号C-006-190904)、橙皮素(质量分数>98%,批号C-017-181129)以及柚皮苷(质量分数>98%,批号Y-006-170426)均由成都瑞芬思生物科技有限公司提供。实验过程中使用的甲醇(HPLC/MS级)和乙腈(HPLC/MS级)均购自德国Merck公司。甲酸(UPLC级,质量分数99%)购自美国Anaqua化学公司。其他试剂(分析级)均购自南京化学试剂股份有限公司。米醋购自海天食品股份有限公司,生产批号20190312。
实验用饮片均购自安徽铜陵禾田中药饮片有限公司,其中柴胡饮片原产于甘肃(生产批号20180601)、白芍饮片原产于安徽(生产批号20180611)、枳实饮片原产于江西(生产批号20190129)、炙甘草饮片原产于内蒙(生产批号20180731),经南京中医药大学江苏省中药炮制重点实验室蔡皓副研究员鉴定为正品,分别为伞形科柴胡属植物柴胡DC.的干燥根(,BR),毛茛科芍药属植物芍药Pall.的干燥根(,PRA),芸香科柑橘属植物酸橙L.的干燥幼果(,AFI),豆科甘草属植物甘草Fisch. ex DC.的干燥根和根茎的炮制加工品(etcum,GRRPM)。
采用《中国药典》2020年版(四部)炮制通则所述方法制备醋炙柴胡(vinegar-processed BR,vpBR)和醋炙白芍(vinegar-processed PRA,vpPRA)饮片:取柴胡及白芍生品若干,捡出杂质后,按1 kg饮片用0.2 kg米醋充分混合,拌匀闷润,置炒炙容器中,以文火加热不停翻炒,炒干为度,取出,放凉后备用。
2 方法
2.1 供试品提取液的制备
称取饮片若干(柴胡、白芍、枳实、炙甘草质量比为1∶1∶1∶1),用蒸馏水回流提取(6倍量蒸馏水提取1.5 h),滤过,残渣再用蒸馏水回流提取(4倍量蒸馏水提取1 h),滤过,合并2次滤液,减压浓缩至最终质量浓度为0.96 g/mL(以饮片干质量计),制得四逆散水提液。
称取饮片若干(醋炙柴胡、醋炙白芍、枳实、炙甘草质量比为1∶1∶1∶1),操作方法同上,制得含醋炙柴胡和醋炙白芍的四逆散水提液。
称取饮片若干(柴胡、白芍质量比为1∶1),操作方法同上,制得柴胡-白芍药对水提液。
分别称取柴胡饮片和白芍饮片若干,操作方法同上,分别制得柴胡水提液和白芍水提液。
2.2 对照品溶液的制备
分别精密称取SSa、SSb2、SSc、SSd、芍药苷、Alb、Ben、Oxy、橙皮苷、橙皮素、柚皮苷、甘草苷、甘草酸及甘草素对照品适量,用甲醇配制成质量浓度分别为88.96、94.72、78.48、88.80、81.28、87.60、86.56、81.92、82.88、38.24、76.40、82.96、38.68、39.08mg/mL的混合对照品溶液。
2.3 UPLC-Q-TOF/MS检测条件
2.3.1 色谱检测条件 Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸水溶液-乙腈;梯度洗脱程序:0.01~5 min,5%~30%乙腈;5~7 min,30%~65%乙腈;7~15 min,65%~95%乙腈;15~17 min,95%乙腈;17~19 min,95%~5%乙腈;19~21 min,5%乙腈;体积流量0.3 mL/min;进样量1 μL;柱温40 ℃。
2.3.2 质谱检测条件 离子化模式为电喷雾正、负离子模式(ESI+/−),离子喷雾电压(ion spray voltage floating,ISVF)分别为5500 V/−4500 V,离子源温度为550 ℃,去簇电压(declustering potential,DP)分别为60 V/−60 V,碰撞能量(collision energy,CE)分别为45 V/−45 V,碰撞能量扩展(collision energy spread,CES)为20 V。喷雾辅助气体为氮气(N2),雾化气(nebulizer gas,Gas1)和辅助加热气(heater gas,Gas2)的压力均设定为379.212 kPa(55 psi),气帘气(curtain gas,Cur)为241.316 kPa(35 psi)。一级质谱母离子扫描范围为/100~2000,子离子扫描范围为/50~1000。
2.4 动物实验
2.4.1 慢性不可预期温和应激(chronic unpredictable mild stress,CUMS)抑郁症大鼠模型的建立 CUMS模型造模周期为4周,刺激方式[21]:(I)昼夜颠倒12 h,(II)禁食24 h,(III)禁水24 h,(IV)水平震荡15 min,(V)捆绑束缚6 h,(VI)潮湿笼子12 h,(VII)鼠笼倾斜12 h,(VIII)夹尾1 min,(IX)4 ℃冰水游泳5 min,(X)异物暴露12 h,(XI)异味刺激5 h,(XII)噪音干扰5 h。各组大鼠(除正常组外)于每天8:00、20:00时由抽签选取一种刺激方式进行造模,注意3 d以内刺激方式不重复。
2.4.2 模型的行为学评价指标 造模结束后,通过体质量变化指标、糖水偏好实验、旷场实验、强迫游泳实验进行行为学评价。
2.4.3 生物样品的采集 造模结束后,分别ig生理盐水(正常组及模型组)和各给药组提取物,给药剂量为9.6 g/kg,给药体积为10 mL/kg。每天1次,连续给药7 d后,收集24 h的尿液和粪便。所有大鼠分别再次给药,并于给药后40 min眼眶取血于预先涂有1%肝素钠的EP管中,3500 r/min离心15 min,取上清,得到血浆,将其置于−80 ℃储存备用。同时进行胆管插管,收集4 h胆汁,−80 ℃保存,备用。
2.4.4 生物样品供试液的制备
(1)血浆:精密吸取血浆300 µL,置1.5 mL EP管中,加入甲醇900 µL,涡旋5 min,13 000 r/min离心5 min,取上清液于1.5 mL EP管中,13 000 r/min再次离心5 min,取上清液进样。
(2)胆汁:精密吸取胆汁300 µL,置4 mL EP管中,加入甲醇3 mL,从中取50 µL于1.5 mL EP管中,加入950 µL甲醇,涡旋5 min,13 000 r/min离心5 min,取上清液于1.5 mL EP管中,13 000 r/min再次离心5 min,取上清液进样。
(3)尿液:精密吸取尿液300 µL,置10 mL EP管中,加入甲醇5 mL,涡旋5 min,13 000 r/min离心5 min,取上清液于1.5 mL EP管中,13 000 r/min再次离心5 min,取上清液进样。
(4)粪便:将每只大鼠的全部粪便烘干6 h后粉碎,精密称取碾碎混匀的粪便1 g,加入甲醇4 mL,溶解匀浆,13 000 r/min离心5 min,取上清于1.5 mL EP管中,13 000 r/min再次离心5 min,取上清液进样。
2.5 数据采集与分析
在分析鉴定化合物之前,建立柴胡、白芍、枳实和炙甘草的14种化学成分数据库,包括名称、CAS号、分子式、相对分子质量及其化学结构(mol:化学分子结构文件)文件等化学成分信息。体内柴胡、白芍、枳实及炙甘草原型成分的相关信息由软件Analyst®TF 1.6分析及鉴定,然后使用PeakViewTM软件的XIC Manager功能进行鉴别,以保留时间(误差范围在0.2 min以内)和质荷比(/)(误差范围在1.0×10−5之内)这2个参数初步确定化合物。再结合化合物在裂解过程中的一级离子碎片、二级离子碎片信息,以及匹配率(大于75%)共同确定各个离子峰的归属,从而完成原型化合物的最终鉴别。其次,体内柴胡、白芍、枳实及炙甘草代谢产物成分的相关信息由软件Metabolite PilotTM分析及鉴定,将在PeakViewTM软件中匹配分析所得到的原型成分的信息录入Compound Library,并进行代谢途径库和分析方法的建立,最终根据综合评分的匹配度(大于75%)共同确定体内代谢产物的最终鉴别。
3 结果
3.1 CUMS大鼠模型评价
通过对体质量变化、糖水偏好值、旷场实验的活动总路程、中央停留时间及活动总次数、强迫游泳实验的水中静止不动时间等指标进行评价后的整体评价结果显示:造模后大鼠自主活动能力下降,对经历快乐的能力缺失,对于在危机时的求生欲望也显著降低,造模成功。
3.2 给药后血浆、胆汁、尿液、粪便的UPLC-Q-TOF/MS分析
将模型组的血浆、胆汁、尿液、粪便和给药组的血浆、胆汁、尿液、粪便样品进行UPLC-Q-TOF/MS分析,正、负离子模式下的总离子流图见图1。
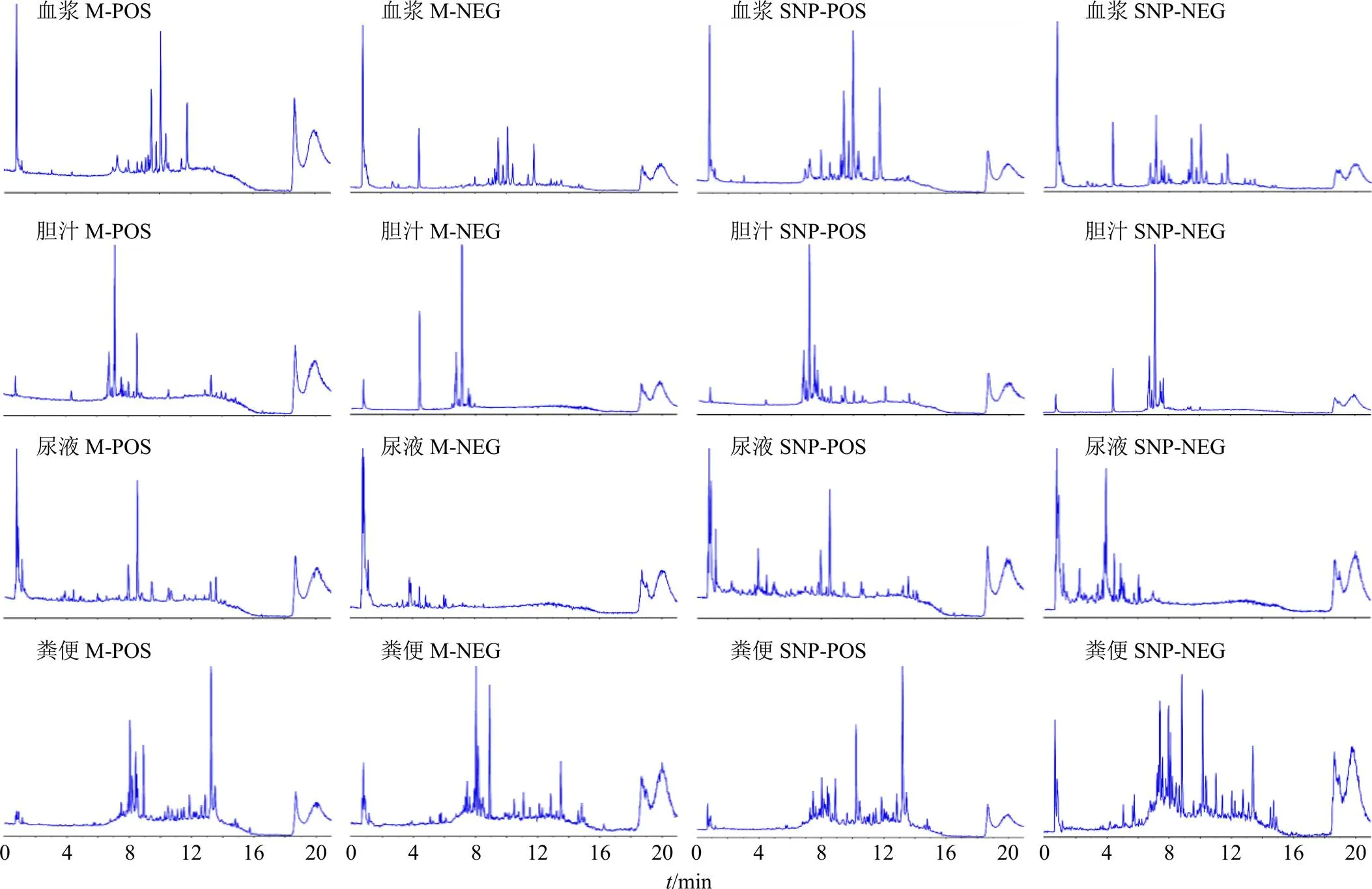
M-模型组 SNP-四逆散组 POS-正离子模式 NEG-负离子模式
3.2.1 原型成分的结构鉴定 经PeakViewTM软件处理,结果见表1。ig柴胡提取物后,未在抑郁模型大鼠体内检测到柴胡皂苷原型成分。ig柴胡-白芍药对提取物后,在抑郁模型大鼠的粪便中检测到原型成分。ig四逆散提取物后,未检测到原型成分。ig含醋炙柴胡和醋炙白芍的四逆散提取物后,在抑郁模型大鼠的粪便中检测到柴胡皂苷原型成分。ig白芍提取物后,在抑郁模型大鼠体内检测到白芍总苷原型成分,其中芍药苷和Alb在血浆、胆汁、尿液及粪便中均能被检测到,Oxy在胆汁及粪便中被检测到,Ben仅在粪便中被检测到。ig柴胡-白芍药对提取物后,同样能在胆汁和粪便中检测到Oxy,在胆汁、尿液及粪便中检测到芍药苷和Alb,但在血浆中并未检测到这2个化合物的原型成分,也并未在大鼠体内检测到Ben。ig四逆散提取物后,仅在大鼠血浆和尿液中检测到芍药苷和Alb。ig含醋炙柴胡和醋炙白芍的四逆散提取物后,在血浆、胆汁、尿液及粪便中均能检测到芍药苷和Alb,在血浆、胆汁及粪便中均能检测到Oxy。ig四逆散及含醋炙柴胡和醋炙白芍的四逆散提取物后,枳实中的橙皮苷、橙皮素及柚皮苷均在体内被检测到,其中含醋炙品的四逆散给药后在血浆中未检测到柚皮苷,在尿液中未检测到橙皮苷。ig四逆散及含醋炙柴胡和醋炙白芍的四逆散提取物后,炙甘草中的甘草苷、甘草素均在体内被检测到,四逆散含醋炙品前后对甘草酸的体内代谢影响较大,甘草酸在给药四逆散提取物后未在体内被检测到,而给药含醋炙柴胡和醋炙白芍的四逆散提取物后,在体内的血浆、胆汁、尿液及粪便中均能检测到其原型。整体来看,四逆散中主要活性成分的原型均能在大鼠体内被检测到,但各成分主要经粪便、胆汁及尿液代谢。其中含醋炙柴胡和醋炙白芍的四逆散组中所检测到的原型成分最多,且在血浆中的含量占比较高,符合前期药动学研究的结果。
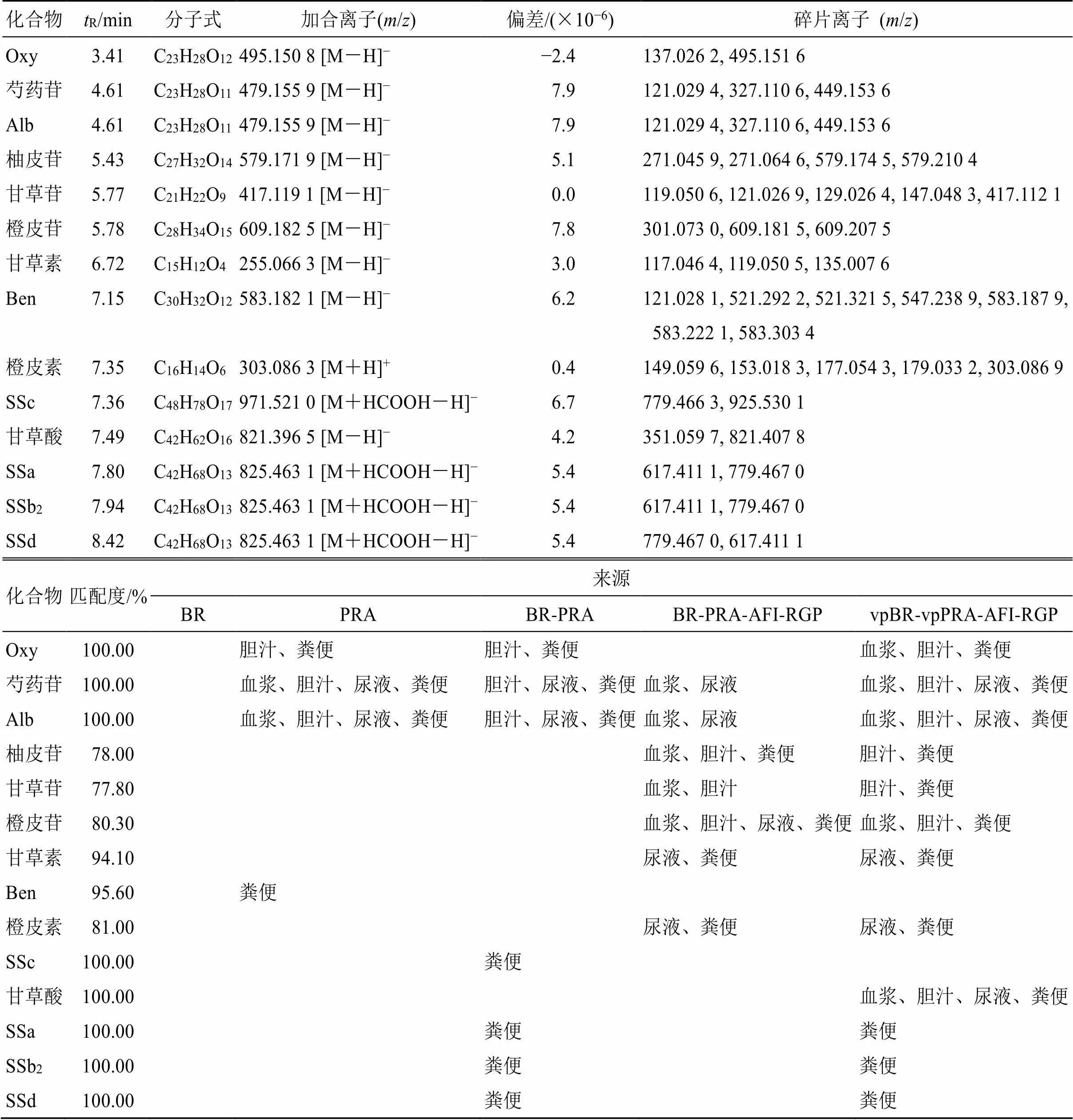
表1 炮制与配伍前后四逆散主要活性成分在抑郁模型大鼠血浆、胆汁、尿液和粪便中的分布情况
3.2.2 与柴胡相关的代谢产物 柴胡皂苷类成分的代谢产物见表2。ig后,在抑郁模型大鼠体内共鉴定出与SSa、SSb2、SSc、柴胡皂苷d相关的代谢产物33种。在柴胡组中检测到27种,其中23种成分在粪便中以I相代谢物形式存在,3种成分在胆汁中以II相代谢物形式存在,仅有1种成分在血浆中以I相代谢物形式存在;在柴胡-白芍药对组中检测到29种,其中26种成分在粪便中以I、II相代谢物形式存在,3种成分在血浆及胆汁中以II相代谢物形式存在;在四逆散组中检测到19种,其中18种成分在粪便中以I相代谢物形式存在,11种成分在血浆中以I相代谢物形式存在,8种成分在胆汁中以I相代谢物形式存在;在含醋炙柴胡和醋炙白芍的四逆散组中检测到28种,其中25种成分在粪便中以I相代谢物形式存在,11种成分在胆汁中以I、II相代谢物形式存在,10种成分在血浆中以I相代谢物形式存在。柴胡皂苷类成分的代谢产物基本上均在血浆、胆汁、粪便中出现,在体内主要发生的代谢类型以I相代谢中脱糖、去甲基化、氧化和II相代谢中甲基化、与葡萄糖醛酸结合为主。
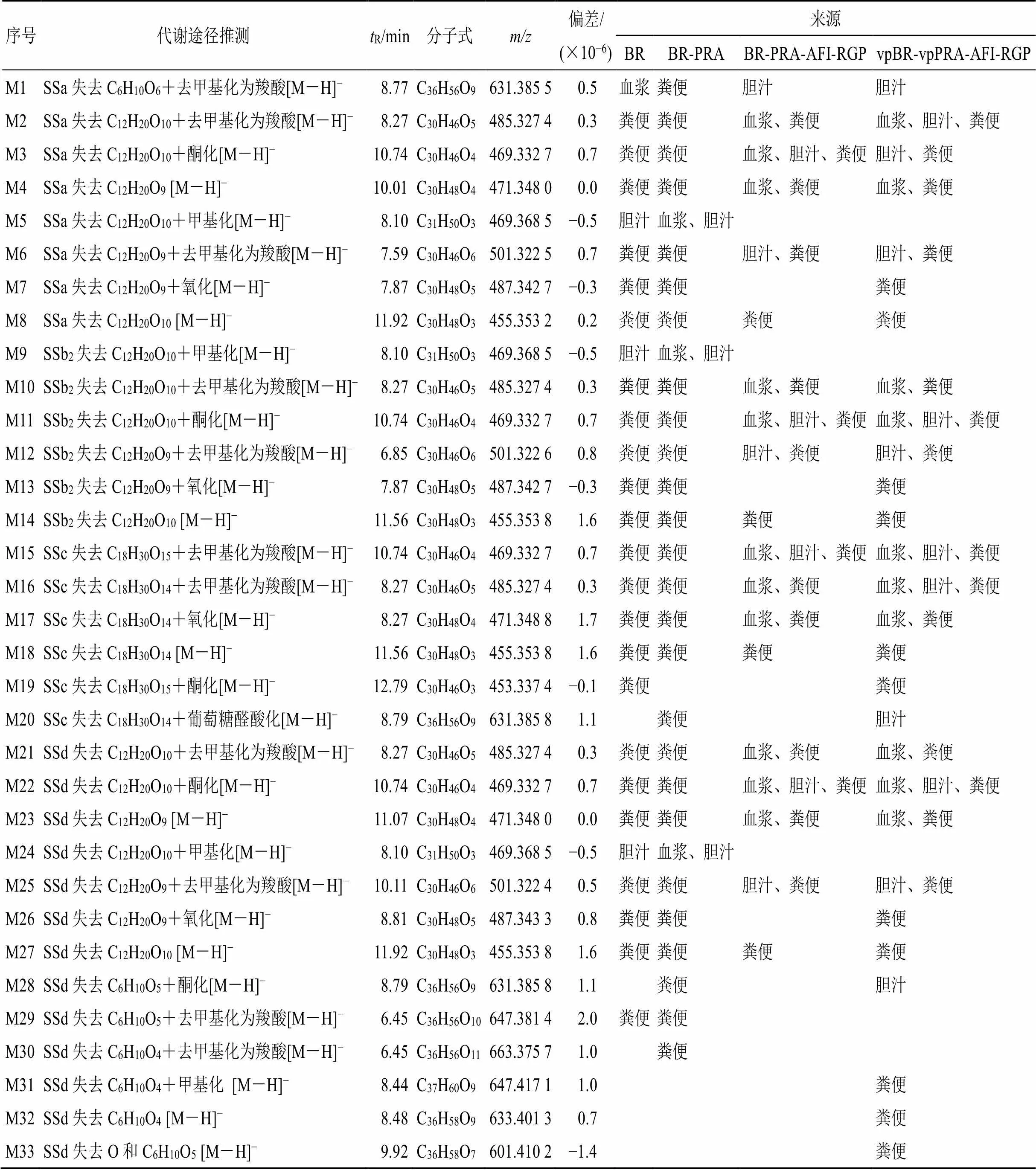
表2 炮制与配伍前后柴胡的柴胡皂苷类成分在大鼠血浆、胆汁、尿液和粪便中的代谢物
3.2.3 与白芍相关的代谢产物 白芍总苷类成分的代谢产物见表3。ig后,在抑郁模型大鼠体内共鉴定出与芍药苷、Alb、Ben、Oxy相关的代谢产物57种。在白芍组中检测到30种,其中20种成分在粪便中以I、II相代谢物形式存在,17种成分在尿液中以I、II相代谢物形式存在,6种成分在血浆中以I相代谢物形式存在,3种成分在胆汁中以I相代谢物形式存在;在柴胡-白芍药对组中检测到23种,其中10种成分在粪便中以I、II相代谢物形式存在,5种成分在尿液中以I、II相代谢物形式存在,2种成分在血浆中以II相代谢物形式存在,1种成分在胆汁中以I相代谢物形式存在;在四逆散组中检测到30种,其中13种成分在血浆中以I、II相代谢物形式存在,10种成分在粪便中以I、II相代谢物形式存在,6种成分在尿液中以I相代谢物形式存在,4种成分在胆汁中以I相代谢物形式存在;在含醋炙柴胡和醋炙白芍的四逆散组中检测到36种,其中24种成分在尿液中以I、II相代谢物形式存在,17种成分在粪便中以I、II相代谢物形式存在,4种成分在血浆中以I相代谢物形式存在,3种成分在胆汁中以I相代谢物形式存在。白芍总苷类成分的代谢产物在血浆、胆汁、尿液、粪便中均有出现,在体内主要发生的代谢类型以I相代谢中脱糖、脱氧、氢化、氧化和II相代谢中甲基化、与葡萄糖醛酸结合为主。
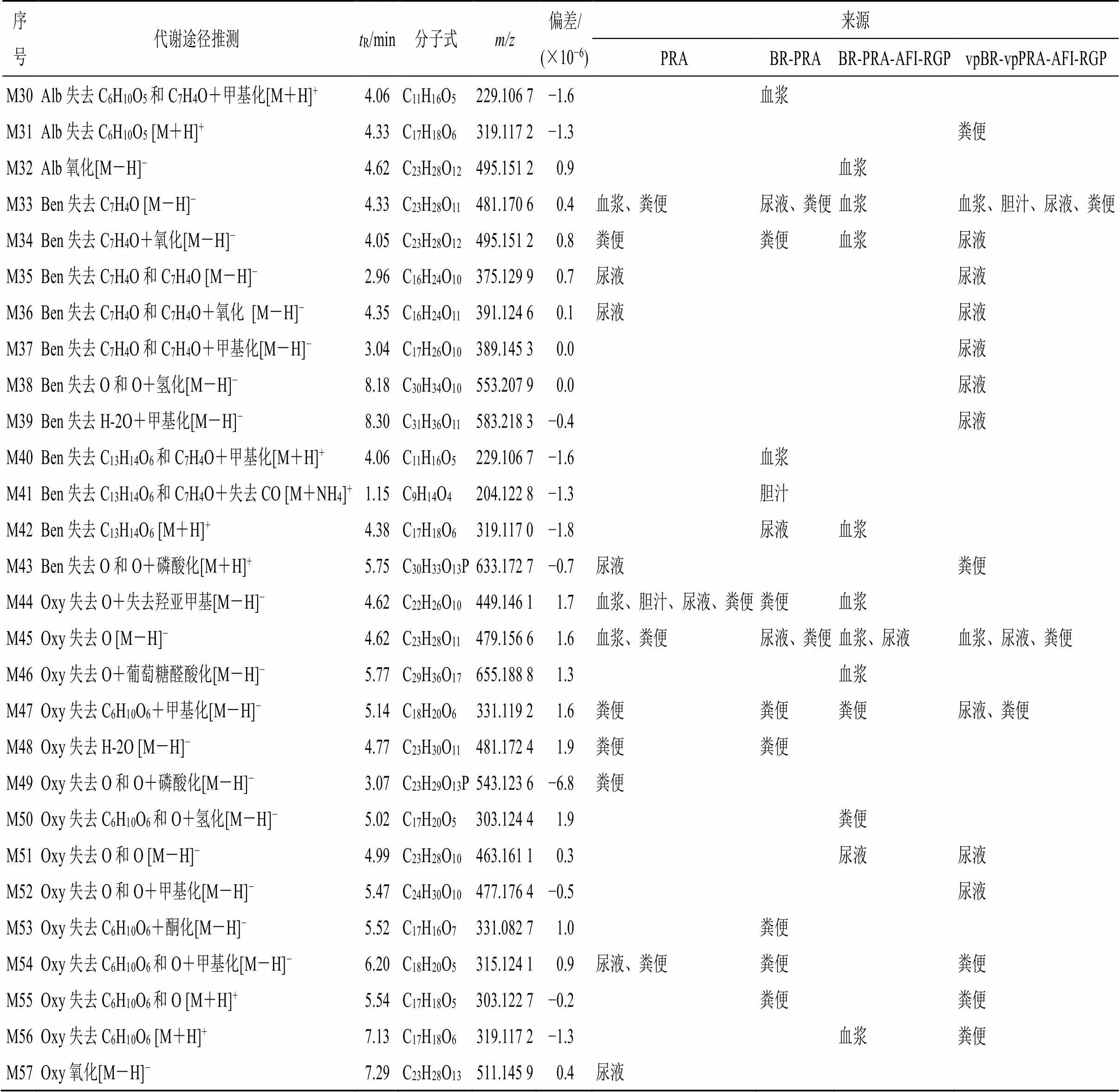
续表3
3.2.4 与枳实相关的代谢产物 橙皮苷、橙皮素、柚皮苷的代谢产物见表4。ig后,在抑郁模型大鼠体内共鉴定出与橙皮苷、橙皮素、柚皮苷相关的代谢产物65种。在四逆散组中检测到33种,其中21种成分在尿液中以I、II相代谢物形式存在,17种成分在血浆中以I相代谢物形式存在,13种成分在胆汁中以I、II相代谢物形式存在,12种成分在粪便中以I相代谢物形式存在;在含醋炙柴胡和醋炙白芍的四逆散组中检测到65种,其中40种成分在尿液中以I、II相代谢物形式存在,33种成分在粪便中以I、II相代谢物形式存在,24种成分在血浆中以I、II相代谢物形式存在,21种成分在胆汁中以I、II相代谢物形式存在。橙皮苷、橙皮素、柚皮苷的代谢产物在血浆、胆汁、尿液、粪便中均有出现,在体内主要发生的代谢类型以I相代谢中氧化、去甲基化、氧化、脱糖、脱氧、去羟基亚甲基化和II相代谢中与葡萄糖醛酸结合、与硫酸结合、甲基化为主,其中一些代谢产物未经I相代谢而直接参与到II相代谢,在含醋炙柴胡和醋炙白芍的四逆散组中被检测到。
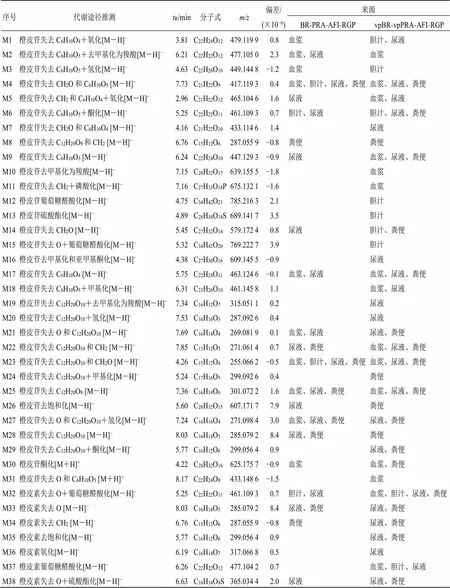
表4 四逆散中的柴胡和白芍醋炙前后枳实的橙皮苷、橙皮素和柚皮苷在大鼠血浆、胆汁、尿液和粪便中的代谢物
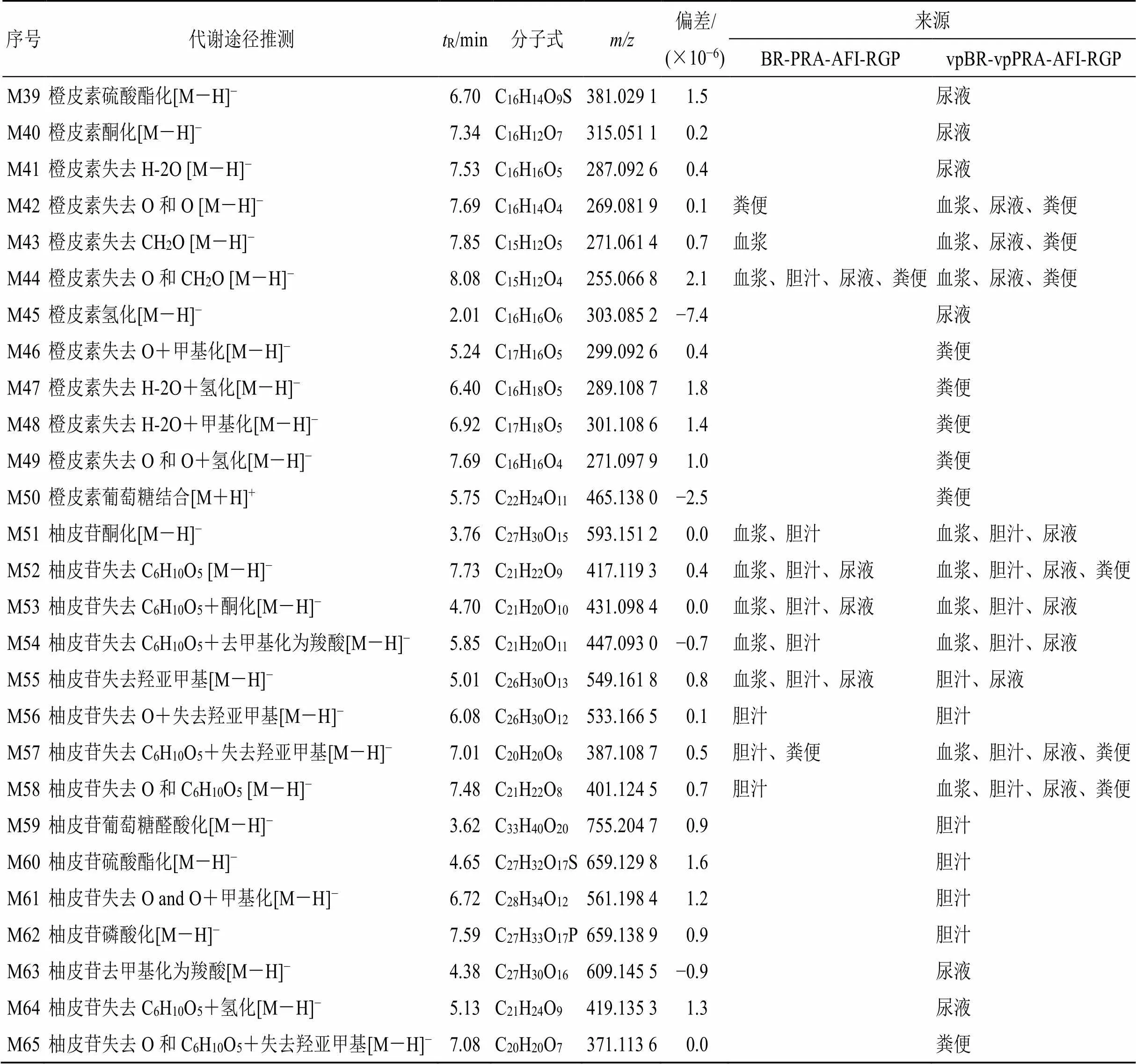
续表4
3.2.5 与炙甘草相关的代谢产物 甘草苷、甘草酸、甘草素的代谢产物见表5。ig后,在抑郁模型大鼠体内共鉴定出与甘草苷、甘草酸、甘草素相关的代谢产物43种。在四逆散组中检测到36种,其中25种成分在血浆中被检测到,20种成分在粪便中被检测到,18种成分在尿液中被检测到,8种成分在胆汁中被检测到,均以I、II相代谢物形式存在。在含醋炙柴胡和醋炙白芍的四逆散组中检测到39种,其中23种成分在粪便中被检测到,21种成分在尿液中被检测到,19种成分在血浆中被检测到,18种成分在胆汁中被检测到,均以I、II相代谢物形式存在。甘草苷、甘草酸、甘草素的代谢产物在血浆、胆汁、尿液、粪便中均有出现,在体内主要发生的代谢类型以I相代谢中脱糖、脱氧、去甲基化、氧化、氢化和II相代谢中与葡萄糖醛酸结合、与硫酸结合、甲基化为主,其中基本上全部的代谢产物均未经I相代谢而直接参与到II相代谢。
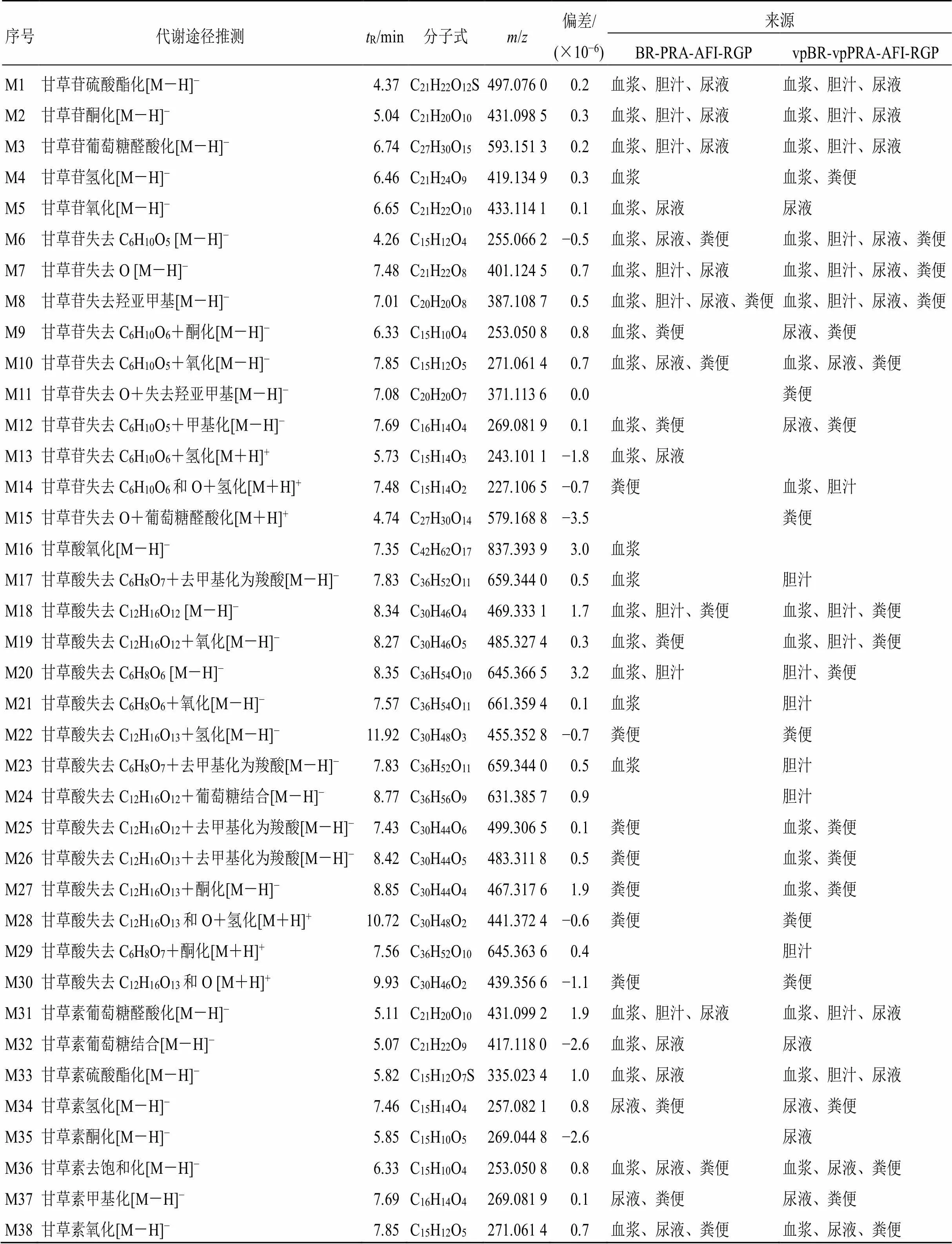
表5 四逆散中的柴胡和白芍醋炙前后炙甘草的甘草苷、甘草酸和甘草素在大鼠血浆、胆汁、尿液和粪便中的代谢物

续表5
4 讨论
SSa、SSb2、SSc和SSd为“君药”柴胡中的主要成分,芍药苷、Alb、Ben和Oxy为“臣药”白芍中的主要成分,橙皮苷、橙皮素和柚皮苷为“佐药”枳实中的主要成分,甘草苷、甘草酸和甘草素为“使药”炙甘草中的主要成分。课题组前期研究结果显示,炮制及配伍对四逆散中这14种主要有效成分在抑郁模型大鼠体内的药动学状态有显著的影响。本研究首次基于炮制与配伍的角度对四逆散进行拆方研究,实验结果显示,炮制及配伍前后各成分在CUMS抑郁模型大鼠体内的存在形式有较大差异。其中,柴胡皂苷类成分在体内主要进行I相代谢,在肠道中水解并以苷元的形式吸收入血,在体内检测到其代谢产物是以苷元的去甲基化、氧化等形式存在,并最终由粪便排出。这与之前的研究结果[22]不太一致,推测可能与疾病状态对药物体内代谢的影响有关[23-28]。
与单味药柴胡组相比,经柴胡与白芍配伍后组方的四逆散组以及经柴胡与白芍炮制后再配伍组方的含醋炙柴胡和醋炙白芍的四逆散组中的柴胡皂苷类代谢产物的分布更加广泛,且近一半的代谢物在血浆和胆汁中被检出。目前已有相关报道指出,柴胡经醋炙后部分成分发生了量变和质变,其中挥发油的含量降低,而与解热和抗炎相关的9种药效成分含量升高,并产生16种新成分,同时有10种成分消失[29]。推测可能是由于炮制及配伍后成分的变化促使某些代谢物的产生以及反应位点和代谢进程发生了改变;含醋炙柴胡和醋炙白芍的四逆散组中的代谢产物主要经粪便和胆汁进行代谢,提示柴胡经醋炙后促进了某些成分参与肝肠循环,进一步为“醋炙发挥肝脏引经作用”提供了佐证。
白芍总苷类成分在体内主要以原型和I、II相代谢产物形式存在,原型在体内广泛分布,代谢产物主要在粪便和尿液中被检测到。各组间的代谢产物分布规律较为相似,但原型的分布有较大差异,其中Ben的原型仅在单味药白芍组中被检测到以粪便排出,炮制及配伍后的各组均未检测到其原型。前期研究时发现Ben的生物利用度偏低,而此次实验证实,在ig给药后其在体内可迅速代谢脱去1个C7H4O并进而主要转化为芍药苷,因此,导致其血药浓度偏低。有学者对大鼠ig Ben后Ben和芍药苷的药动学行为进行研究,结果未检测到Ben的原型,同时推测Ben以入血后代谢为芍药苷,发挥功效作用[30]。进一步提示炮制及配伍可促进Ben向芍药苷的代谢转化,进而在一定程度上增强了抗抑郁疗效的发挥。此外,Oxy的原型除了在四逆散组中未见有检出外,在其余各组的胆汁及粪便中均有分布。推测产生这一现象的原因可能是由于在加入枳实和炙甘草的配伍组方四逆散后抑制了某些代谢物的产生,或是与配伍后成分间的相互作用有关,尚有待进一步的探讨。
枳实中的橙皮苷、橙皮素和柚皮苷主要以原型和I、II相代谢产物形式广泛存在于体内,与四逆散组相比,含醋炙柴胡和醋炙白芍的四逆散组中这3个成分的代谢途径更广,代谢产物更丰富,其中大多数代谢产物在体内不经I相反应而直接进行II相代谢。炙甘草中的甘草苷、甘草酸和甘草素同样以原型和I、II相代谢产物形式存在于体内,四逆散组和含醋炙柴胡和醋炙白芍的四逆散组的代谢产物分布规律相似,但原型的分布差异显著,尤以甘草酸最为明显。甘草酸的原型成分在四逆散中未检测到,而在含醋炙柴胡和醋炙白芍的四逆散组中的血浆、胆汁、尿液及粪便中均被检测到。甘草酸在体内易代谢产生大量的甘草次酸[31],进一步对四逆散及含醋炙柴胡和醋炙白芍的四逆散组中的甘草次酸的原型成分分析时发现,甘草次酸广泛存在于这两组的血浆、胆汁、尿液及粪便中。可见四逆散在含有醋炙品前后对甘草酸的体内代谢有较大的影响。
综上所述,在CUMS抑郁模型大鼠体内,这14种主要抗抑郁有效成分的体内代谢物在“单味药-药对-复方”和“生品-醋炙品”不同层次的分析中存在显著差异。总体来看,相比于其他组,含醋炙柴胡和醋炙白芍的四逆散组中检测到的代谢产物的种类较多且在体内分布的范围较广,这些差异可能与其在治疗抑郁病症发挥效应相比于其他各组更具优势的主要原因之一。
本实验根据中药体内代谢成分的研究思路,首次应用UPLC-Q-TOF/MS分析炮制与配伍后四逆散中主要活性成分在抑郁模型大鼠体内的代谢成分。同时基于成分鉴定的相关软件和数据库的建立,并依据代谢途径和离子碎片信息,推测SSa、SSb2、SSc、SSd、芍药苷、Alb、Ben、Oxy、橙皮苷、橙皮素、柚皮苷、甘草苷、甘草酸以及甘草素在CUMS抑郁模型大鼠体内主要以原型、脱糖、脱氧、去甲基化、氧化、甲基化、葡萄糖醛酸化、硫酸化等形式存在。并鉴定了柴胡中的27种代谢物、白芍中的30种代谢物、柴胡-白芍药对中的52种代谢物、四逆散中的118种代谢物以及含醋炙柴胡和醋炙白芍的四逆散中的168种代谢物。
在CUMS抑郁模型大鼠体内,配伍前后的“单味药-药对-复方”和炮制前后的“生品-醋炙品”的原型及其代谢产物存在差异,即经醋炙及配伍后,14种主要活性成分的原型及其代谢产物的分布更为广泛,且醋炙在一定程度上促进了某些成分参与肝肠循环,进一步为四逆散抗抑郁作用的药效物质研究奠定基础,同时也为阐明炮制与配伍机制提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 杨秀伟. 基于体内过程的中药有效成分和有效效应物质的发现策略 [J]. 中国中药杂志, 2007, 32(5): 365-370.
[2] Liu X G, Cheng C Y, Wang J X,. A metabolic exposure-oriented network regulation strategy for the identification of effective combination in the extract ofL. [J]., 2018, 149: 151-159.
[3] 宋慧鹏, 杨华, 高雯, 等. 中药活性成分发现关键技术研究进展 [J]. 世界科学技术—中医药现代化, 2016, 18(7): 1093-1098.
[4] 邱峰. 浅谈中药成分体内代谢研究 [J]. 国际药学研究杂志, 2010, 37(5): 321-328.
[5] 宗阳, 陈婷, 董宏利, 等. 基于网络药理学四逆散治疗抑郁症的作用机制探讨 [J]. 中草药, 2019, 50(20): 4995-5002.
[6] 徐甜, 樊姝宁, 邓楠, 等. 基于分子网络研究四逆散抗抑郁症作用的潜在生物学机制 [J]. 药物评价研究, 2019, 42(9): 1723-1729.
[7] 雒明池, 梁如, 高树明, 等. 基于cAMP-CREB-BDNF通路探讨柴胡-白芍药对抗抑郁作用机制 [J]. 中草药, 2018, 49(17): 4093-4098.
[8] 王雅泽, 吕梦, 赵迪, 等. 基于功能药队分析策略和粗糙集理论的逍遥散改善大鼠抑郁样行为的配伍规律研究 [J]. 中草药, 2020, 51(22): 5760-5767.
[9] 李晓宇. 柴胡醋制前后抗抑郁作用物质基础和药效作用机制的研究 [D]. 济南: 山东中医药大学, 2020.
[10] 徐颖, 徐美华, 鄢连和. 柴胡的醋炙方法及临床应用 [J]. 中国药业, 2006, 15(7): 56.
[11] 王丽娜, 汪巍, 贾天柱. 北柴胡醋制前后对抑郁症小鼠脑内DA和NE含量的影响 [J]. 亚太传统医药, 2014, 10(9): 4-6.
[12] 汪巍, 陈映辉, 王丽娜, 等. 柴胡与醋柴胡疏肝解郁作用比较研究 [J]. 中成药, 2014, 36(3): 617-619.
[13] Su J, Pan Y W, Wang S Q,. Saikosaponin-d attenuated lipopolysaccharide-induced depressive-like behaviors via inhibiting microglia activation and neuroinflammation [J]., 2020, 80: 106181.
[14] Sun X P, Li X L, Pan R L,. Total saikosaponins ofreduces depressive, anxiety-like behavior and increases synaptic proteins expression in chronic corticosterine-treated mice [J]., 2018, 18(1): 117.
[15] Liu S C, Hu W Y, Zhang W Y,. Paeoniflorin attenuates impairment of spatial learning and hippocampal long-term potentiation in mice subjected to chronic unpredictable mild stress [J]., 2019, 236(9): 2823-2834.
[16] Lee B, Choi G M, Sur B. Antidepressant-like effects of hesperidin in animal model of post-traumatic stress disorder [J]., 2021, 27(1): 39-46.
[17] Zhao Z Y, Wang W X, Guo H Z,. Antidepressant-like effect of liquiritin fromin chronic variable stress induced depression model rats [J]., 2008, 194(1): 108-113.
[18] Cao Z Y, Liu Y Z, Li J M,. Glycyrrhizic acid as an adjunctive treatment for depression through anti-inflammation: A randomized placebo-controlled clinical trial [J]., 2020, 265: 247-254.
[19] Ben-Azu B, Nwoke E E, Aderibigbe A O,. Possible neuroprotective mechanisms of action involved in the neurobehavioral property of naringin in mice [J]., 2019, 109: 536-546.
[20] Zhang X H, Han L R, Liu J,. Pharmacokinetic study of 7 compounds following oral administration ofto depressive rats [J]., 2018, 9: 131.
[21] Antoniuk S, Bijata M, Ponimaskin E,. Chronic unpredictable mild stress for modeling depression in rodents: Meta-analysis of model reliability [J]., 2019, 99: 101-116.
[22] 陆林玲, 束艳, 钱大玮, 等. 大鼠灌胃四逆散提取物后血浆、尿液、粪便、胆汁中主要代谢产物的鉴定 [J]. 药学学报, 2011, 46(11): 1374-1379.
[23] Wang Y X, Zhu W J, Xie B G. Expression of PPAR-γ in adipose tissue of rats with polycystic ovary syndrome induced by DHEA [J]., 2014, 9(3): 889-893.
[24] Zaree M, Shahnazi V, Fayezi S,. Expression levels of PPARγ and CYP-19 in polycystic ovarian syndrome primary granulosa cells: Influence of ω-3 fatty acid [J]., 2015, 9(2): 197-204.
[25] 张钰, 彭英, 王广基, 等. 疾病状态下Ⅱ相代谢酶表达和活性的研究进展 [J]. 中国临床药理学与治疗学, 2020, 25(6): 686-700.
[26] 梁志强, 郑彤, 高兴旺. 黄芩素在溃疡性结肠炎模型大鼠肝、肠微粒体中酶促反应动力学研究 [J]. 中南药学, 2016, 14(12): 1302-1307.
[27] 张晓芳, 周芳, 王广基, 等. 疾病状态下的药物代谢处置变化及其机制研究 [J]. 药物评价研究, 2019, 42(3): 369-377.
[28] Wang J J, Zhai T, Chen Y. Effects of honokiol on CYP450 activity and transporter mRNA expression in type 2 diabetic rats [J]., 2018, 19(3): 815.
[29] 彭新, 陈晓辉, 周浩, 等. 中药醋制入肝减毒、增效现代研究 [J]. 中华中医药学刊, 2020, 38(9): 190-194.
[30] 章芳珍, 吴德玲, 赵宏苏, 等. 苯甲酰芍药苷灌胃给药的代谢产物芍药苷的药动学研究 [J]. 中药新药与临床药理, 2019, 30(12): 1490-1496.
[31] Hattori M, Sakamoto T, Kobashi K,. Metabolism of glycyrrhizin by human intestinal flora [J]., 1983, 48(1): 38-42.
Investigation on difference of metabolites of Sini Powder in the depressive rats based on processing and compatibility
ZHANG Ya-ting1, 2, CAI Hao1, 2, DUAN Yu1, 2, PEI Ke3, WANG Meng-qing1, 2, YU Hui1, 2, LIU Xin1, 2, SONG Jian-tao1, 2, DUAN Yi-chen1
1. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Engineering Center of State Ministry of Education for Standardization of Chinese Medicine Processing, Nanjing University of Chinese Medicine, Nanjing 210023, China 3. School of Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 030619, China
To investigate the differences of the metabolites of the main effective constituents contained in Sini Powder (四逆散, SNP) in plasma, bile, urine, and feces of depressive rats by processing and compatibility.The depressive rat model was established by chronic unpredictable mild stress (CUMS). After modeling, the extracts of Chaihu (, BR), Baishao (, PRA), the herb-pair of-(BR-PRA), SNP, and SNP containing vinegar-processed(vpBR) and vinegar-processed(vpPRA) were ig administered, respectively. Urine and feces for 24 h were collected after continuously intragastric administration for seven days, and plasma and bile were collected after intragastric administration again. The technique of ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF/MS) was applied to detect the samples of plasma, bile, urine, and feces, and PeakViewTMand MetabolitePilotTMsoftwares were used for identification and analysis.According to the metabolic pathway and ion fragment information, it was speculated that saikosaponin a, saikosaponin b2, saikosaponin c, saikosaponin d, paeoniflorin, albiflorin, benzoylpaeoniflorin, oxypaeoniflorin, hesperidin, hesperetin, naringin, liquiritin, glycyrrhizic acid, and liquiritigenin were mainly metabolizedto prototype, deglycosylation, deoxidation, demethylation, oxidation, methylation, glucuronidation, sulfation, and other forms in depressive rats. Finally, 27, 30, 52, 118, and 168 metabolites were identified in the BR group, the PRA group, the BR-PRA herb-pair group, the SNP group, and the group of SNP containing vpBR and vpPRA, respectively.There were large differences in metabolites between the “individual herb-herb pair-herbal formula” before and after compatibility and the “crude products-vinegar-processed products” before and after processing in depressive rats. That is to say, the prototypes and metabolites of 14 main active constituents had more extensive distribution after vinegar-processing and compatibility, and vinegar-processing promoted the participation of some constituents in hepatoenteral circulation to a certain extent, which further laid the foundation for investigating the antidepressant substantial basis of SNP, and also provide the scientific evidence for clarifying the mechanism of processing and compatibility.
Sini Powder; vinegar-processing; Chinese medicinal formula compatibility; metabolites; UPLC-Q-TOF/MS; antidepressant effect; chronic unpredictable mild stress;;; saikosaponin a; saikosaponin b2;saikosaponin c; saikosaponin d; paeoniflorin; albiflorin; benzoylpaeoniflorin; oxypaeoniflorin; hesperidin; hesperetin; naringin; liquiritin; glycyrrhizic acid; liquiritigenin
R283.6
A
0253 - 2670(2021)23 - 7244 - 15
10.7501/j.issn.0253-2670.2021.23.019
2021-05-25
国家自然科学基金面上项目(81673600);江苏省研究生科研创新计划(KYCX20_1604);江苏省研究生科研创新计划(KYCX18_1637)
张雅婷(1995—),女,硕士,从事中药质量控制及中药炮制与中药复方临床功效的相关性研究。Tel: (025)86798281 E-mail: zhangyatingzyt@126.com
蔡 皓(1966—),男,副研究员,硕士生导师,从事中药质量控制及中药炮制与中药复方临床功效的相关性研究。Tel: (025)86798281 E-mail: haocai@njucm.edu.cn
[责任编辑 郑礼胜]

