枳实总黄酮对5-氟尿嘧啶诱导的肠黏膜炎小鼠肠道菌群失调的影响
刘丹宁,潘梦雪,杨璐嘉,黄洁瑶,任 巧,袁吕江
枳实总黄酮对5-氟尿嘧啶诱导的肠黏膜炎小鼠肠道菌群失调的影响
刘丹宁,潘梦雪,杨璐嘉,黄洁瑶,任 巧*,袁吕江*
西南大学药学院,重庆 400715
研究枳实总黄酮对5-氟尿嘧啶(5-fluorouracil,5-FU)诱导的肠黏膜炎和肠道菌群的影响及作用机制。雄性昆明小鼠随机分为对照组、模型组及枳实总黄酮低、中、高剂量(50、100、200 mg/kg)组和洛哌丁胺(0.3 mg/kg组),ip 5-FU(50 mg/kg)5 d诱导肠黏膜炎模型,第6天开始,各给药组ig相应药物,1次/d,连续7 d,观察小鼠体质量、饮食量、饮水量、腹泻评分、胸腺指数、脾脏指数、结肠形态、隐窝深度;采用苏木素-伊红(HE)染色考察小鼠结肠组织病理变化;采用ELISA法检测小鼠结肠组织中白细胞介素-6(interleukin-6,IL-6)、IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;检测小鼠结肠组织中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和丙二醛(maleic dialdehyde,MDA)水平;采用细菌16S rRNA基因V3~4区高通量测序技术分析小鼠肠道菌群变化。与模型组相比,枳实总黄酮组小鼠体质量和饮食量增加,饮水量减少,腹泻评分降低,胸腺指数和脾脏指数显著增加(<0.05、0.01),结肠组织损伤减轻,结肠长度和隐窝深度显著增加(<0.05、0.01),结肠组织中促炎细胞因子IL-6、IL-1β和TNF-α水平显著降低(<0.05、0.01),SOD和GSH-Px活性显著升高(<0.05、0.01),MDA水平显著降低(<0.01)。16S rRNA基因测序结果显示,模型组小鼠肠道菌群多样性和丰度降低,枳实总黄酮组小鼠肠道菌群多样性和丰度增加。门水平主要表现为厚壁菌门相对丰度升高;属水平上拟杆菌属、unidentified_、拟普雷沃菌属、unidentified_和乳酸杆菌属5个菌属相对丰度升高。枳实总黄酮能够有效改善5-FU所致的小鼠肠黏膜炎,其机制可能与抗氧化、抗炎、调节肠道菌群有关。
枳实总黄酮;5-氟尿嘧啶;肠黏膜炎;肠道菌群;抗氧化;抗炎;芸香柚皮苷;柚皮苷;橙皮苷
5-氟尿嘧啶(5-fluorouracil,5-FU)是一种抗代谢药物,为治疗恶性肿瘤最常用的处方药之一[1]。由于5-FU对DNA合成抑制的作用是非靶向性的,它不仅攻击肿瘤细胞,还攻击正常细胞,导致增殖抑制、DNA损伤和细胞死亡,引起广泛的不良反应[2-3]。其中最严重的不良反应之一为肠黏膜炎并伴有严重腹泻[4-5]。研究表明,活性氧(reactive oxygen species,ROS)[6]、炎性细胞因子[7-8]、细胞凋亡[9]以及肠道菌群失调是导致肠黏膜炎的主要因素[10-11]。50~80%接受5-FU治疗的患者发展为肠黏膜炎或伴有严重腹泻的黏膜炎[12-13]。目前治疗肠黏膜炎和肠黏膜炎腹泻的药物大多是以对症和短期治疗为原则[14-15]。因此,开发安全有效的药物对治疗5-FU诱导的肠黏膜炎有重要意义。
枳实是酸橙L.及其栽培品种或甜橙Osbeck的干燥幼果,长期以来作为中药单味或入制剂治疗腹泻、胃胀胀痛和子宫脱垂等胃肠道疾病[16]。黄酮类、生物碱、挥发油和香豆素是枳实的主要活性成分[17-18]。枳实中的挥发油成分具有抗真菌[19]、抗焦虑[20]和抗乙酰胆碱酯酶活性[21];辛弗林和-甲基酪胺等生物碱类成分通常作为食品补充剂,可以减轻体质量并改善体态[22];黄酮类成分中的芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷具有抗氧化[23]、抗癌[24]、抗炎[25]、保护胃黏膜[26]、抗凝、调节肠道运动[27]、保护神经[28]等作用。然而,枳实黄酮类成分对化疗诱导的肠黏膜炎的作用及机制少有报道。本研究从枳实中制备得到总黄酮,探究其对5-FU诱导的肠黏膜炎小鼠的影响。
1 材料
1.1 动物
SPF级雄性昆明小鼠,体质量(20±2)g,8周龄,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCKK(湘)2016-0002。动物在SPF级动物房中饲养,自由进食饮水,动物房温度控制在(20±5)℃,湿度控制在(55±5)%,通风环境好,并且保持12 h明暗交替。动物实验均根据《实验动物的护理和使用指南》和《中国实验动物立法》(第398-2006号)进行操作,并由西南大学实验动物伦理审查委员会批准(批准号yxy201912)。
1.2 药品与试剂
枳实(批号20190801)购自重庆市忠县中药有限公司,经西南大学药学院李学刚教授鉴定为芸香科植物酸橙L.;洛哌丁胺胶囊(批号H10910085)购自西安杨森制药有限公司;5-FU注射液(批号H20051113)购自山西普德药业有限公司;白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒、IL-1β ELISA试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号分别为20190426、20190319、20190321)购自上海酶联生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(maleic dialdehyde,MDA)试剂盒(批号分别为20190313、20190319、20190425)购自南京建成生物工程研究所;柚皮苷(批号Y-006-171216,质量分数≥98%)、芸香柚皮苷(批号Y-071-170917,质量分数≥98%)、橙皮苷(批号C-006-170216,质量分数≥98%)购自成都瑞芬思生物科技有限公司。
1.3 仪器
LC-20AD型高效液相色谱仪(HPLC,日本岛津公司);KQ5200DB型超声波清洗仪器(昆山市超声仪器有限公司);QVSW-20A型超纯水仪(美国Millipore公司);RE-52A型旋转蒸发仪(上海荣生化工仪器厂);HHW-21CU-600B型恒温水浴锅(上海福玛实验设备有限公司);YP6000N型电子天平(上海精密仪器科技有限公司);WK1000A型高速多功能粉碎机(山东青州市精诚机械有限公司);TDL-5A型台式低速大容量离心机(上海菲恰尔分析仪器);ELX808型酶标分析仪(美国基因有限公司);DY89型电动玻璃匀浆机(宁波新芝生物科技股份有限公司);SIM-FI40AY65型制冰机(日本松下电器);OMYSS-325型全自动高压灭菌锅(日本TOMY公司);低温微量高速离心机(重庆市医疗器械有限公司);超净工作台(上海浦东荣丰科学仪器有限公司)。
2 方法
2.1 枳实总黄酮的制备
枳实总黄酮由本课题组采用低共熔溶剂(氯化胆碱/醋酸)进行超声波辅助提取,利用大孔吸附树脂富集分离技术对溶液中黄酮类成分富集分离,采用HPLC仪检测枳实总黄酮中芸香柚皮苷、柚皮苷和橙皮苷的质量分数分别为3.36%、0.629%、15.96%。
2.2 造模、分组与给药
小鼠适应性饲养1周后随机分为对照组、模型组以及枳实总黄酮低、中、高剂量(50、100、200 mg/kg)组和洛哌丁胺(0.3 mg/kg)组,每组10只。对照组ip 0.9%氯化钠溶液,其余各组ip 5-FU(50 mg/kg)5 d诱导肠黏膜炎模型;从第6天开始,各给药组ig相应药物,对照组和模型组ig 0.9%氯化钠溶液,1次/d,连续7 d。自造模第1天起,每天记录各组小鼠体质量、饮食量、饮水量、大便形状及临床表现,并对腹泻状态进行腹泻评分,评分≥1的小鼠被认为是腹泻,表现为自主活动减少、肛周污染、体质量减轻、粪便湿软或呈水样,评分为0表明小鼠大便正常,自主活动和体质量增加。
2.3 胸腺和脾脏指数的测定
各组小鼠于取材前1天(末次给药后)禁食但不禁水12 h,样本采集当天首先称定小鼠体质量,小鼠ip 3%戊巴比妥钠(45 mg/kg)麻醉,采血后脱颈椎处死小鼠,紧靠心脏处取下胸腺,胃后面取下脾脏,滤纸吸去血迹,分别称定质量。无菌条件下收集结肠中粪便并测量结肠长度,计算胸腺和脾脏指数。
胸腺(脾脏)指数=胸腺(脾脏)质量/体质量
2.4 肠黏膜病理观察
取约2 cm长的结肠段固定在4%甲醛溶液中,用石蜡包埋,切成4 μm切片,进行苏木素-伊红(HE)染色,于光学显微镜下观察肠黏膜病理变化,评估结肠的病理变化,同时测量隐窝深度。
2.5 ELISA法测定结肠组织炎症因子水平
按照ELISA试剂盒说明书检测结肠组织中炎症因子TNF-α、IL-6和IL-1β水平。
2.6 比色法测定结肠组织氧化应激指标
按照试剂盒说明书检测结肠组织中SOD、GSH-Px活性和MDA水平。
2.7 肠道菌群测序
使用QIAamp DNA粪便Mini Kit从样品中提取微生物DNA。用带条形码的特异引物(338F,806R)扩增细菌16S rRNA基因的区域(V3~4)。热循环包括以下条件:98 ℃、2 min(1个循环);95 ℃、30 s,50 ℃30 s,72 ℃、1 min(30个循环);最后在72 ℃下延伸5 min。PCR产物的高通量测序在Illumina MiSeq平台上进行高质量的生物信息学分析读数,根据UCLUST,基于97%的序列相似性,每个样品的所有有效读数都被归类为可操作分类单元(operational taxonomic unit,OTU)。对于α多样性分析,将OTU划分为多个指标,包括OTU等级、稀释曲线以及Shannon、Chao1、Simpson和ACE的计算指标。对于β多样性分析,使用QIIME进行RDA识别的OTU热图、主成分分析(principal component analysis,PCA)、主坐标分析(principal coordinates analysis,PCoA)、非度量多维标度(non-metric multidimensional scaling,NMDS)和带算术平均值的非加权对组方法(unweighted-pair- group method with arithmetic averag,UPGMA)。进行线性判别分析效应大小(LEfSe)分析以定量分析各组之间的生物标志物。使用LEfSe分析,LDA阈值>4,非参数阶乘Kruskal-Wallis(KW)和秩检验,然后(不成对的)Wilcoxon秩和检验来识别差异最大的分类单元。
2.8 统计学分析
3 结果
3.1 枳实总黄酮对肠黏膜炎小鼠腹泻相关指标的影响
如图1所示,对照组小鼠活动敏捷,体质量增加,饮食饮水正常,毛发光滑,无腹泻情况。模型组小鼠出现腹泻、扎堆、懒动、体质量减轻、饮食减少、饮水增加、翻毛和肛周污渍症状。各给药组小鼠体质量和饮食增加、饮水减少,第12天各给药组腹泻评分接近正常,表明腹泻基本好转。第12天除模型组外,其余各组小鼠粪便基本正常,进一步说明枳实总黄酮明显改善了5-FU诱导的小鼠腹泻。
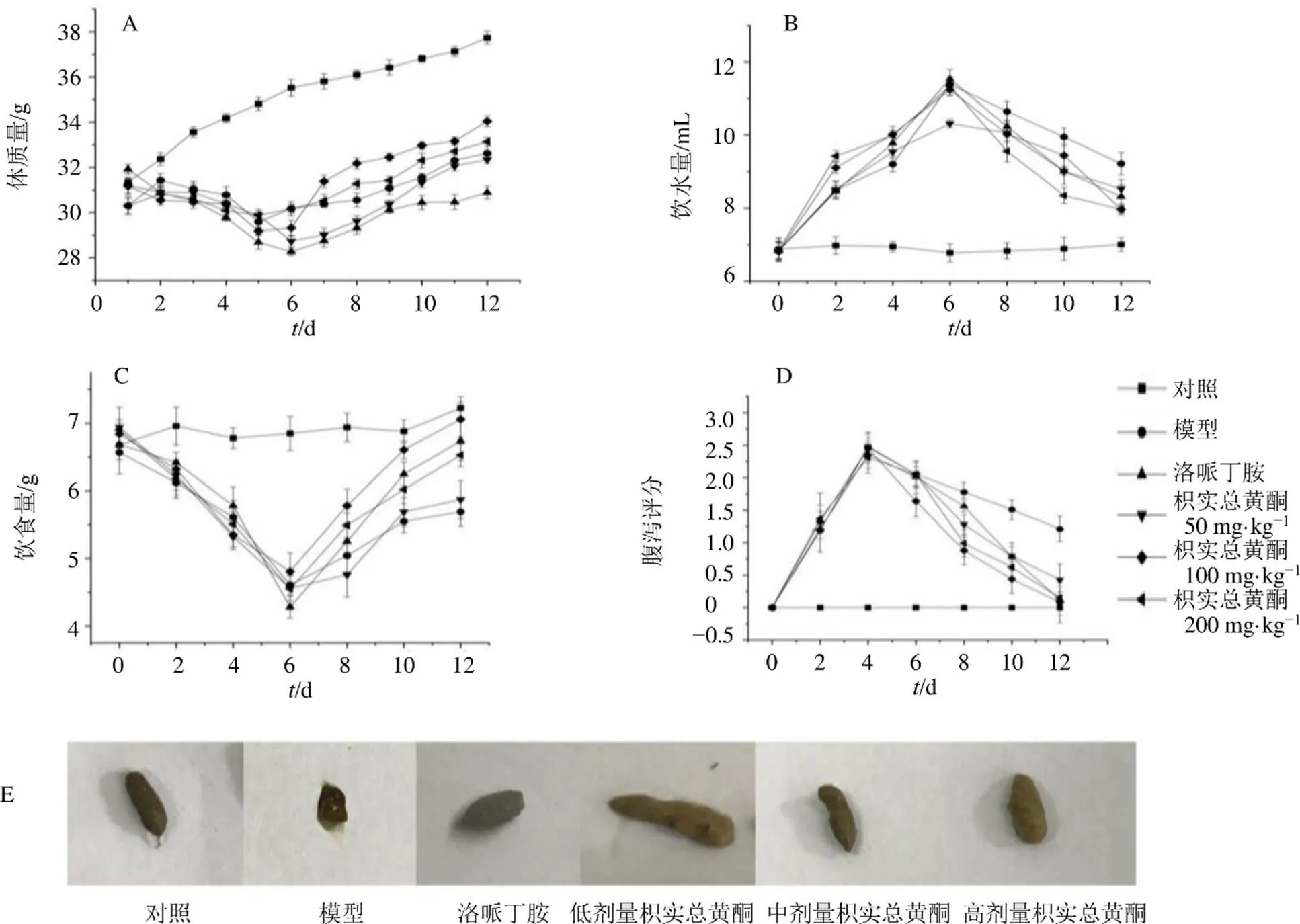
图1 枳实总黄酮对肠黏膜炎小鼠体质量 (A)、饮水量(B)、饮食量(C)、腹泻评分(D) 和粪便外观 (E) 的影响
3.2 枳实总黄酮对肠黏膜炎小鼠胸腺指数和脾脏指数的影响
如图2所示,与对照组相比,模型组小鼠胸腺和脾脏指数显著降低(<0.01);与模型组比较,枳实总黄酮中、高剂量组和洛哌丁胺组小鼠胸腺和脾脏指数显著增加(<0.05、0.01),表明枳实总黄酮可以使肠黏膜炎小鼠胸腺和脾脏指数恢复至正常水平。
3.3 枳实总黄酮对肠黏膜炎小鼠结肠形态和组织病理学的影响
如图3-A、B所示,与对照组相比,模型组小鼠结肠长度显著缩短(<0.01);与模型组相比,各给药组结肠长度显著增加(<0.05、0.01)。如图3-C所示,模型组小鼠结肠组织隐窝深度显著降低(<0.01),各给药组隐窝深度明显恢复(<0.01),表明枳实总黄酮可以恢复肠黏膜炎小鼠结肠长度,增加隐窝深度。如图3-D所示,对照组小鼠基本没有出现炎性细胞浸润情况,隐窝结构保持完整且排列规则;模型组小鼠结肠组织中,上皮细胞坏死,隐窝结构被破坏,大量炎性细胞浸润到黏膜层;与模型组相比,各给药组肠上皮细胞、隐窝的形状和分布得以恢复,表明枳实总黄酮可以修复5-FU诱导的结肠黏膜损伤,减轻肠道炎症反应。

与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
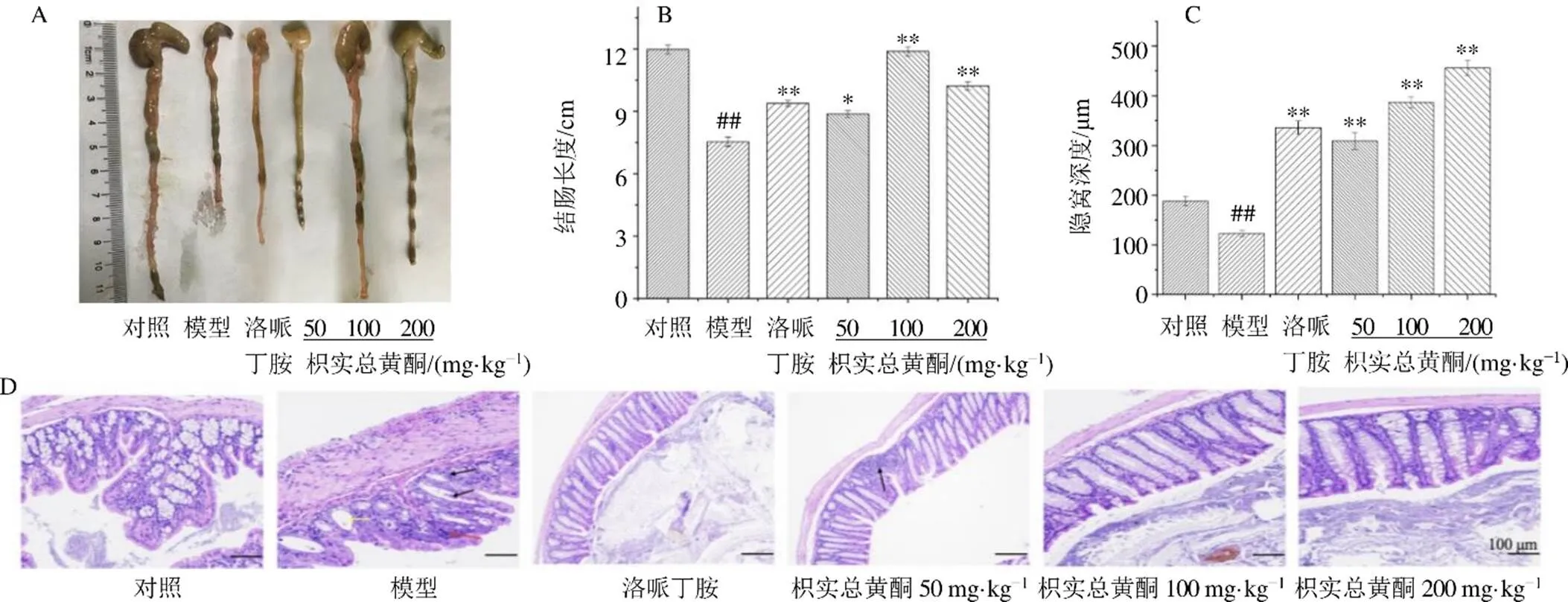
图3 枳实总黄酮对肠黏膜炎小鼠结肠形态 (A)、结肠长度(B)、隐窝深度(C)和结肠组织病理变化(D) 的影响
3.4 枳实总黄酮对肠黏膜炎小鼠结肠组织中炎症因子水平的影响
如图4所示,与对照组相比,模型组小鼠结肠组织中TNF-α、IL-6和IL-1β水平显著增加(<0.01);与模型组相比,各给药组结肠组织中TNF-α、IL-6和IL-1β水平显著降低(<0.05、0.01),表明枳实总黄酮能够调节肠黏膜炎小鼠结肠组织中炎症因子水平。
3.5 枳实总黄酮对肠黏膜炎小鼠结肠组织中SOD、GSH-Px活性和MDA水平的影响
如图5所示,与对照组相比,各造模组小鼠结肠组织中SOD和GSH-Px活性显著降低(<0.01),MDA水平显著增加(<0.01);与模型组比较,洛哌丁胺组结肠组织中GSH-Px活性显著升高(<0.01),MDA水平显著降低(<0.01);枳实总黄酮各剂量组结肠组织中SOD和GSH-Px活性显著升高(<0.05、0.01),MDA水平显著降低(<0.01),表明枳实总黄酮可以改善肠黏膜炎小鼠的氧化应激参数。
3.6 枳实总黄酮对肠黏膜炎小鼠肠道菌群整体结构的影响
如图6-A所示,每个样品的平均有效序列为77 099条,各组之间的DNA序列无显著差异。分析表明,尽管通过更高的测序覆盖率可以获得新的系统,但每个样品中的肠道菌群多样性大都可以在当前测序深度下得到充分捕获(图6-B)。Illumina Hiseg测序系统产生了929个可操作分类单位,相似度截止为97%。组间OTU重叠表明,6组共有455个相同的OTU,对照组、模型组、洛哌丁胺组以及枳实总黄酮低、中、高剂量组分别有14、11、28、18、9、4个独立的OUT(图6-C)。与对照组相比,模型组OTU数量略有减少;与模型组相比,枳实总黄酮中剂量组OUT数量明显增加,枳实总黄酮低、高剂量组对OUT数量没有产生影响(图6-D)。OUT数据表明,通过枳实总黄酮中剂量可以恢复肠道菌群的多样性。
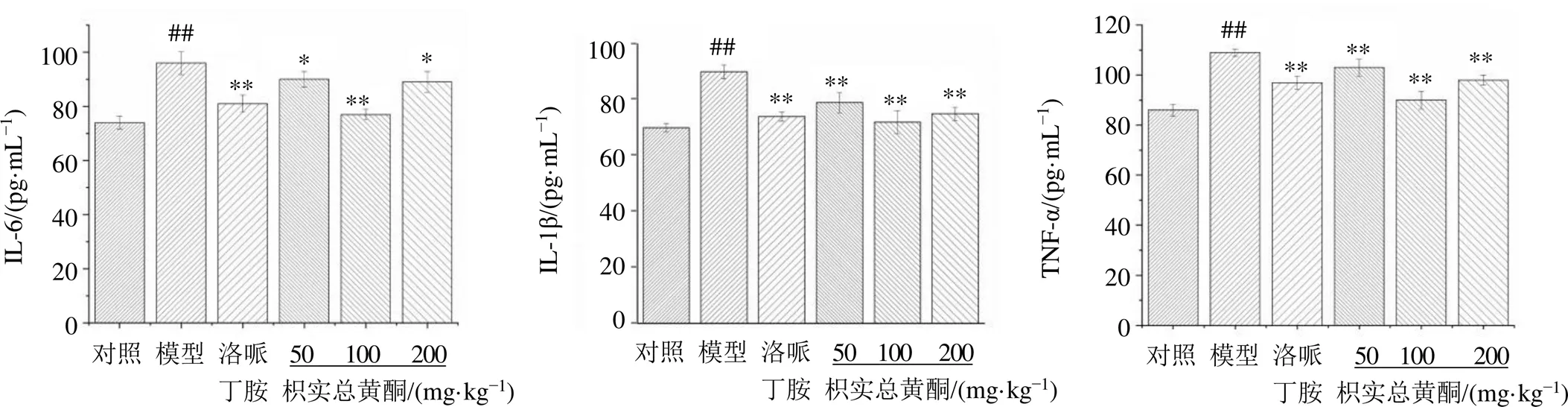
图4 枳实总黄酮对肠黏膜炎小鼠结肠组织中TNF-α、IL-1β和IL-6水平的影响
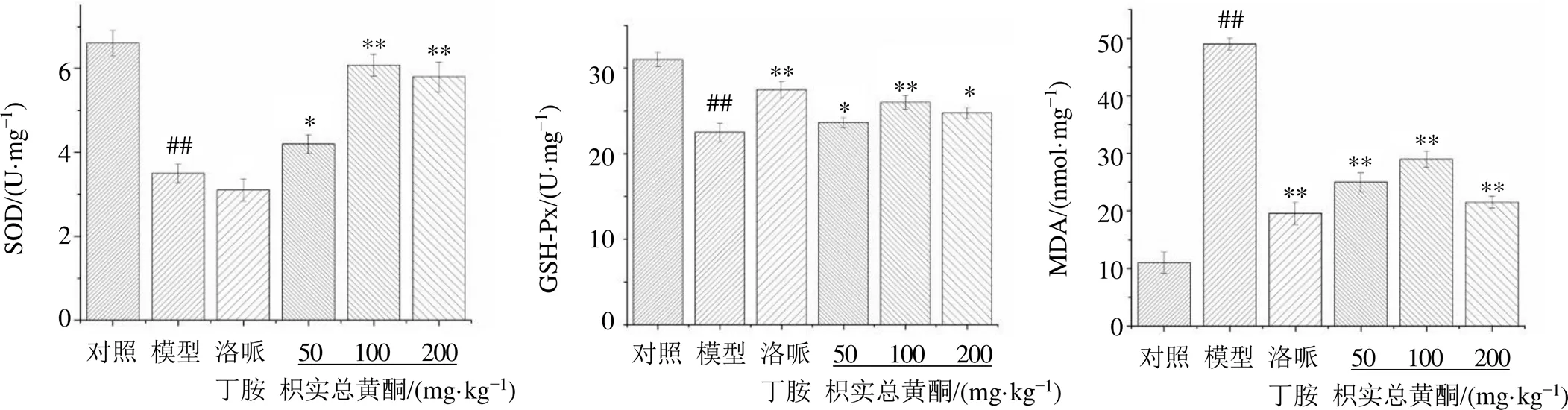
图5 枳实总黄酮对肠黏膜炎小鼠结肠组织中SOD、GSH-Px活性和MDA水平的影响
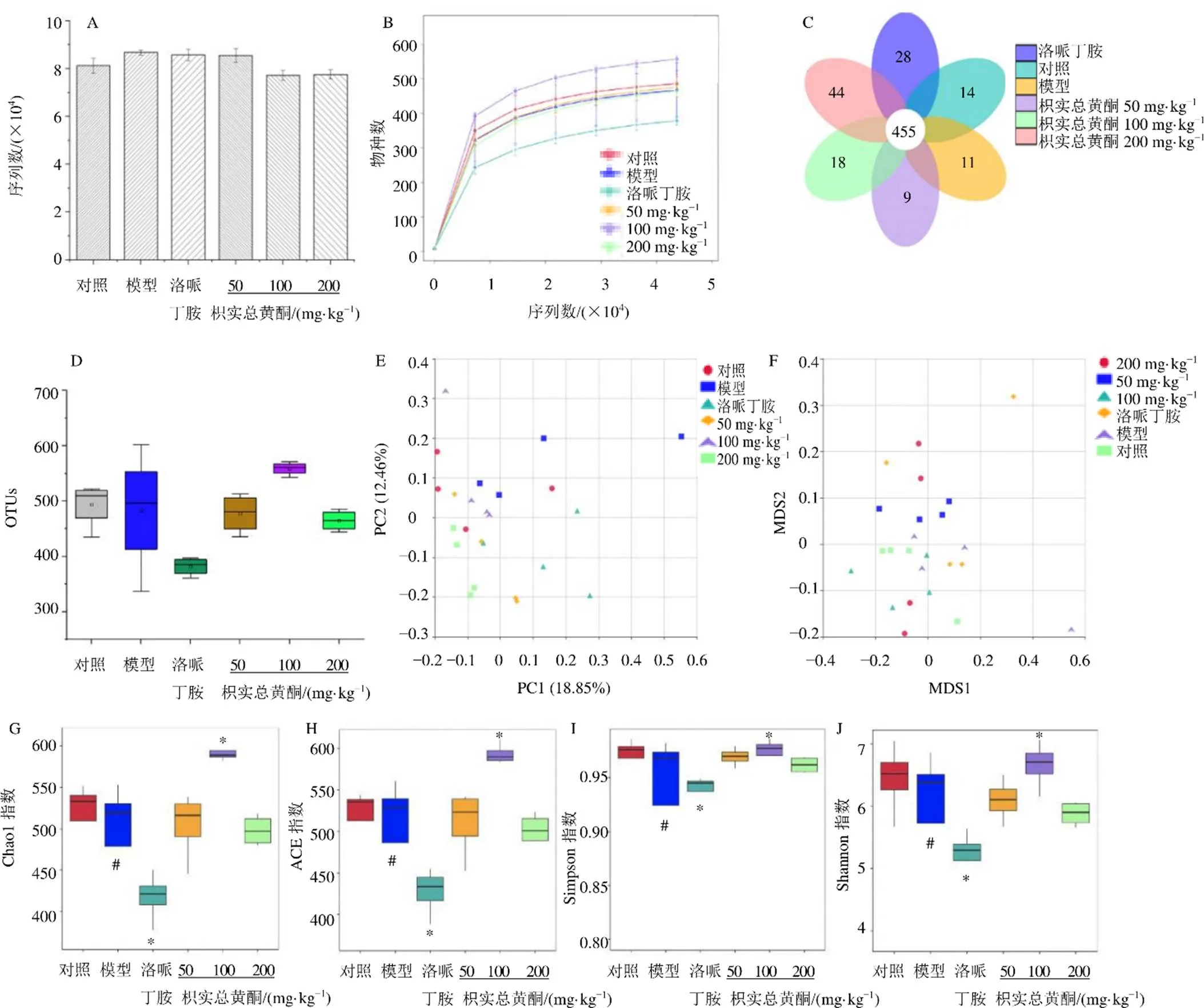
A-每个粪便样品的质量序列均低于97%一致性阈值 B-反光分析 C-OTU维恩图 D-各组OUT E-PCA散点图 F-NMDS散点图 G-Chao1指数 H-ACE指数 I-Simpson指数 J-Shannon指数
为了阐明不同群体之间微生物群结构变化,进行β多样性分析包括PCA和NMDS。如图6-E所示,PC1和PC2变化的百分比分别为18.85%和12.46%,模型组与其他5组样本相距较远,枳实总黄酮各剂量组较洛哌丁胺组更接近对照组,NMDS分析也观察到同样的结果(图6-F)。如图6-G~J所示,与对照组比较,模型组小鼠Chao1、ACE、Shannon和Simpson指数显著降低(<0.05);与模型组比较,枳实总黄酮中剂量组Chao1、ACE、Shannon和Simpson指数显著升高(<0.05),洛哌丁胺组Chao1、ACE、Simpson和Shannon指数显著降低(<0.05)。
综上,5-FU通过减少微生物群落丰富度和多样性改变了肠道菌群的整体结构,枳实总黄酮中剂量有效地恢复了肠道菌群的整体结构,洛哌丁胺使肠道微生物的丰富性和多样性的降低,使得肠道菌群的整体结构进一步恶化。
3.7 枳实总黄酮对肠黏膜炎小鼠肠道菌群的影响
如图7所示,在门水平上,拟杆菌门、厚壁菌门和变形杆菌门是各组的主要菌门。拟杆菌门、厚壁菌门、变形杆菌门、unidentified_Bacteria和放线菌门相对丰度分别为58.31%、34.52%、1.45%、4.10%和1.00%,占总丰度的99.38%。与对照组比较,模型组拟杆菌门和变形杆菌门分别增加至65.70%和3.67%,厚壁菌门和放线菌门分别减少至26.21%和0.37%;洛哌丁胺组及枳实总黄酮低、中剂量组厚壁菌门相对丰度分别恢复到31.70%、29.54%、37.86%。与对照组比较,模型组厚壁菌门/拟杆菌门(F/B)显著降低(<0.01);与模型组比较,洛哌丁胺组及枳实总黄酮低、中剂量组F/B显著升高(<0.05、0.01)。
如图8所示,在属水平上,对照组拟杆菌属、拟普雷沃菌属、乳酸杆菌属、unidentified_、、unidentified_、副拟杆菌属、幽门螺杆菌属、相对丰度分别为10.47%、10.56%、7.03%、0.32%、2.50%、2.64%、2.12%、3.65%、0.07%,占总丰度的39%以上;与对照组相比,模型组拟杆菌属、unidentified_、相对丰度分别增加到32.7%、1.69%、0.56%,拟普雷沃菌属、乳酸杆菌属、、unidentified_相对丰度分别降低到5.33%、6.07%、0.90%、0.96%。与模型组相比,各给药组拟杆菌属相对丰度降低,枳实总黄酮低、中剂量组unidentified_相对丰度降低;阳性药组和枳实总黄酮高剂量组拟普雷沃菌属相对丰度增加,枳实总黄酮高剂量组的乳酸杆菌属相对丰度升高。表明5-FU导致了明显的肠道菌群失调,枳实总黄酮可以有效地改善肠道菌群失调情况。

图7 枳实总黄酮对肠黏膜炎小鼠肠道菌群门水平相对丰度的影响

图8 枳实总黄酮对肠黏膜炎小鼠肠道菌群属水平相对丰度的影响
4 讨论
本研究结果表明,小鼠给予5-FU后,体质量严重降低,腹泻、饮食减少,饮水增加,皮毛松弛,懒动;枳实总黄酮可显著改善肠黏膜炎小鼠的一般状态,表明枳实总黄酮可以改善5-FU引起的不良反应[29];枳实总黄酮可以恢复肠黏膜炎小鼠的结肠长度,改善隐窝萎缩,抑制炎症因子水平,表明枳实总黄酮对结肠形态和黏膜具有保护作用;枳实总黄酮能够通过改善胸腺指数和脾脏指数恢复了肠黏膜炎小鼠受损的免疫功能。综上所述,枳实总黄酮可有效减轻5-FU引起的肠道不良反应,与文献报道一致[30-31]。
ROS、DNA、蛋白质和细胞膜相互作用以调节信号通路,通过产生促炎细胞因子导致组织破坏和炎症反应。5-FU通过抑制内源性抗氧化剂(如SOD、过氧化氢酶、GSH、GSH-Px)活性及升高MDA和促炎细胞因子(包括TNF-α、IL-1β、IL-6)水平,诱导肠黏膜炎[32]。本研究发现,小鼠给予5-FU后,结肠组织中SOD和GSH-Px活性降低,MDA、TNF-α、IL-1β和IL-6水平升高;枳实总黄酮能够提高SOD和GSH-Px活性,抑制MDA、TNF-α、IL-1β、IL-6水平。因此,枳实总黄酮能够通过抗氧化和抗炎来治疗5-FU诱导的肠黏膜炎。
5-FU干扰肠道微生物群落。通过16S rDNA扩增测序技术分析了各组小鼠粪便样本中的微生物群。结果表明,5-FU造模后小鼠肠道菌群的丰富度和多样性显著降低,从而肠道菌群的整体结构发生改变;枳实总黄酮中剂量组通过增加丰富度和多样性将肠道微生物群的整体结构调节到正常水平。
在门水平上,模型组小鼠肠道厚壁菌门相对丰度降低,拟杆菌门和变形杆菌门相对丰度增加,F/B降低;枳实总黄酮使肠道厚壁菌门相对丰度增加,拟杆菌门和变形杆菌门相对丰度降低,从而提高F/B。由于厚壁菌和变形杆菌是粪便相关菌,而拟杆菌被认为是黏膜相关菌,它们的丰度变化最有可能引发细菌感染和胃肠道疾病如腹泻和肠炎[33]。F/B是评估肠易激综合征[34]、炎症性肠病[35]和代谢紊乱[36]等肠病患者的常用指标。
在属水平上,模型组小鼠肠道拟杆菌属、unidentified_和相对丰度显著增加,而拟普雷沃菌属、乳酸杆菌属、和unidentified_相对丰度显著降低。拟杆菌是与5-FU治疗相关的重要病原菌之一,一些梭状芽孢杆菌如肉毒梭菌,由于产生外毒素而被认为是致病菌。益生菌乳杆菌可以改善5-FU引起的肠道损伤和生态失调[37]。瘤胃球菌通过产生丁酸盐为肠上皮细胞提供必需的能量,以提高肠道免疫力[38]。枳实总黄酮能够抑制潜在致病菌并促进了粪便中的益生菌,从而改善5-FU诱导的肠道微生物群失调。
枳实总黄酮的黏膜保护作用、枳实总黄酮中活性成分与肠道微生物群之间的具体关系仍待进一步确定。一是粪便群落不能完全代表生活在肠道中的细菌群落[39];二是当枳实总黄酮调节肠道微生物群的整体结构时,其黏膜保护作用和成分可能会受到肠道微生物代谢和药动学的影响[40]。例如,在枳实总黄酮中分别占15.45%、39.19%的柚皮苷和橙皮苷对人体肠道微生物群(半乳糖拟杆菌、乳酸杆菌、肠球菌、链状双歧杆菌、布氏瘤胃球菌、大肠杆菌)没有表现出体外抑制活性,但苷元缺表现出体外抑制活性[41]。因此,枳实总黄酮活性成分和肠道微生物群变异之间关系的系统和全面解释将是本课题组后续研究的重点。
综上所述,枳实总黄酮可以通过抑制氧化应激、抑制促炎细胞因子分泌并调节肠道微生物群的整体结构和组成,有效减轻5-FU诱导的肠黏膜炎。
利益冲突 所有作者均声明不存在利益冲突
[1] Ducreux M, Bennouna J, Hebbar M,. Capecitabine plus oxaliplatin (XELOX) versus 5-fluorouracil/ leucovorin plus oxaliplatin (FOLFOX-6) as first-line treatment for metastatic colorectal cancer [J]., 2011, 128(3): 682-690.
[2] Longley D B, Harkin D P, Johnston P G. 5-Fluorouracil: Mechanisms of action and clinical strategies [J]., 2003, 3(5): 330-338.
[3] Miura K, Kinouchi M, Ishida K,. 5-Fu metabolism in cancer and orally-administrable 5-fu drugs [J].(Basel), 2010, 2(3): 1717-1730.
[4] Zhang S, Liu Y, Xiang D,. Assessment of dose-response relationship of 5-fluorouracil to murine intestinal injury [J]., 2018, 106: 910-916.
[5] Daniele B, Secondulfo M, De Vivo R,. Effect of chemotherapy with 5-fluorouracil on intestinal permeability and absorption in patients with advanced colorectal cancer [J]., 2001, 32(3): 228-230.
[6] dos Santos Filho E X, Ávila P H M, Bastos C C C,. Curcuminoids fromlonga L. reduced intestinal mucositis induced by 5-fluorouracil in mice: Bioadhesive, proliferative, anti-inflammatory and antioxidant effects [J]., 2016, 3: 55-62.
[7] Sonis S T, Elting L S, Keefe D,. Perspectives on cancer therapy-induced mucosal injury: Pathogenesis, measurement, epidemiology, and consequences for patients [J]., 2004, 100(9 Suppl): 1995-2025.
[8] Lee C S, Ryan E J, Doherty G A. Gastro-intestinal toxicity of chemotherapeutics in colorectal cancer: The role of inflammation [J]., 2014, 20(14): 3751-3761.
[9] Hamouda N, Sano T, Oikawa Y,. Apoptosis, dysbiosis and expression of inflammatory cytokines are sequential events in the development of 5-fluorouracil- induced intestinal mucositis in mice [J]., 2017, 121(3): 159-168.
[10] Von Bültzingslöwen I, Adlerberth I, Wold A E,. Oral and intestinal microflora in 5-fluorouracil treated rats, translocation to cervical and mesenteric lymph nodes and effects of probiotic bacteria [J]., 2003, 18(5): 278-284.
[11] van Vliet M J, Harmsen H J, de Bont E S,. The role of intestinal microbiota in the development and severity of chemotherapy-induced mucositis [J]., 2010, 6(5): e1000879.
[12] Iacovelli R, Pietrantonio F, Palazzo A,. Incidence and relative risk of grade 3 and 4 diarrhoea in patients treated with capecitabine or 5-fluorouracil: A meta- analysis of published trials [J]., 2014, 78(6): 1228-1237.
[13] Stein A, Voigt W, Jordan K. Review: Chemotherapy-induced diarrhea: Pathophysiology, frequency and guideline-based management [J]., 2010, 2(1): 51-63.
[14] Benson A B, Ajani J A, Catalano R B,. Recommended guidelines for the treatment of cancer treatment-induced diarrhea [J]., 2004, 22(14): 2918-2926.
[15] Gibson R J, Keefe D M K, Lalla R V,. Systematic review of agents for the management of gastrointestinal mucositis in cancer patients [J]., 2013, 21(1): 313-326.
[16] Kurita A, Kado S, Kaneda N,. Modified irinotecan hydrochloride (CPT-11) administration schedule improves induction of delayed-onset diarrhea in rats [J]., 2000, 46(3): 211-220.
[17] Liu W Y, Zhou C, Yan C M,. Characterization and simultaneous quantification of multiple constituents inextracts by HPLC-DAD- ESI-MS/MS [J]., 2012, 10(6): 456-463.
[18] 张霄潇, 李正勇, 马玉玲, 等. 中药枳实的研究进展 [J]. 中国中药杂志, 2015, 40(2): 185-190.
[19] Viuda-Martos M, Ruiz-Navajas Y, Fernández-López J,. Antifungal activity of lemon (L.), mandarin (L.), grapefruit (L.) and orange (L.) essential oils [J]., 2008, 19(12): 1130-1138.
[20] de Moraes Pultrini A, Almeida Galindo L, Costa M. Effects of the essential oil fromL. in experimental anxiety models in mice [J]., 2006, 78(15): 1720-1725.
[21] Zarrad K, Hamouda A B, Chaieb I,. Chemical composition, fumigant and anti-acetylcholinesterase activity of the TunisianL. essential oils [J]., 2015, 76: 121-127.
[22] Fugh-Berman A, Myers A., an ingredient of dietary supplements marketed for weight loss: Current status of clinical and basic research [J].(Maywood), 2004, 229(8): 698-704.
[23] Yu J, Wang L, Walzem R L,. Antioxidant activity oflimonoids, flavonoids, and coumarins [J]., 2005, 53(6): 2009-2014.
[24] Manthey J A, Guthrie N. Antiproliferative activities offlavonoids against six human cancer cell lines [J]., 2002, 50(21): 5837-5843.
[25] Kim J A, Park H S, Kang S R,. Suppressive effect of flavonoids from KoreanL. on the expression of inflammatory mediators in L6 skeletal muscle cells [J]., 2012, 26(12): 1904-1912.
[26] Takase H, Yamamoto K, Hirano H,. Pharmacological profile of gastric mucosal protection by marmin and nobiletin from a traditional herbal medicine, Aurantii fructus immaturus [J]., 1994, 66(1): 139-147.
[27] Tan W, Li Y, Wang Y,. Anti-coagulative and gastrointestinal motility regulative activities ofand its effective fractions [J]., 2017, 90: 244-252.
[28] Nakajima A, Yamakuni T, Haraguchi M,. Nobiletin, aflavonoid that improves memory impairment, rescues bulbectomy-induced cholinergic neurodegeneration in mice [J]., 2007, 105(1): 122-126.
[29] Atiq A, Shal B, Naveed M,. Diadzein ameliorates 5-fluorouracil-induced intestinal mucositis by suppressing oxidative stress and inflammatory mediators in rodents [J]., 2019, 843: 292-306.
[30] Wang J, Feng W, Zhang S,. Ameliorative effect ofessential oil combined withtotal saponins on 5-fluorouracil induced diarrhea is associated with gut microbial modulation [J]., 2019, 238: 111887.
[31] Wang J, Feng W, Zhang S,. Gut microbial modulation in the treatment of chemotherapy-induced diarrhea with Shenzhu Capsule [J]., 2019, 19(1): 126.
[32] Ali J, Khan A U, Shah F A,. Mucoprotective effects of saikosaponin-A in 5-fluorouracil-induced intestinal mucositis in mice model [J]., 2019, 239: 116888.
[33] Rangel I, Sundin J, Fuentes S,. The relationship between faecal-associated and mucosal-associated microbiota in irritable bowel syndrome patients and healthy subjects [J]., 2015, 42(10): 1211-1221.
[34] Louis S, Tappu R M, Damms-Machado A,. Characterization of the gut microbial community of obese patients following a weight-loss intervention using whole metagenome shotgun sequencing [J]., 2016, 11(2): e0149564.
[35] Rojas-Feria M, Romero-García T, Fernández Caballero- Rico J Á,. Modulation of faecal metagenome in Crohn’s disease: Role of microRNAs as biomarkers [J]., 2018, 24(46): 5223-5233.
[36] Yakoob J, Abbas Z. Role of Omega-3 fatty acids in irritable bowel syndrome (IBS) [J]., 2016, 6(8): 271-277.
[37] Tang Y, Wu Y, Huang Z,. Administration of probiotic mixture DM#1 ameliorated 5-fluorouracil-induced intestinal mucositis and dysbiosis in rats [J]., 2017, 33: 96-104.
[38] Leonel A J, Alvarez-Leite J I. Butyrate: Implications for intestinal function [J]., 2012, 15(5): 474-479.
[39] Liu S, da Cunha A P, Rezende R M,. The host shapes the gut microbiota via fecal MicroRNA [J]., 2016, 19(1): 32-43.
[40] Feng W, Ao H, Peng C,. Gut microbiota, a new frontier to understand traditional Chinese medicines [J]., 2019, 142: 176-191.
[41] Duda-Chodak A. The inhibitory effect of polyphenols on human gut microbiota [J]., 2012, 63(5): 497-503.
Effect of total flavonoids fromon intestinal flora imbalance in mice with intestinal mucositis induced by 5-fluorouracil
LIU Dan-ning, PAN Meng-xue, YANG Lu-jia, HUANG Jie-yao, REN Qiao, YUAN Lyu-jiang
College of Pharmaceutical Sciences, Southwest University, Chongqing 400715, China
To study the effect and mechanism of total flavonoids from Zhishi (, AFIF) on mice with intestinal mucositis induced by 5-fluorouracil (5-FU).Male Kunming mice were randomly divided into control group, model group, low-, medium- and high-dose AFIF (50, 100, 200 mg/kg) groups and loperamide (0.3 mg/kg) group. 5-FU (50 mg/kg) was injected intraperitoneally for 5 d to induce intestinal mucositis model. Beginning on day 6, rats in each administration group were ig corresponding drugs, once a day for 7 consecutive days. The body weight, diet intake, water intake, diarrhea score, thymus index, spleen index, colon morphology and crypt depth were observed. Hematoxylin-eosin (HE) staining was used to investigate the pathological changes of colon. Levels of interlerkin-6 (IL-6), IL-1β and tumor necrosis factor-α (TNF-α) in colon tissues were determined by ELISA; Superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) activities, and malondialdehyde (MDA) level were detected; 16S rRNA gene V3—4 regions for high throughput sequencing technology was used to analysis the changes of intestinal flora.Compared with model group, body weight and food intake of mice in AFIF groups were increased, water intake and diarrhea score were decreased, thymus and spleen index were significantly increased (< 0.05, 0.01), colon tissue damage was reduced, colon length and crypt depth were significantly increased (< 0.05, 0.01); Levels of pro-inflammatory cytokines IL-6, IL-1β and TNF-α in colon tissue were significantly reduced (< 0.05, 0.01); Activities of SOD and GSH-Px were significantly increased (< 0.05, 0.01), and MDA level was significantly decreased (< 0.01). 16S rRNA gene sequencing results showed that diversity and abundance of intestinal flora of mice in model group was reduced, diversity and abundance of intestinal flora of mice in AFIF groups were increased. At phylum level, the relative abundance of Firmicutes was increased in AFIF groups. At genus level, the relative abundance of, unidentified_,, unidentified_andwere increased.AFIF can effectively improve 5-FU induced intestinal mucositis in mice, and its mechanism may be related to the anti-oxidation, anti-inflammatory and regulation of intestinal flora.
total flavonoids from; 5-fluorouracil; intestinal mucositis; intestinal flora; anti-oxidant; anti-inflammatory; narirutin; naringin; hesperidin
R285.5
A
0253 - 2670(2021)23 - 7204 - 10
10.7501/j.issn.0253-2670.2021.23.014
2021-08-16
重庆科委社会事业与民生保障科技创新专项(cstc2017shmsA10004)
刘丹宁(1993—),女,硕士研究生,主要从事中药活性成分研究。E-mail: 2427817565@qq.com
袁吕江,教授,硕士生导师,主要从事中药活性成分研究。E-mail: yuanlujiang@hotmail.com
任 巧,副教授,硕士生导师,主要从事中药活性成分研究。E-mail: qren2014@swu.edu.cn
[责任编辑 李亚楠]

