凹唇姜精油包结物的制备及其对鲜切草鱼肉冷藏品质的影响
王 娅,李 荣,*,姜子涛,2,*,王 颖,谭 津,汤书华
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津天狮学院食品工程学院,天津 301700)
草鱼(Ctenopharyngodon idellus)属于鲤形目鲤科草鱼属,是中国淡水养殖的“四大家鱼”之一,2018年养殖产量达到550.43万 t,居淡水鱼之首[1]。其因含较高水分、富含不饱和脂肪酸、内源酶活性高以及pH值呈中性等易腐败而较难加工贮运[2]。因此研究延长草鱼肉货架期并保持其良好品质具有重要意义。近年来,随着绿色食品概念的兴起,保鲜材料开始向天然无毒的生物活性物质的方向发展,健康、安全的天然保鲜剂运用于水产品中已成为研究热点及发展趋势[3-7]。
植物源生物保鲜剂在抗氧化和抑菌等方面有独特优势,安全性争议小,消费者接受度高,应用潜力巨大[3]。凹唇姜(Boesenbergia rotunda(L.) Mansf.)为姜科凹唇姜属[8],别名泰国沙姜、甲猜等,素有姜中人参的美称。凹唇姜是我国南方、泰国、印度尼西亚以及马来西亚等东南亚国家传统的调味香料,用法同生姜。凹唇姜含有黄酮[9-11]、多酚[10-11]等化学成分,因此具有一定的抗氧化[10,12-13]、抗菌[13-14]、抗细胞毒性[12]等生物活性。凹唇姜也含有精油[14],但迄今鲜有凹唇姜精油及其应用方面的报道。精油具有易挥发的特性,且在光、热和氧的作用下很容易被氧化降解。环糊精金属有机骨架化合物(cyclodextrin metal-organic frameworks,CD-MOFs)是一类由可再生和可食用的基本单元环糊精和对身体无害的金属合成的经典绿色材料[15],将精油包结在CD-MOFs中可避免其与光和氧气的直接接触,可防止其氧化降解,并且精油在其空腔内释放缓慢,可有效提高精油的保存率和利用率;因此,CD-MOFs是精油抗氧化剂的理想壁材选择。国内外有较多关于草鱼生物保鲜技术的研究[1-2,16-20],但将β-CD-MOFs-精油包结物应用于鲜切草鱼肉的保鲜鲜见报道。
本实验以凹唇姜精油(Boesenbergia rotundaessential oil,BEO)为芯材、β-环糊精金属钾有机骨架材料(K-β-CD-MOF)为壁材,采用饱和水溶液法制备凹唇姜精油包结物(BEO-K-β-CD-MOF),并利用傅里叶变换红外光谱和X射线衍射法对BEO-K-β-CD-MOF结构进行表征;再将制备的BEO-K-β-CD-MOF添加到鲜切草鱼肉中,考察其对冷藏鲜切草鱼肉的品质及氧化稳定性的影响。
1 材料与方法
1.1 材料与试剂
凹唇姜为广州市售。
鲜活草鱼(1~2 kg)购自于天津华润超市。
β-CD 上海化学试剂采购供应站联营企业中心化工厂;甲醇(分析纯) 天津市科密欧化学试剂有限公司;三氯乙酸、石油醚、冰乙酸 天津市风船化学试剂科技有限公司;无水乙醇 天津市汇杭化工科技有限公司;氢氧化钾 天津市凯通试剂有限公司;2-硫代巴比妥酸(thiobarbituric acid,TBA) 上海阿拉丁生化科技股份有限公司;三氯甲烷 天津市化学试剂供销公司。
1.2 仪器与设备
IRIS VA400电子眼 法国Alpha MOS公司;TA.XT plus质构仪 英国Stable Micro Systems公司;Multisynth微波反应器 意大利Milestone公司;U-3900紫外-可见分光光度计 日本日立公司;Nicolet iS10型傅里叶变换红外光谱仪 美国Thermo公司;DX-2500 X射线衍射仪丹东方圆仪器有限公司;BP211D十万分之一电子分析天平 德国Satorius公司。
1.3 方法
1.3.1 BEO的提取
将凹唇姜根茎粉碎后,用微波辅助提取法提取BEO[21],将所获得的BEO经无水硫酸钠干燥,经0.22 μm膜过滤后,置于棕色瓶中备用。
1.3.2 K-β-CD-MOF的合成
参照文献[21]方法进行K-β-CD-MOF的合成,显微镜下观察其形貌后放于干燥器中储存备用。
1.3.3 BEO-K-β-CD-MOF的制备
参考文献[22]方法并作一定修改,将BEO乙醇溶液(取1.116 g BEO,加10 mL无水乙醇溶解)按不同芯壁比(1∶3、1∶5、1∶8、1∶10、1∶12,m/m)缓慢滴加至K-β-CD-MOF饱和溶液中,在4 ℃冰箱中冷藏24 h后抽滤,再用石油醚洗涤2~3 次后置于60 ℃恒温箱中干燥至恒质量,即得到包结物粉末,显微镜下观察其形貌后放于干燥器中储存备用。
1.3.4 包结率的测定
标准曲线的绘制:分别量取0、1、2、3、4、5 mL 0.075 mg/mL BEO标准溶液加入到10 mL比色管中,用体积分数45%乙醇溶液定容后摇匀。测定其在277 nm波长处的吸光度,以BEO终质量浓度为横坐标、吸光度为纵坐标绘制标准曲线。
包结率的测定:参考文献[22-23]的方法并稍作修改,用体积分数45%乙醇溶液溶解0.04 g BEO-K-β-CDMOF后转移至50 mL的容量瓶中定容,60 W超声振荡15 min,静置后吸取上清液,在277 nm波长处测定其吸光度,通过BEO标准曲线得到BEO的质量浓度,按照公式(1)计算包结率。

式中:m1表示包结物中的BEO质量/g;m表示加入的BEO质量/g。
1.3.5 BEO-K-β-CD-MOF的微观结构观察
采用扫描电子显微镜对BEO-K-β-CD-MOF以及物理混合物(BEO与K-β-CD-MOF按质量比1∶10物理混合,下同)的形态进行观察。取微量的样品粉末于粘有双面胶的玻片上,用洗耳球吹去未粘住的粉末,并进行喷金处理,进行样品扫描。
1.3.6 BEO-K-β-CD-MOF结构的表征
1.3.6.1 傅里叶变换红外光谱分析
分别将β-CD、K-β-CD-MOF、BEO-K-β-CD-MOF以及物理混合物与干燥后的KBr以质量比1∶100混合研磨均匀;另取一份KBr研磨压片,在其表面涂抹上BEO。将以上样品在400~4 000 cm-1波数范围内进行傅里叶变换红外光谱扫描。
1.3.6.2 X射线衍射分析
分别取β-CD、K-β-CD-MOF、BEO-K-β-CD-MOF以及物理混合物进行X射线衍射分析,分析条件:2θ为5°~80°,扫描时间为10 min,扫描速率为7.5(°)/min。以测得的X射线衍射强度(I)与最强衍射峰的强度(I0)的比值(I/I0)为纵坐标,以2θ为横坐标作图。
1.3.7 BEO-K-β-CD-MOF的稳定性分析
称取一定量的包结物粉末与物理混合物,在日常照明光照下照射(12 h光照/12 h黑暗),分别在第2、4、6、8、10天测定BEO保留率以研究其光稳定性;于25~75 ℃的恒温干燥箱中保存,放置12 h后测定BEO保留率研究其热稳定性;参考聂吉语等[22]的方法,将一定量的包结物与物理混合物分别用体积分数45%乙醇溶液配制成质量浓度为0.075 mg/mL的溶液,再加入等体积的pH值分别为3、7、10的磷酸缓冲液置于室温下每隔1 d测定BEO保留率研究其酸碱稳定性。保留率根据公式(2)进行计算,分别设定初始条件下(25℃、0 d)的精油保留率为100%。

1.3.8 BEO-K-β-CD-MOF对鲜切草鱼肉品质及抗氧化效果的评价
1.3.8.1 鲜切草鱼样品的处理
将活草鱼击毙,去头、鳞及内脏,用预冷的无菌水清洗干净,沿脊椎剖为两半,取相同部位,剔除鱼骨,切成20 mm×10 mm×10 mm的鱼块((5.0±0.2)g)作为鲜切鱼肉样品,再将鱼肉样品分为7 组(编号A~G),每组3 块,分别放入蒸馏水(A组,空白)或不同的抗氧化剂溶液(B~G组)中浸渍处理30 min,沥干后用保鲜袋装好放入(4±1)℃条件下冷藏,每隔1 d对鱼肉样进行各指标的测定。
抗氧化剂均由45%乙醇溶液配制,各组的抗氧化剂溶液分别如下:B组:0.01 g/100 mL BEO;C组:0.03 g/100 mL BEO;D组:0.05 g/100 mL BEO;E组:0.1 g/100 mL BEO-K-β-CD-MOF;F组:0.3 g/100 mL BEO-K-β-CD-MOF;G组:0.5 g/100 mL BEO-K-β-CD-MOF。
1.3.8.2 失水率的测定
参考文献[17]的方法并稍作修改,用十万分之一电子分析天平称量保鲜袋的质量(m1/g)、第0天保鲜袋和样品的总质量(m2/g)以及每隔1 d取出鱼肉样品并将其表面水分吸干后的质量(m3/g)。失水率按公式(3)计算。
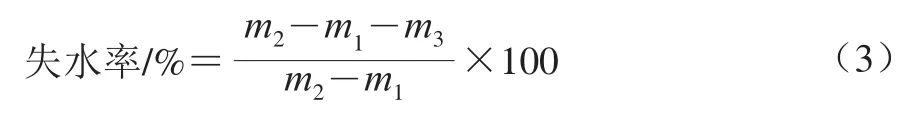
1.3.8.3 硫代巴比妥酸反应物值的测定
鱼肉样绞碎后参考参照文献[20,24]的方法测定硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值,测定处理好的鱼肉样液在532 nm和600 nm波长处的吸光度,TBARS值按公式(4)计算。

式中:155为丙二醛的摩尔吸光系数/(L/(mmol·cm));72.06为丙二醛的摩尔质量/(g/mol);m表示样品质量/g。
1.3.8.4 质构特性的测定
质构特性通过质构仪测定,具体参考王垚等[25]的方法并稍作修改,探头型号选取P50,测试前速率为2.00 mm/s,测试中速率为1.00 mm/s,测试后速率为1.00 mm/s,压缩程度为40%,时间间隔为5 s,压缩次数为2。
1.3.8.5 色泽的测定
将鱼肉样置于黑色背景卡纸上,采用IRIS VA400电子眼,经校正后采用底部-底部照明方式对样品进行图象的采集,每个样品进行多面的采集。采用Alpha Soft V14.2软件进行图片处理与数据分析。
1.4 数据统计与分析
每组实验均平行3 次,使用Origin 8.0软件作图,利用Statistics 19软件进行数据统计分析,采用S-N-K多重比较法进行差异显著性分析(P<0.05),由Alpha Soft V14.2软件对色泽结果进行主成分分析。
2 结果与分析
2.1 BEO-K-β-CD-MOF的微观结构
如图1A、B所示,K-β-CD-MOF为表面带有纹路的立方晶体,而包结BEO后为立方体,表面光滑且尺寸明显减小。物理混合物和BEO-K-β-CD-MOF包结物微观结构分布分别如图1C、D所示,可以看出在相同放大倍数下,BEO-K-β-CD-MOF结构中,BEO进入K-β-CD-MOF空腔内使其内部结构发生改变,外部形态仍保留了K-β-CD-MOF的晶型,但尺寸减小。

图1 K-β-CD-MOF和BEO-K-β-CD-MOF的显微镜和扫描电子显微镜照片Fig. 1 Optical microscope and scanning electron microscope images of K-β-CD-MOF and BEO-K-β-CD-MOF
2.2 BEO-K-β-CD-MOF的包结率
BEO质量浓度(ρ/(mg/mL))与吸光度(A277nm)之间的标准曲线回归方程为:A277nm=8.253 33ρ+0.004 1(R2=0.999 4)。再按照公式(1)计算得不同芯壁比下的包结率,结果见图2。当芯壁比为1∶10时包结率最大,为71.70%。
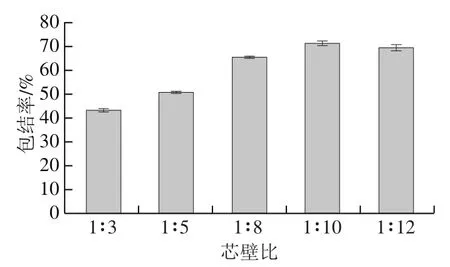
图2 不同芯壁比下BEO-K-β-CD-MOF的包结率Fig. 2 Inclusion rates of BEO-K-β-CD-MOF with different core-to-wall ratios
2.3 BEO-K-β-CD-MOF的结构表征结果
2.3.1 傅里叶变换红外光谱法表征结果
如图3所示,K-β-CD-MOF和β-CD的红外光谱图相似,在K-β-CD-MOF的傅里叶变换红外光谱图中出现了860、945、1 029、1 163、1 647、2 927、3 411 cm-1等处属于β-CD的特征吸收峰,由此表明K-β-CD-MOF保留了β-CD的空腔结构。BEO的傅里叶变换红外光谱图中,1 743 cm-1处是C=O的特征伸缩振动峰,1 638 cm-1处为C=C的特征吸收峰;在2 884、2 928、2 964 cm-1处为C—H伸缩振动峰[26]。在物理混合物的傅里叶变换红外光谱图中,既有K-β-CD-MOF的特征吸收峰,又有BEO的特征吸收峰。而在BEO-K-β-CD-MOF的傅里叶变换红外光谱图中,BEO于1 377、1 450、1 638、1 674、1 743、2 964 cm-1处的特征峰已被掩埋或消失,表明BEO已完全进入K-β-CD-MOF空腔与之形成包结物。但BEO-K-β-CD-MOF傅里叶变换红外光谱图中存在1 029、1 056、1 080 cm-1等K-β-CD-MOF的特征吸收峰,说明BEO-K-β-CD-MOF仍然保留了K-β-CD-MOF的部分晶体结构。
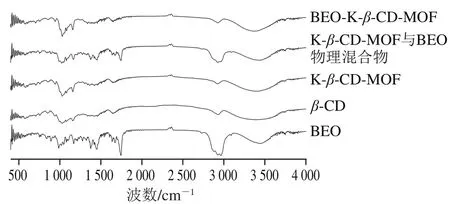
图3 BEO-K-β-CD-MOF傅里叶变换红外光谱图Fig. 3 Fourier transform infrared spectra of BEO-K-β-CD-MOF
2.3.2 X射线衍射法表征结果
由图4可知,β-CD与K-β-CD-MOF的X射线衍射图谱都有强度较高的衍射峰,K-β-CD-MOF的图谱中保留了β-CD的9.08°和12.46°的衍射峰,与陆洪军等[15]的研究结果一致,但是K-β-CD-MOF与β-CD相比衍射峰数量变多,说明形成了K-β-CD-MOF特有的晶体结构(图4)。物理混合物与K-β-CDMOF有类似的衍射峰,但物理混合物中部分峰强度增加,可能是精油附着在K-β-CD-MOF表面所致。然而BEO-K-β-CD-MOF较K-β-CD-MOF峰数大量减少且强度明显降低,表明BEO已完全进入K-β-CD-MOF空腔内,形成新的晶体结构,但BEO-K-β-CD-MOF中没有新的衍射峰出现,说明仍保留了K-β-CD-MOF的部分形态。
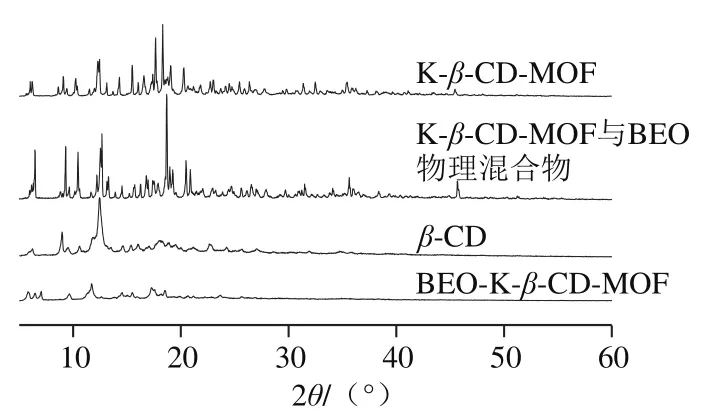
图4 BEO-K-β-CD-MOF X射线衍射图Fig. 4 X-ray diffraction pattern of BEO-K-β-CD-MOF
2.4 BEO-K-β-CD-MOF的稳定性
由图5可知,随着日常光照时间的延长或温度的升高,包结物及物理混合物中的BEO含量均逐渐降低,但两条件下的包结物保留率均远高于物理混合物。日常光照第10天时,包结物中BEO保留率(95.60%)约为物理混合物(47.67%)的2 倍;在75 ℃下处理12 h,包结物中BEO保留率(86.07%)约为物理混合物(20.67%)的4 倍。由图6可知,在保存第10天时,在中性环境下包结物中的BEO比物理混合物中的BEO稳定性较好,而在强碱下两者都极不稳定,在第10天时,酸性条件下包结物的BEO稳定性较物理混合物好,其包结物保留率较物理混合物提升21.6%。从总体上看,BEO-K-β-CD-MOF具有较好的光、热及酸碱稳定性,且更适合于在酸性和中性环境中使用。
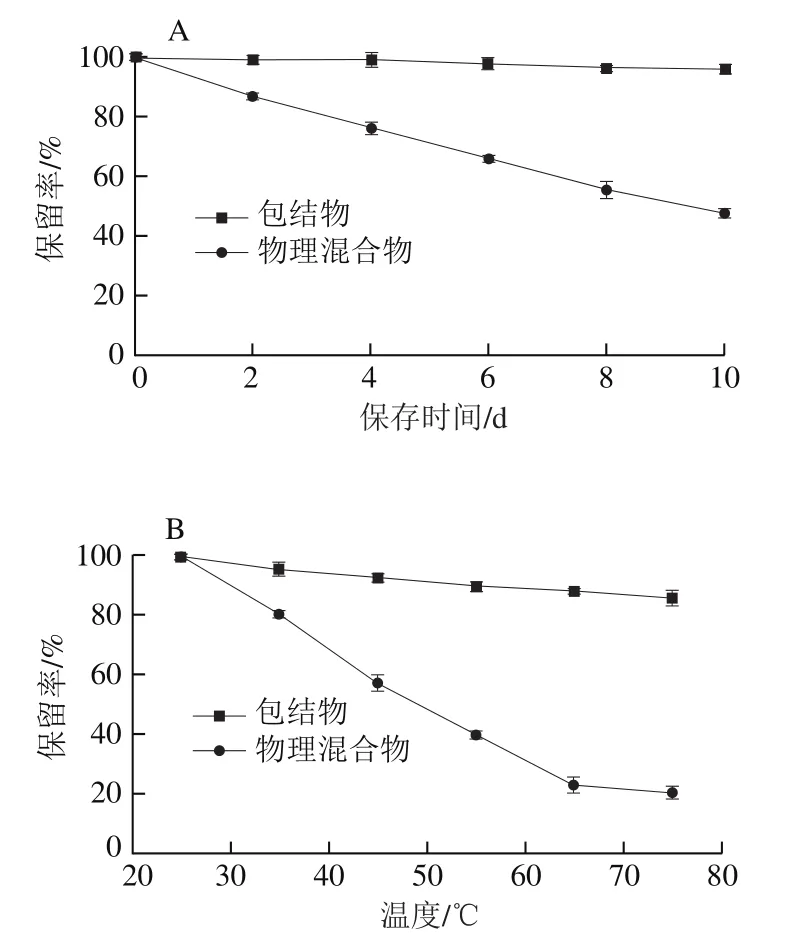
图5 日常光照(A)及温度(B)对BEO-K-β-CD-MOF稳定性的影响Fig. 5 Effects of daily light (A) and temperature (B) on stability of BEO and BEO-K-β-CD-MOF
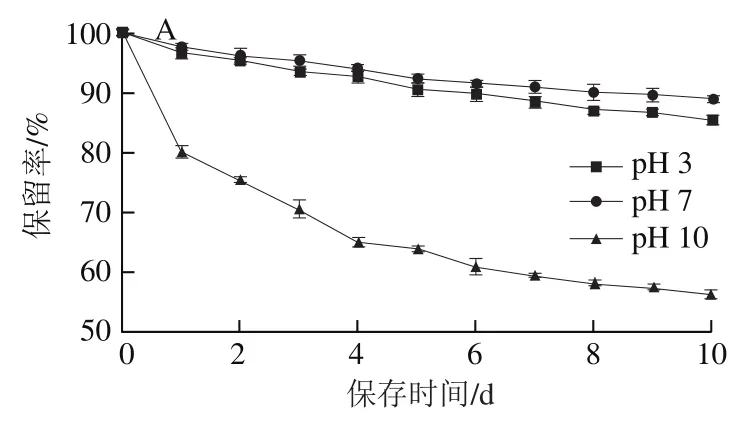
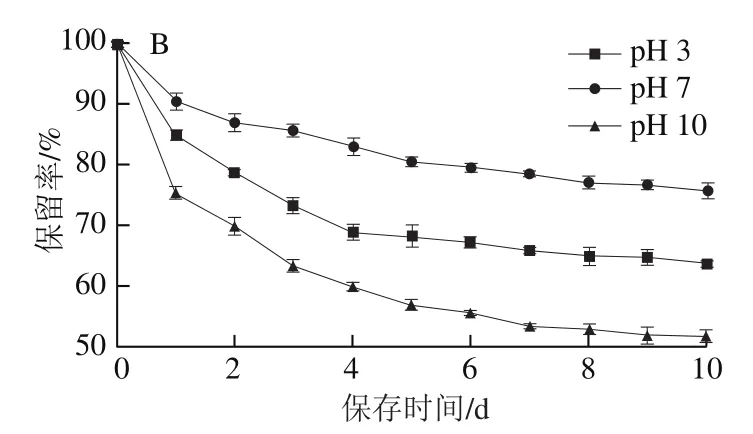
图6 pH值对BEO-K-β-CD-MOF(A)、物理混合物(B)稳定性的影响Fig. 6 Effect of pH on stability of BEO-K-β-CD-MOF (A) and their physical mixture (B)
2.5 BEO-K-β-CD-MOF对鲜切草鱼肉品质的影响
2.5.1 BEO-K-β-CD-MOF对鲜切草鱼肉失水率的影响
水分流失会导致鱼肉中无机盐、蛋白质等营养物质的流失,严重影响其感官与品质。如图7所示,7 组样品的失水率均随冷藏时间的延长呈现上升的趋势,但与空白组A组相比,其他组在6 d内的上升速率较为缓慢,表明BEO可以抑制鲜切草鱼肉中水分的流失。6 d后B、C、D组在6 d后的失水率迅速上升,在第10天时,B(19.17%)、C(17.48%)、D(17.17%)组的失水率接近A组(19.48),而包结物处理组(E、F、G组)失水率在整个冷藏过程中升高均较缓慢。表明随着时间的延长,BEO处理组(B、C、D组)作用效果减弱。在冷藏的第10天,添加BEO和包结物的鲜切草鱼肉与未经处理过的鲜切草鱼肉相比,失水率分别降低了1.6%~11.9%和35.0%~64.0%,表明包结物抑制水分流失的效果优于BEO。这是由于包结物具有较好的缓释性,延长了BEO抗氧化的时效。BEO-K-β-CD-MOF可以通过抑制脂肪氧化来影响蛋白质氧化从而减轻肌肉纤维收缩而提高肌肉的保水性[27]。

图7 草鱼冷藏过程中失水率的变化Fig. 7 Change in dripping loss rates of grass carp during refrigerated storage
2.5.2 BEO-K-β-CD-MOF对鲜切草鱼肉TBARS值的影响
通过TBARS值可以评价鲜切草鱼肉脂肪的最终氧化程度。由图8可知,鲜切草鱼最初的TBARS值在0.1 mg/kg以下,而在冷藏6 d后,A组TBARS值就超过不可食用阈值区间(1.0~2.0 mg/kg)[28]的最大值,说明草鱼肉已完全腐败。而其他处理组TBARS值均未超过2 mg/kg,表明BEO具有较好的抗氧化能力,能抑制鲜切草鱼肉脂肪氧化。BEO处理组(B、C、D组)TBARS值在冷藏4 d后开始快速上升,且在第6天时D组超过E组,而经包结物处理的3 组TBARS值均上升较缓慢,到第10天时,添加BEO和包结物的鲜切草鱼肉与未经处理过的鲜切草鱼肉相比,TBARS值分别降低了3.4%~21.7%和46.0%~71.1%。以上结果表明,包结物在抑制脂肪氧化的能力强于BEO。脂肪氧化会使鱼肉产生不良风味,并可能形成有毒化合物[29]。
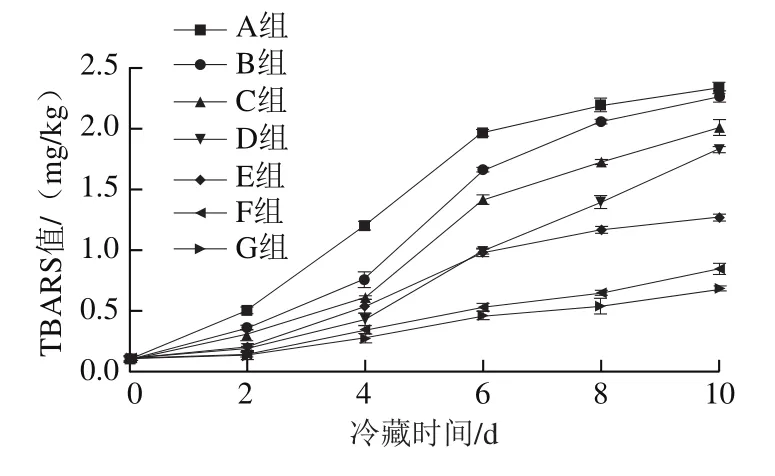
图8 鲜切草鱼冷藏过程中TBARS值的变化Fig. 8 Change in TBARS value of grass carp during refrigerated storage
2.5.3 BEO-K-β-CD-MOF对鲜切草鱼肉冷藏过程中质构特性的影响
由表1可知,不同处理组的鲜切草鱼肉的硬度与咀嚼性在冷藏过程呈先升高后下降的趋势。在10 d冷藏期内,B、C、D组鲜切草鱼肉硬度与空白组A组相比差异不显著,而F、G组在冷藏第6天时的硬度与A组相比差异显著(P<0.05),F与G组鲜切草鱼肉咀嚼性与空白组A相比分别在第10天和第8天表现出显著差异(P<0.05),其他组与A组在整个冷藏过程中咀嚼性差异均不显著,说明F、G组抗氧化剂处理对鲜切草鱼肉硬度、咀嚼性在冷藏后期有较大影响。E、F、G组鲜切草鱼肉弹性在冷藏第10天时才与A组表现出显著差异,说明各处理对冷藏期内草鱼肉弹性影响不大。在冷藏第10天,添加包结物组与空白组相比,硬度、弹性、咀嚼性的变化率分别降低了9.2%~13.6%、9.9%~22.3%、26.2%~38.2%。综上,BEO-K-β-CD-MOF处理组对鲜切草鱼肉硬度、弹性、咀嚼性在冷藏后期具有较好的保护作用,且质量浓度越大,作用效果越好。这是因为BEO-K-β-CD-MOF保持着BEO的抗氧化作用的同时,又提高了BEO稳定性,延长了BEO的作用时间。在贮藏过程中鲜切草鱼肉脂肪氧化破坏了肌纤维膜的完整性,会造成鲜切草鱼肉水分、脂肪和蛋白质的流失,其质构特性被破坏[29],使鲜切草鱼肉的口感大大降低。因此BEO-K-β-CD-MOF可以很好地通过抑制鱼肉脂肪氧化来改善草鱼的硬度、弹性与咀嚼性。
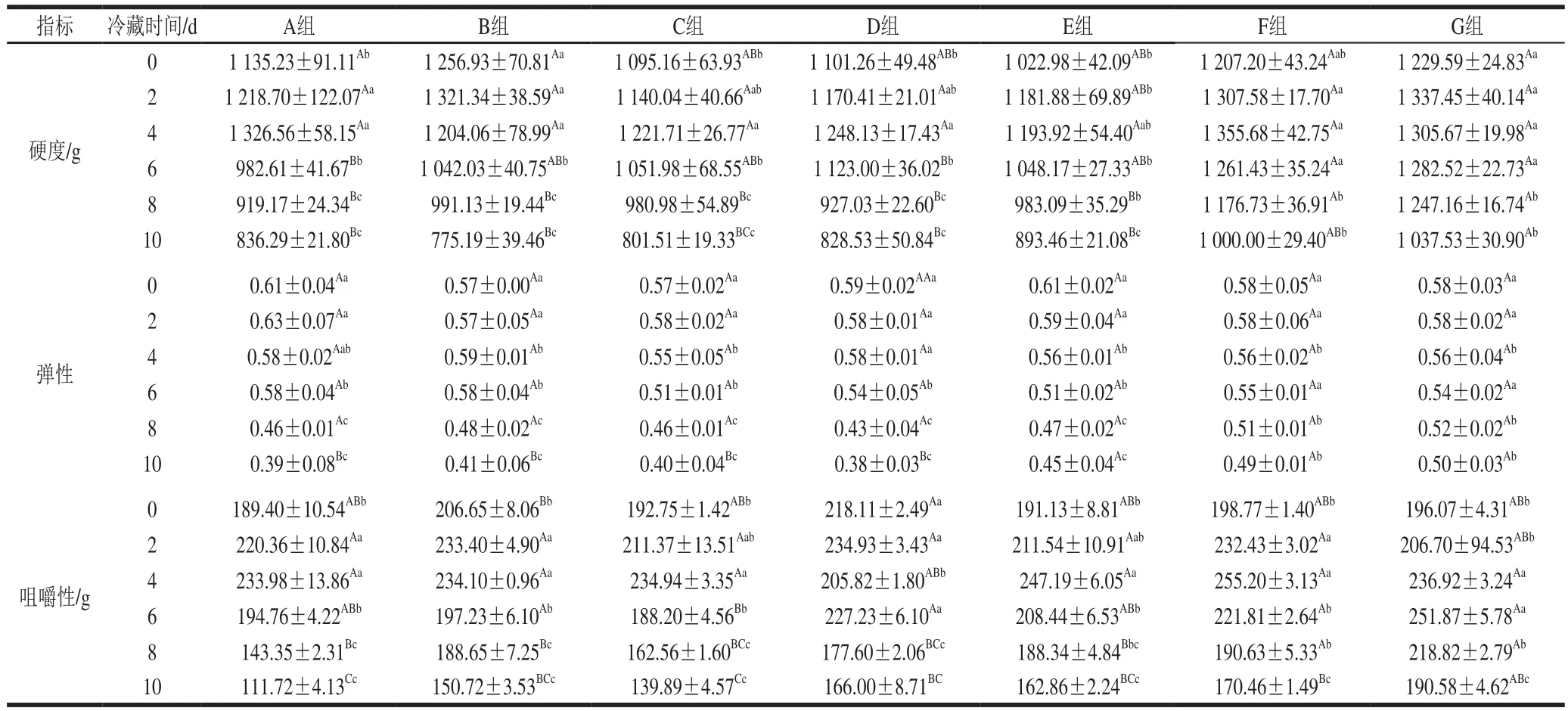
表1 不同条件处理的鲜切草鱼肉在冷藏过程中的质构特性变化Table 1 Changes in texture characteristics of grass carp during refrigerated storage
2.5.4 BEO-K-β-CD-MOF对鲜切草鱼肉色泽的影响
由图9可知,鲜切草鱼肉在第0天时,占比最大的色号主要为2440(灰红色)(75.8%)与2713(浅灰红色)(18.3%),这是由于在肉样的处理过程中鱼肉表面在空气中发生氧合氧化,脱氧肌红蛋白转化为氧合肌红蛋白[30]。在0~4 d内,草鱼色泽变化不明显。在冷藏第6天时,草鱼色号占比开始发生变化,空白组A组与处理组B、C、E组2440色号占比开始减小,而色号2731占比增加,并且A、B、C、E、F组出现新的色泽(2712色号,浅灰黄褐色)。这是鱼死后贮藏过程中血红素蛋白质经自动氧化,还原态的肌红蛋白逐渐转变为氧化态的高铁肌红蛋白,使鱼肉呈褐色[30]。在第8天时,G组出现2712色号;在第10天时,各组2712色号占比逐渐增加,但E、F、G组2712色号占比相比A组低59.6%~80.0%。鱼肉的色泽是评价鱼肉品质的重要指标之一,BEO-K-β-CD-MOF可以通过抑制肌红蛋白转换成肌红蛋白衍生物,从而抑制草鱼色泽改变。

图9 不同条件下鲜切草鱼肉色泽随冷藏时间的变化Fig. 9 Color changes of grass carp during refrigerated storage
根据图9的色泽变化规律,选取冷藏第4天和第10天时的鲜切草鱼肉色泽进行主成分分析,结果如图10所示。主成分贡献率大,说明主要成分可以较好地反映原来多指标的信息,总贡献率超过70%~85%即表明该分析方法可行[31]。在冷藏第4天时,主成分1占81.142%,主成分2占9.643%,两者之和为90.785%,因主成分1包含了原始数据中的大部分信息,所以主成分1为区分轴,各处理组与空白组A相比分布接近,识别指数为79(小于80),表明各处理组在冷藏初期对鲜切草鱼肉色泽区分度不明显[32]。在冷藏第10天时,主成分1占57.257%,主成分2占21.688%,两者之和为78.945%,仍以主成分1为区分轴,识别指数为98(大于80),处理组B、C、D组与空白组A组相距较近,均分布于二、三象限,处理组E、F、G组(分布于一、四象限)与空白组A相距较远,表明在冷藏后期包结物的处理组鲜切草鱼肉色泽均与空白组A组有较大差异,体现出BEO-K-β-CD-MOF对鲜切草鱼肉色泽变化的抑制作用。
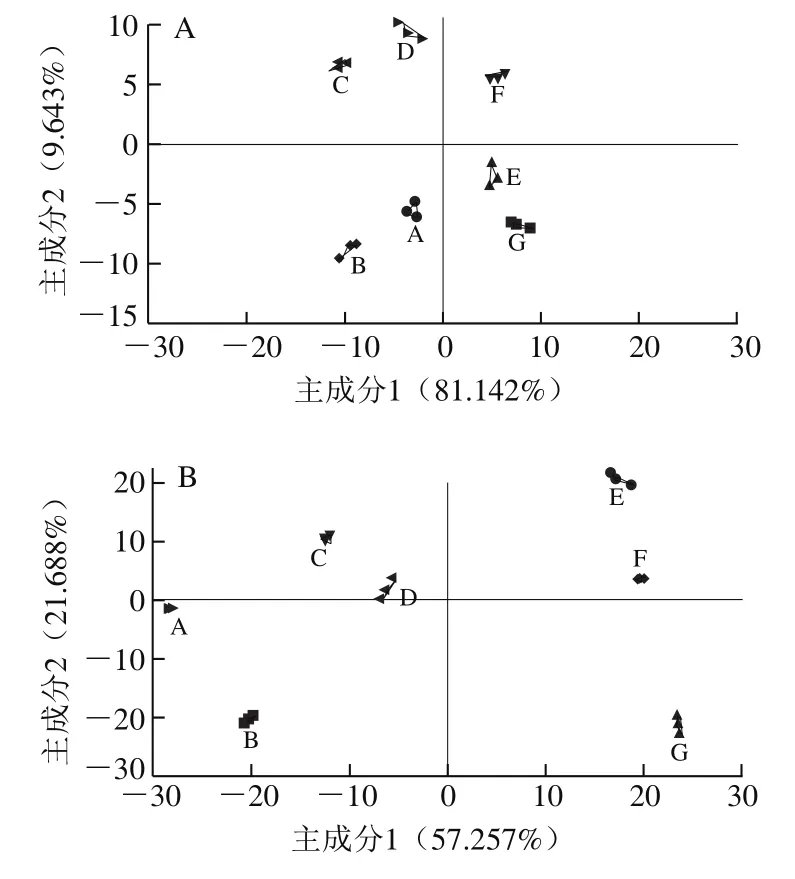
图10 鲜切草鱼肉冷藏第4天(A)和第10天(B)的色泽主成分分析Fig. 10 Principal component analysis of the color of grass carp at day 4 (A) and 10 (B) of storage
3 结 论
在10 d冷藏期内,鲜切草鱼肉的汁液流失率、TBARS值、弹性、硬度、咀嚼性、色泽等指标随着冷藏时间的延长有不同程度增加,但包结物与BEO保鲜组样品增加的幅度明显小于空白组,且包结物保鲜组增加的幅度小于BEO保鲜组,说明BEO保鲜效果良好且BEO-K-β-CD-MOF展现出更好的作用效果。因此,添加BEO-K-β-CD-MOF是一种可行且高效的鲜切草鱼肉保鲜方案,本实验对保持鲜切草鱼肉加工贮运过程中的品质具有一定的参考价值。
- 食品科学的其它文章
- 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展
- 茶多酚对小麦淀粉理化特性和面包品质的影响及机理
- 运动对苏尼特羊脂肪代谢和肉品质的影响
- 升温方式对鲢鱼肌球蛋白结构和理化性质的影响
- Thermal Unfolding and Aggregation Process of Recombinant Staphylococcal Enterotoxin M (rSEM) Associated with Potential Toxin Responsible for Staphylococcal Food Poisoning
- 小米麸皮水溶性膳食纤维-Cr(III)配合物的合成、表征及其体外抗氧化活性

