静电纺丝制备白藜芦醇固体分散体及其性能
邓 姣,刘 鑫,郑 敏,2,周 军,3,李湘洲,3,*
(1.中南林业科技大学材料科学与工程学院,湖南 长沙 410004;2.湖南第一师范学院教育科学学院,湖南 长沙 410215;3.中南林业科技大学天然产物加工利用研究所,湖南 长沙 410004)
白藜芦醇(resveratrol,Res)是一种非黄酮类天然多酚化合物,广泛存在于葡萄、花生、虎杖、菝葜、桑葚等多种植物组织器官中[1-2]。现代药理学研究表明,Res具有保护心血管、调节血脂代谢、抗氧化、抗肿瘤等多种生理活性[2-4]。但与其他许多天然产物类似,Res是脂溶性成分,其存在稳定性差、口服后在人体的生物利用度低等问题,这限制了Res在食品、保健品等领域的应用。
目前,国内外利用制剂学方法将难溶性成分溶解、吸附或包裹于特定材料中而制成口服脂质体、固体分散体、聚合物纳米粒及微乳等食品或药品输送体系,以有效提高其稳定性、改善吸收以及增强靶向性等[5-8]。固体分散体是一种以固体形式存在的药物-载体固体分散系统,能将药物高度分散于固体载体中。制备固体分散体的常用方法主要有溶剂法、熔融法、喷雾干燥法、静电纺丝法等[9-10]。近年来静电纺丝技术作为一种新兴的制备技术,其制备的固体分散体具有比表面积大、结构可控和生物相容性好等优点,已在药物载体、组织工程支架等方面得到较好的应用[11]。基材的选择是影响静电纺丝制备产物结构的重要因素之一,天然高分子材料如多糖、环糊精及其衍生物、蛋白和紫胶等常被用作固体分散体的基材[12-14]。其中,紫胶是紫胶虫分泌的一种天然低分子聚合物,具有良好的成膜性,兼具热塑性和热固性,且天然无毒,是一种极好的固体分散体基材,且近年来紫胶树脂及其衍生物作为壁材在食品和制药工业中受到越来越多的关注[15]。
本实验以氨水改性的紫胶树脂铵盐(shellac resin ammonium salt,SRAS)为单一基材用于包埋Res,通过静电纺丝技术制备白藜芦醇/紫胶树脂铵盐(Res/SRAS)固体分散体,以提高Res的热稳定性和生物活性,促进其在模拟肠液中的释放,为Res功能产品的开发与利用提供依据。
1 材料与方法
1.1 材料与试剂
Res(纯度98%) 湖南健源生物有限公司;紫胶市售;乙酸乙酯、磷酸氢二钠、磷酸二氢钠、盐酸、铁氰化钾、三氯乙酸、三氯化铁以及无水乙醇(均为分析纯) 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 梯希爱(上海)化成工业发展有限公司;MD34透析袋(截留分子质量3 500 Da)美国Sigma Aldrich公司。
1.2 仪器与设备
DF-1集热式磁力搅拌器 常州市江南实验仪器厂;SCIENTZ-18N冷冻干燥仪 宁波新芝生物科技股份有限公司;NANON-01A静电纺丝机 日本MECC公司;Alpha红外光谱仪 德国Bruker公司;sigma 300场发射扫描电子显微镜 德国卡尔蔡司公司;Ultimate IV型X射线衍射仪 日本Rigaku公司;DSC-TA Q200差示扫描量热仪 美国PerkinElmer公司;RC-3溶出度测试仪天津市光学仪器厂;UV23II紫外分光光度计 上海天美科学仪器有限公司;TG16-WS医用离心机 湖南平凡科技有限公司;AUY120分析天平 日本岛津实验器材有限公司;SB-5200DTD超声波清洗机 昆山美美超声仪器有限公司。
1.3 方法
1.3.1 SRAS的制备
利用氨水对紫胶进行改性制备SRAS[16]。精确称取10 g粉碎并过40 目筛的紫胶,加入至200 mL 0.1 mol/L NH3·H2O溶液中,于40 ℃下恒温磁力搅拌反应1 h,所得反应溶液静置,取上层清液装入表面皿,冻干得SRAS,经称质量并计算得到SRAS的得率为97.73%。
1.3.2 静电纺丝制备Res固体分散体
在前期研究[17]的基础上制备Res/SRAS固体分散体,称取0.222 g Res分散于含2.0 g SRAS的10 mL无水乙醇溶液中。45 ℃恒温水浴磁力搅拌1 h,冷却至室温,得到Res/SRAS前驱液,静电纺丝前将前驱液超声处理60 s,排出气泡。静电纺丝参数为电压29 kV、泵送流速0.2 mL/h、钢针尖端到收集器的距离15.5 cm、针头清洗频率50 s/次,固体分散体通过铝箔锡纸收集,得到粉末状Res/SRAS固体分散体。
1.3.3 Res标准曲线的绘制
1.3.3.1 Res-乙酸乙酯溶液标准曲线的绘制
精确称取Res标准品30 mg于50 mL棕色容量瓶,用乙酸乙酯溶解并定容。吸取上述Res-乙酸乙酯溶液1 mL于100 mL棕色容量瓶并用乙酸乙酯定容。分别量取2.0、4.0、6.0、8.0、10.0 mL上述Res-乙酸乙酯溶液于10 mL棕色容量瓶中,用乙酸乙酯定容。以乙酸乙酯溶液作参比,在305 nm波长处分别测定各质量浓度(1.2~6.0 μg/mL)溶液的吸光度,得到标准曲线方程为y=141.5x+0.004 7,R2=0.999 6。
1.3.3.2 Res-磷酸盐缓冲液标准曲线的确定
精确称取Res标准品8.5 mg,用相应的磷酸盐缓冲液(phosphate buffered saline,PBS)定容至500 mL得到Res标准溶液。分别量取0.5、1.0、2.0、4.0、6.0、8.0、10.0 mL Res标准溶液于10 mL容量瓶中,用PBS定容。以PBS作参比,在305 nm波长处分别测定各质量浓度(0.085~17 μg/mL)溶液的吸光度。分别得到pH 1.0条件下的标准曲线方程为y=100.72x+0.025,R2=0.999 3;pH 6.8条件下的标准曲线方程为y=103.01x+0.018 9,R2=0.999 1。
1.3.4 Res/SRAS中Res包埋率、负载率的测定
精确称取一定量的固体分散体,用乙酸乙酯反复淋洗3 遍,过滤,滤液定容,用紫外分光光度计在305 nm波长处测定吸光度,根据1.3.3.1节标准曲线计算表面未包裹的Res的质量,并分别按公式(1)和(2)计算Res的包埋率和负载率。
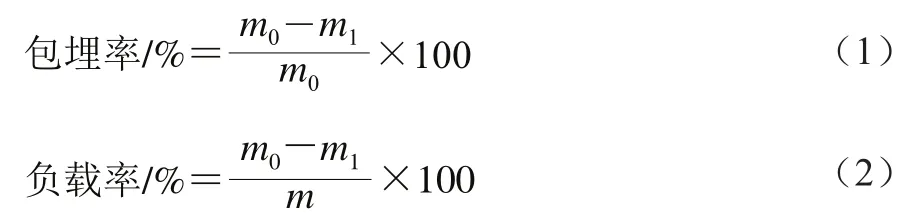
式中:m为固体分散体的质量/mg;m0为Res的加入量/mg;m1为未包裹的Res的质量/mg。
1.3.5 Res/SRAS的微观形貌观察
分别取适量的Res标准品、空白SRAS固体分散体和Res/SRAS固体分散体,黏在有导电胶的样品台上,利用真空镀膜机喷金,再用扫描电子显微镜(电压10 kV)观察固体分散体表观形貌,分析制备前后样品微观形貌的变化。
1.3.6 Res/SRAS的复溶性分析
称取一定量的Res/SRAS固体分散体于样品瓶中,分别加入50 倍和100 倍质量的水,超声60 s,静置后观察样品的复溶效果。
1.3.7 傅里叶变换红外光谱分析
将Res、空白SRAS固体分散体、Res/SRAS及其物理混合物分别与干燥的KBr进行混合,研磨、压片。用傅里叶变换红外光谱仪扫描,扫描频率64 Hz,扫描32 次,扫描范围400~4 000 cm-1。
1.3.8 差示扫描量热分析
分别取10 mg的Res、空白SRAS固体分散体、Res/SRAS及二者物理混合物至铝制小坩埚中,封压后放入差示扫描量热仪。测定温度范围25~350 ℃,升温速率为10 ℃/min。以液氮为降温介质,加热过程中均以高纯N2为吹扫和保护气体。
1.3.9 X射线衍射分析
分别将纯Res、空白SRAS固体分散体、Res/SRAS及其物理混合物(Res与SRAS质量比1∶10)进行X射线衍射分析。分析条件:铜靶、石墨单色器、工作电流40 mA、电压40 kV、波长1.541 8 Å、扫描范围(2θ)5°~90°、扫描速率10(°)/min。
1.3.10 体外释放实验
分别称取5 mg纯Res和50 mg Res/SRAS置于已预处理的MD34透析袋中,加入少量释放介质(pH 1的模拟胃液和pH 6.8的模拟肠液)后封闭,置于溶出仪中,转速为(50±2)r/min,温度为(37.0±0.5)℃,分别以400 mL pH 1的模拟胃液和pH 6.8的模拟肠液为释放介质,释放10 h。在预定的时间间隔(2 h)内取释放介质5 mL,并立即补充等量新鲜释放介质。用紫外分光光度计在305 nm波长处测定所取样液的吸光度,根据1.3.3.2节标准曲线方程和公式(3)分别计算释放量和累积释放率。
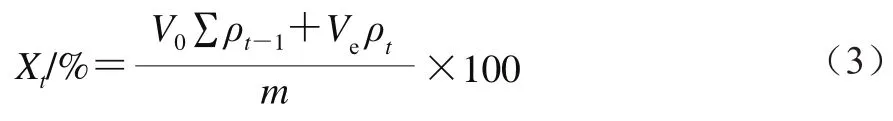
式中:Xt为第t次累积释放率/%;V0为每次取样的体积(5 mL);Ve为释放介质的总体积(400 mL);ρt和ρt-1分别为第t次和第t-1次取出的缓释介质中Res的质量浓度/(mg/mL);m为固体分散体中Res的质量/g。
1.3.11 体外抗氧化活性分析
1.3.11.1 DPPH自由基清除率的测定
配制79 mg/L的DPPH-乙醇溶液,低温下避光保存备用。分别取Res和Res/SRAS溶于乙醇中,使两者的Res质量浓度均为80、160、240、320、400 μg/mL。分别取0.5 mL不同质量浓度的Res和Res/SRAS乙醇溶液,加入5.0 mL的DPPH-乙醇溶液混合均匀,37 ℃下反应1 h,以无水乙醇为空白,在517 nm波长处测定吸光度,按公式(4)计算DPPH自由基清除率。

1.3.11.2 还原力的测定
取样品10 mg溶于水,分别配成质量浓度为20、40、60、80、100 μg/mL的溶液,取不同质量浓度的样品溶液2.5 mL,加入pH 6.6、0.2 mol/L PBS 2.5 mL和1 g/100 mL K3Fe(CN)6溶液2.5 mL,混匀后于50 ℃水浴20 min,迅速冷却,然后加入10 g/100 mL三氯乙酸2.5 mL,3 000 r/min离心10 min,取上清液2.5 mL加入2.5 mL蒸馏水和0.5 mL 0.1 g/100 mL三氯化铁溶液混合,常温下继续反应10 min,以相应蒸馏水为空白,在波长为700 nm波长处测定吸光度,以吸光度表示还原能力。
1.4 数据处理与分析
所有数据均采用Origin 8.0软件进行数据分析与作图,每组实验设置3 次平行,结果以平均值±标准偏差表示。
2 结果与分析
2.1 扫描电子显微镜观察与物理性能分析结果
对纯Res、空白SRAS固体分散体、Res/SRAS的形貌进行扫描电子显微镜观察,并用Nano measure软件对其粒径分布进行统计分析,结果见图1。Res的形貌大多为细长的无规则晶体结构,其平均粒径为(3 034.06±584.71)nm。空白SRAS固体分散体的形状为凹陷的球状,且表面有许多突起,其平均粒径为(1 547.09±129.01)nm。研究表明,SRAS表面存在许多不平滑凸起,这与紫胶本身的性质有关[18]。Res/SRAS为表面较光滑的球状结构,颗粒大小较均一,其平均粒径为(843.75±162.99)nm,达到纳米级。
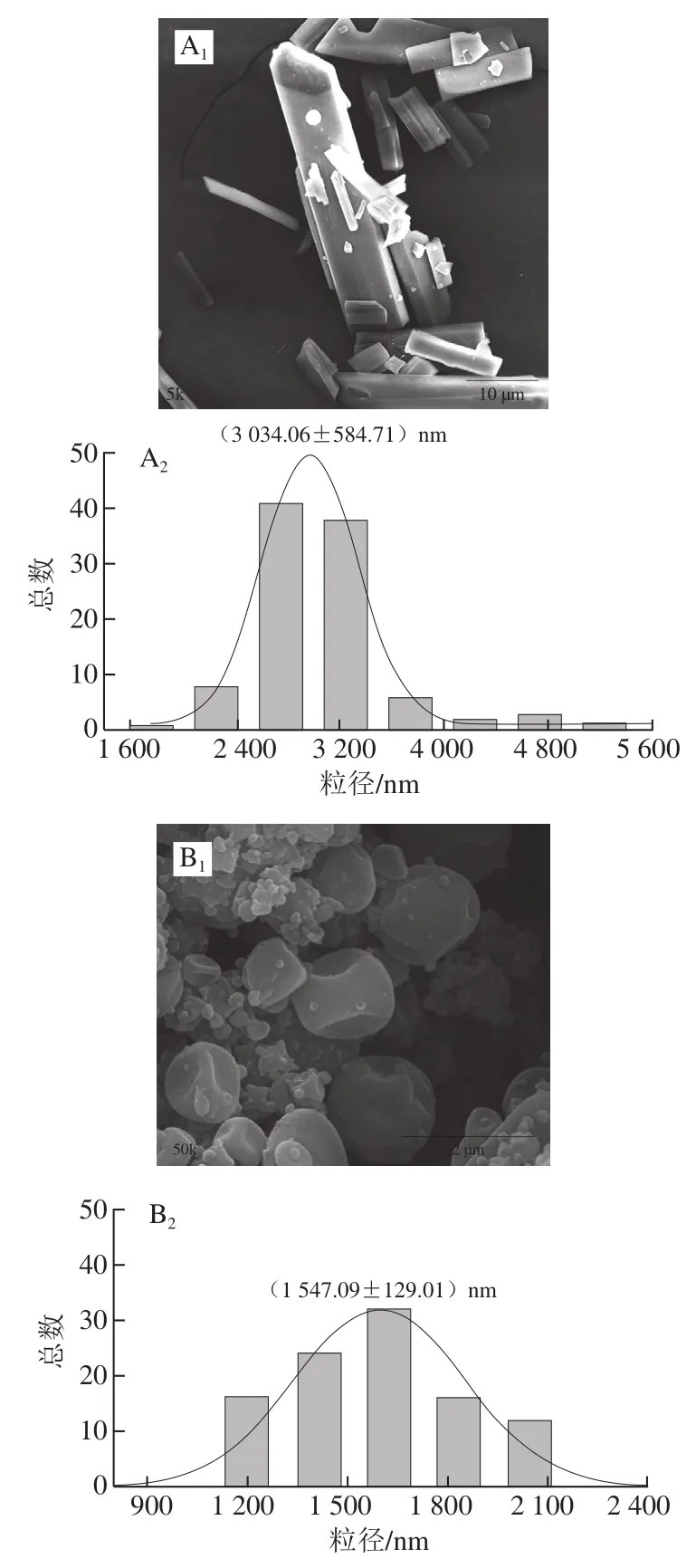
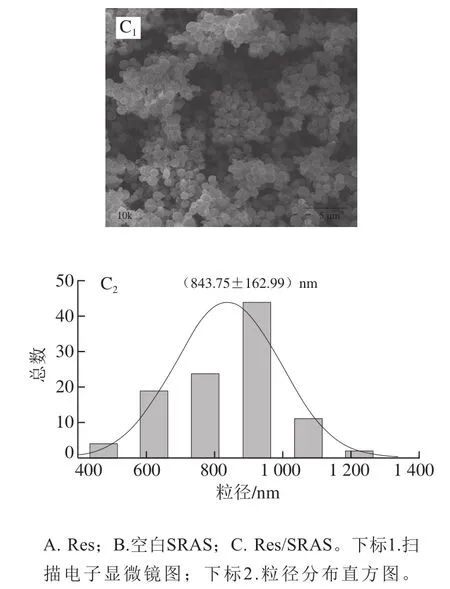
图1 扫描电子显微镜分析结果Fig. 1 Results of SEM analysis
静电纺丝技术制备的Res/SRAS固体分散体中Res包埋率为79.06%,负载率为7.91%,与前期研究中利用喷雾干燥技术制备的Res/SRAS微胶囊[17]的包埋效果类似,但Res/SRAS固体分散体形貌更易于控制,且粒径明显减小。SRAS本身具有较好的成膜性[19],能有效包裹Res,形成具有稳定结构的Res固体分散体。
2.2 复溶性分析结果
固体分散体复溶后的稳定性是衡量载药性能的重要指标之一[20]。根据1.3.6节所述方法对Res/SRAS进行50 倍和100 倍质量水的复溶,结果见图2。利用静电纺丝技术制备的Res/SRAS固体分散体为均匀的棕色粉末。Res/SRAS在水中以不同质量比复溶后均能形成稳定的混悬液,未出现沉淀或分层现象,表明SRAS对Res具有较好的包埋效果。

图2 Res/SRAS及在水中的复溶效果Fig. 2 Res/SRAS and its dilutions in water
2.3 傅里叶变换红外光谱分析结果
傅里叶变换红外光谱技术可以对化合物的结构进行定性分析。由图3可知,Res在1 585、1 515、1 453 cm-1处为苯环骨架振动吸收峰,在962 cm-1处为反式—C=C—振动吸收峰,在675、614、515 cm-1处为=C—H反式双振动吸收峰[21]。空白SRAS固体分散体中,在1 559 cm-1附近出现了中等强度的吸收峰,是R—COOH—离子键与溶液中游离的NH4+形成SRAS所引起,1 383 cm-1为酰胺基振动吸收峰,表明氨水对紫胶树脂改性成功[16]。与空白SRAS相比,Res/SRAS不仅具有空白SRAS固体分散体的特征吸收峰,还出现了Res的苯环特征吸收峰以及指纹图谱区962、614、515 cm-1处特征吸收峰,且未出现新的特征吸收峰,表明静电纺丝制备Res/SRAS过程是物理包埋。而物理混合物的红外吸收峰是由SRAS与Res各自吸收峰的叠加形成的。综上可知,静电纺丝处理使SRAS对Res进行了有效的物理包埋,形成了稳定的Res/SRAS固体分散体。
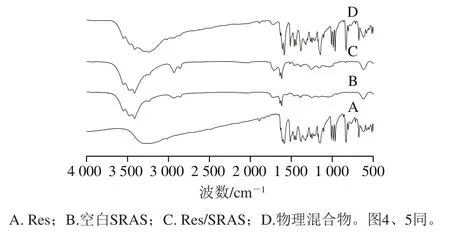
图3 傅里叶变换红外光谱分析结果Fig. 3 Results of FT-IR analysis
2.4 差示扫描量热分析结果
利用差示扫描量热法可以测定药物在载体中的分散状态以及载体的热稳定性。由图4可知,纯Res在269.8 ℃附近呈现出尖锐的吸热峰,这与Res本身的热分解温度相对应[22]。空白SRAS固体分散体在50~200 ℃范围内表现出较宽的弱吸热峰,呈现一个平缓的状态,没有明显的强吸热峰存在,这与陈奇[16]、李凯[23]等的研究结果相似,而Res/SRAS则没有出现明显的吸热峰,表明基材SRAS包裹Res后,Res在固体分散体中以非晶体形式存在,同时形成的Res/SRAS固体分散体的热力学稳定性明显提高。

图4 差示扫描量热分析结果Fig. 4 Results of DSC analysis
2.5 X射线衍射分析结果
X射线衍射可用于对化合物的物相和结晶度进行定性分析。由图5可知,纯Res在6.5°、13.1°、16.2°、19.1°、22.2°、23.6、25.3°和28.4°处呈现出强烈的衍射特征峰,表明Res以结晶态的形式存在。空白SRAS固体分散体在21.1°处有较较强的衍射峰,此为SRAS的特征衍射峰;在18°处有较平缓的衍射峰,表现出明显的非晶体弥散衍射特征,表明空白SRAS固体分散体为非晶体、无定形结构[24]。Res/SRAS在18°处的平缓衍射峰也表现出较为明显的非晶体弥散衍射特征,而Res结晶型的衍射峰消失,表明形成的Res/SRAS固体分散体中Res以无定形的结构存在。与Res/SRAS相比,物理混合物中Res和SRAS的特征衍射峰均有出现。综上,X射线衍射结果表明Res有效包埋于SRAS中。

图5 X射线衍射分析结果Fig. 5 Results of XRD analysis
2.6 体外释放分析结果
功能食品或药物输送体系被人体摄入后主要经过口腔、胃,再到小肠,经吸收后进入人体的血液循环中,整个过程大约需要3~16 h[18]。理想的功能食品或药物输送体系应能够在胃部强酸性环境下保持相对稳定,而进入肠道环境后能在较短时间内充分释放出功能因子,以达到提高功能因子在肠道内吸收的目的[25]。
由图6可知,在模拟胃液环境下,纯Res与Res/SRAS的释放规律基本一致,但Res/SRAS的释放量少于纯Res,10 h内Res、Res/SRAS累积释放率分别为54.95%和51.10%,表明Res/SRAS在模拟胃液环境下具有一定的缓释作用。
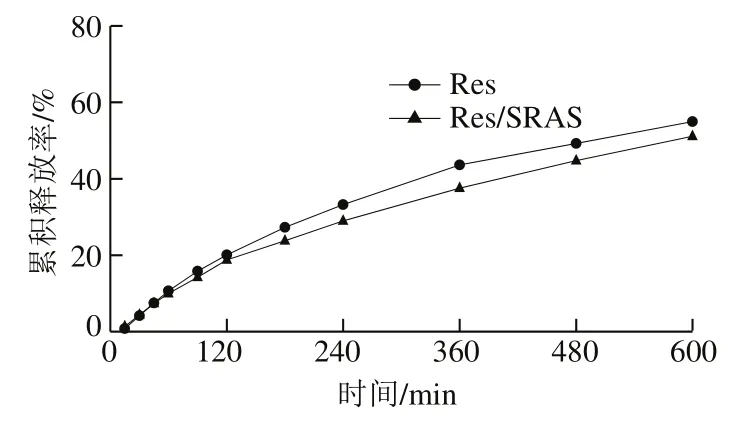
图6 Res和Res/SRAS在模拟胃液条件下的累积释放效果Fig. 6 Cumulative release of Res and Res/SRAS under simulated gastric fluid conditions
由图7可知,在模拟肠液环境下,Res/SRAS的释放量明显高于纯Res,10 h内Res、Res/SRAS的累积释放率分别为53.24%、65.79%。表明纯Res在模拟胃液和模拟肠液中不敏感,而Res/SRAS具有一定的肠溶特性,这可能是常用于肠溶药物包衣材料的紫胶及其铵盐本身具有一定的肠溶特性所致[15];另一方面,静电纺丝技术制备的Res/SRAS的粒径较小,表面积的增大进一步促进了Res的释放[26]。
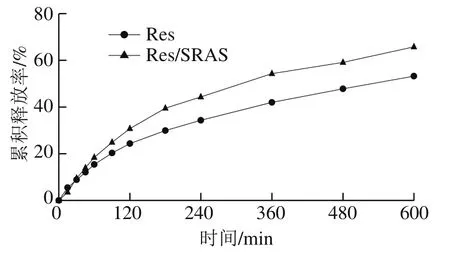
图7 Res和Res/SRAS在模拟肠液条件下的累积释放效果Fig. 7 Cumulative release of Res and Res/SRAS under simulated intestinal fluid conditions
2.7 体外抗氧化活性分析结果
由图8可知,纯Res和Res/SRAS对DPPH自由基的清除率均随质量浓度的增加而增大,呈浓度-效应关系。经计算可得纯Res清除DPPH自由基的半抑制浓度(half maximal inhibitory concentration,IC50)为165.71 μg/mL,而Res/SRAS清除DPPH自由基的IC50为180.88 μg/mL,表明纯Res与Res/SRAS的体外抗氧化能力基本一致。
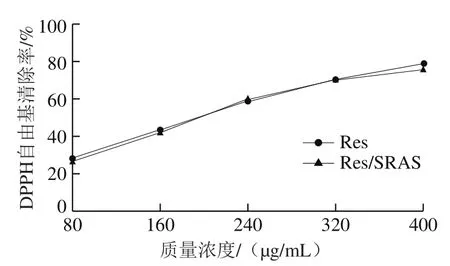
图8 Res和Res/SRAS对DPPH自由基清除效果Fig. 8 DPPH radical scavenging effect of Res and Res/SRAS
由图9可知,纯Res和Res/SRAS的吸光度随质量浓度的增加而增大,呈浓度-效应关系。相同Res质量浓度下,Res/SRAS对Fe3+的还原能力高于纯Res。

图9 Res和Res/SRAS的还原能力Fig. 9 Reducing power of Res and Res/SRAS
相对于游离态的Res,经静电纺丝制备的Res/SRAS对DPPH自由基清除能力没有明显减弱,而对Fe3+还原能力增强,表明抗氧化能力更强,这可能是反应介质中的Res在固体分散体具有较大的表面积所致[27]。表明利用静电纺丝法制备的Res/SRAS固体分散体具有良好的体外抗氧化活性。与之前研究的利用喷雾干燥法制备的Res/SRAS微胶囊相比,以SRAS为单一基材,利用静电纺丝制备的Res/SRAS固体分散体包埋效果相当,而粒径更小、性质更稳定、体外累积释放率更高,且抗氧化效果更好。
3 结 论
本实验以SRAS为壁材,用静电纺丝制备了Res/SRAS固体分散体,Res的包埋率、负载率分别为79.06%、7.91%。Res/SRAS固体分散体的粒径为(843.75±162.99)nm,微观形貌呈现为表面较光滑的球体结构。傅里叶变换红外光谱、差示扫描量热和X射线衍射分析结果表明Res成功地包裹于SRAS中,并以非晶形式存在,热力学性质更稳定。体外抗氧化研究表明Res/SRAS固体分散体的抗氧化能力高于未包埋前的Res。Res/SRAS固体分散体在模拟胃液环境下保持缓释,而在模拟肠液中可持续快速度释放,两种环境下10 h内Res的累积释放率分别为51.10%、65.79%,表现出一定的肠溶特性。
利用静电纺丝技术制备的Res/SRAS固体分散体由于其表面微观形貌可控、粒径分布均匀,在实现对Res等功能因子负载、缓释、增溶等目标的同时,还有望实现因其表观形貌变化带来的抗氧化等生物活性增强的效果。
- 食品科学的其它文章
- 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展
- 茶多酚对小麦淀粉理化特性和面包品质的影响及机理
- 运动对苏尼特羊脂肪代谢和肉品质的影响
- 升温方式对鲢鱼肌球蛋白结构和理化性质的影响
- Thermal Unfolding and Aggregation Process of Recombinant Staphylococcal Enterotoxin M (rSEM) Associated with Potential Toxin Responsible for Staphylococcal Food Poisoning
- 小米麸皮水溶性膳食纤维-Cr(III)配合物的合成、表征及其体外抗氧化活性

