Castor一体式分支支架在胸主动脉瘤治疗中的应用效果
徐一丁 朱峥嵘 谭羽灿 罗灿华
佛山市第一人民医院血管外科,广东 佛山 528000
胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)已在胸主动脉瘤的治疗中得到广泛应用[1]。具备足够的近端健康锚定区是保证TEVAR成功的关键。然而,对于近端锚定区不足的胸主动脉瘤患者,该类病变可通过覆盖左锁骨下动脉(left subclavian artery,LSA)延长锚定区。但研究发现,封堵LSA后左上肢缺血、脑卒中及截瘫的风险均明显增加[2-4]。Castor支架是一体式主动脉弓分支重建支架,可以在TEVAR中一期完成LSA重建,延长近端锚定区至左颈总动脉后缘。本中心采用Castor一体式分支支架治疗胸主动脉瘤患者13例,其短期疗效较为满意,现报道如下。
1 资料和方法
1.1 一般资料
选取2018年10月至2020年7月佛山市第一人民医院应用Castor一体式分支支架治疗需重建LSA的胸主动脉瘤患者临床资料。所有患者术前均通过计算机断层扫描血管造影(computed tomographic angiography,CTA )确诊,共纳入13例,均为男性;年龄47~84岁,平均(67.6±10.6)岁;有高血压病史12例,糖尿病史1例,冠心病史2例,肿瘤病史1例,腹主动脉瘤病史4例。病变距离LSA均小于15 mm,其中有3例因病变起始部位距离左颈总动脉下缘小于15 mm,遂决定行颈-颈搭桥联合Castor支架植入手术,其余10例患者行单纯Castor支架植入手术。
1.2 术前准备
术前完善主动脉CTA了解胸主动脉瘤的位置、大小、形态、累及范围等。TEVAR前根据主动脉CTA检查结果确定治疗方案。主要测量数据包括近端瘤颈距LSA的距离、瘤颈近远端直径、LSA开口前缘距左颈总动脉的距离、近远端锚定区正常主动脉直径、LSA开口直径、主动脉弓及LSA切线位角度等。根据测量结果确定所选用支架的近远端直径、覆膜长度、分支支架的直径和长度。
1.3 手术过程
1.3.1 颈-颈搭桥手术过程
所有患者均行全身麻醉,采用头颈后仰卧位,采取颈前区低切口,切开皮肤,于双侧胸锁乳突肌内侧下方游离出双颈总动脉;给予肝素化(1 mg/kg),阻断并纵行切开右颈总动脉,CV5缝线连续缝合完成与8 mm人工血管的端侧吻合,人工血管经隧道后,再次阻断并纵行切开左颈总动脉,CV5缝线连续缝合完成与人工血管的端侧吻合。行颈-颈搭桥联合Castor支架植入术的患者在行颈-颈搭桥术后1个月后返院再次行Castor支架植入手术,手术过程同下。
1.3.2 Castor支架植入手术过程
所有患者均行全身麻醉。手术采取股动脉入路,将导管送至升主动脉,交换Lunderquist超硬导丝作为主体支架支撑导丝。穿刺左侧肱动脉建立另一动脉通路,引入导丝股动脉,经股动脉鞘将该导丝引出至体外,以该导丝作为分支支架的导引导丝。沿分支导丝由上肢动脉鞘引入长导管,导管前端于股动脉穿出体外。去除导丝,将支架移植物前端的分支导丝穿入该导管,并在上肢动脉鞘中引出,与导管固定。将Lunderquist超硬导丝引入支架输送系统,调整主体支架与分支支架导引导丝的位置,使其不互相缠绕。若发生缠绕,旋转输送手柄,解开缠绕,确定分支方向正确、标志形态正确后,将支架在外鞘中推出,并继续上送至主动脉弓;后撤支架软鞘释放出分支支架,轻轻牵引分支导丝,将分支支架拉入LSA,经造影证实位置无误后固定支架,拉出主体支架释放导丝完成主体释放,牵拉分支支架导丝,将分支支架释放。再次造影证实支架的开放情况及是否存在内漏等,并根据情况选择处理方法。
1.4 观察指标
观察指标主要包括手术技术成功率,以及围手术期和随访期间并发症的发生率、分支支架的通畅率。术后1、3、6、12个月门诊随访,于术后第12个月的门诊随访时复查主动脉CTA。
1.5 统计学方法
2 结果
13例重建LSA的胸主动脉瘤的患者均成功完成Castor单分支支架植入手术,手术技术成功率100%,手术平均时间为(174±56)min。术中,1例患者的LSA分支支架释放后存在狭窄,给予球囊(8 mm×40 mm)扩张后狭窄解除;术中有1例患者因LSA分支支架过长而部分遮挡左椎动脉,遂植入支架(5 mm×19 mm)以开通椎动脉;有1例行颈-颈搭桥联合Castor一体式支架植入的患者术中因瘤体较大出现主体支架前端小弯侧局部缩入瘤体内,造影提示少许Ⅰa型内漏,遂决定行无名动脉开窗术,术后无名动脉血流通畅,内漏消失;术后均无左上肢缺血、内漏、脑梗死、死亡病例。随访至12个月时,LSA分支支架的通畅率为100%,无截瘫、新发内漏、死亡病例。典型病例见图1。
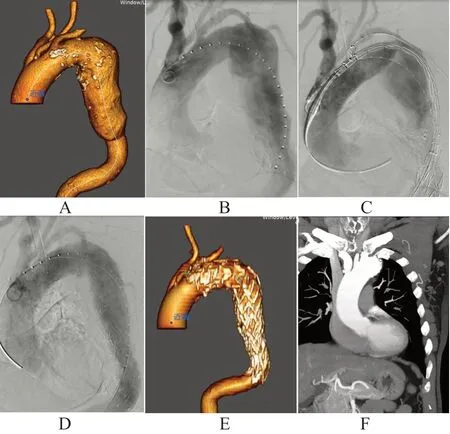
图1 Castor一体式分支支架植入手术过程
3 讨论
TEVAR已广泛用于胸主动脉瘤的治疗。对于近端锚定区不足的胸主动脉瘤患者,可通过覆盖LSA来延长锚定区。研究认为,40%的患者需覆盖LSA以获得足够的锚定区[5],但LSA覆盖减少了左上肢、脊髓和大脑后循环的血供,部分患者可能无法耐受此种变化,从而导致左上肢缺血率达6%,脊髓缺血发生率达4%,脑梗死发生率达5%,特别是针对右侧椎动脉重度狭窄甚至闭塞的患者或左侧椎动脉为优势动脉者。因此,重建LSA显得尤为重要[6]。
目前,临床上重建LSA的方法主要包括烟囱技术、开窗技术、左颈动脉-锁骨下动脉旁路术、分支支架技术。自烟囱技术应用于主动脉血管腔内修复以来,该技术与TEVAR的联合应用已得到广泛应用[7-8]。烟囱支架技术具有短期病死率低、操作简单等优点[9];但烟囱支架与主体支架是平行并列关系,支架间不可避免地存在缝隙,术后发生Ⅰa型内漏的风险高达18.4%,且出现内漏后很难再次干预,长远看来,烟囱支架容易出现狭窄、闭塞,长期通畅率较低[10-12]。开窗技术包括原位开窗技术和预开窗技术。首先,这两种开窗术式是在破坏支架结构的基础上进行重建LSA,能否通过医院医学伦理委员会的审批、家属是否知情,这些在一定程度上都增加了潜在的医疗风险;其次,开窗技术的操作过程复杂,激光能量大小和穿刺针方向均很难控制,术中需多体位、多角度地进行反复造影确认,手术操作时间较长,对术者的操作技术要求较高;再者,开窗技术如术中窗口定位不准确或支架覆膜破坏过多,容易出现Ⅲ型内漏[13];最后,原位开窗存在损伤主动脉血管和破裂的风险,一旦发生,后果严重。左颈总动脉-LSA转流术虽然拓展了TEVAR技术的近端锚定区,但外科手术创伤大,操作复杂,术中阻断颈动脉,增加脑卒中的风险[14]。因此,由于上述存在的一些问题,烟囱技术、开窗技术和左颈动脉-锁骨下动脉旁路术均不是重建LSA的最佳术式;而分支支架技术更受认可,主要原因是其更符合人体的正常解剖结构及血流状态。
Castor一体式分支支架是用于完全腔内治疗主动脉夹层和胸主动脉瘤累及LSA,或主动脉夹层破口主动脉瘤体与LSA距离<1.5 cm的分支型覆膜支架系统。既可以将近端锚定区拓展到LSA近端健康的血管区域,又能够降低主动脉夹层逆撕和内漏的发生率;另外,可以实现对主动脉和LSA的双重锚定,降低支架远期移位的风险。主动脉分支支架后移长度为5~30 mm,能够个体化选择分支支架型号,从而保证左椎动脉血供。国内外多项研究报道了Castor应用于胸主动脉夹层治疗的安全性和有效性[15-18]。Huang等[15]的研究对21例主动脉夹层患者行Castor支架植入术,术后有1例患者存在少许的I型内漏,无死亡病例,无严重并发症,随访1年时有1例患者的分支支架狭窄,无支架闭塞、截瘫、脑卒中等严重并发症发生,证明将Castor支架应用于主动脉夹层的治疗中是安全有效的。本中心自2018年开始应用Castor一体式分支支架治疗胸主动脉瘤, 有1例椎动脉被部分遮挡和1例主体近端出现Ⅰa型漏,考虑与术前未充分评估有一定相关性,因此术前充分评估和选择合适规格的支架是保证手术成功的关键。
本研究将Castor一体式分支支架应用于胸主动脉瘤治疗的体会主要包括以下几点:(1)手术技术关键点为术中分支支架的准确定位及解开分支导丝与主体的缠绕。术中支架定位需于降主动脉完成,然后再向弓部推送支架;解开分支导丝与主体的缠绕方法一般采取术中在主动脉弓部放大图像,仔细观察头端的8字形显影点,使其位于小弯侧,并呈1字形,分支的4个O形显影点位于导丝的大弯侧,这样就能准确定位,便于观察,有利于解除导丝的缠绕;(2)术前需充分评估左椎动脉与LSA开口的距离,病变位置与LSA、左颈总动脉后缘、无名动脉后缘的距离,并根据测量资料选择合适规格的分支支架型号;(3)术前需备齐常见耗材,如近端Cuff支架、远端限制型支架、与LSA和左椎动脉口径相当的球囊和支架等,以备不时之需;(4)术中主体支架释放时应在控制血压的前提下采取快速且均速的方式进行释放;特别是对于瘤体较大的患者,应当控制收缩压在90~100 mmHg(1 mmHg=0.133 kPa),避免血压过高时释放支架导致支架塌陷,从而导致近端内漏;(5)术后应严密随访,对于出现的问题做到早发现、早处理。
综上所述,Castor一体式分支支架作为第一款主动脉弓上分支支架移植物,在治疗胸主动脉瘤中能够安全、有效地重建LSA,相对于转流手术、烟囱技术、开窗技术具有明显的优势,近期疗效满意,远期疗效尚有待观察。当然,Castor一体式分支支架仍具有一定的局限性,如对于侵及左颈总动脉及无名动脉的主动脉疾病,需要联合其他技术治疗,如杂交、烟囱或开窗技术。

