miRNA-519抑制HuR、VEGF和MMP9表达对缺血下肢血管新生的影响
张 波 刘亚民 吴佳庆 苏 帅
西安交通大学第一附属医院周围血管科,陕西 西安 710000
外周动脉疾病是一种心脏外围区域的血管疾病,又称周围血管疾病,主要表现为狭窄性疾病,影响周围组织和器官的血液供应[1]。外周动脉疾病会引起行走时疼痛或者不适,常累及下肢且可发生在下肢的各个部位,发病率与年龄呈正比,是老年人常见的动脉疾病,吸烟和糖尿病能够增加该病的危险性。开放手术、血管内介入或二者联合同时行血运重建是治疗严重外周动脉疾病常用方法[2],尽管手术治疗和血管内介入技术取得了突飞猛进的发展,但目前仍有30%的患者存在严重的血管受累不适合手术治疗,且动脉粥样硬化斑块聚集在腓动脉或胫后动脉中,增加了血运重建的难度[3],这类患者只能选择药物治疗,但药物治疗仅针对扩张血管、抗血栓治疗,效果有限,所以寻找新的策略对缺血下肢的治疗至关重要。新血管形成的过程比较复杂,在血管生成期间,血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)在血管形成过程中起重要作用[4]。微小核糖核酸(microRNA,miRNA)具有高度的保守性,参与调控多种重要的生理和生化反应途径[5]。miRNA-519是非编码的小分子RNA,位于人类染色体19q13.41,具有重要的生理功能,参与肿瘤的发生和发展[6],但miRNA-519在血管新生中尚未出现过相关报道。人类抗原R(human antigen R,HuR)是一种RNA结合蛋白,可提高mRNA稳定性,促进靶基因表达[7]。研究表明,HuR被发现与微血管密度增加相关,并参与和调节血管生成的相关因子,包括细胞因子、基质金属蛋白酶和生长因子[8]。因此本研究探讨miRNA-519抑制HuR、VEGF和MMP9表达对缺血下肢血管新生的影响,为临床上在外周动脉疾病治疗方面提供新方向,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
72只清洁级SD雄性大鼠[SCXK(沪) 2020-0011],体重220~300 g,平均(213.74±35.68)g,月龄为6个月,购自上海西普尔-必凯实验动物有限公司。
1.1.2 主要实验药品和仪器
胎牛血清 、山羊血清、磷 酸 盐 缓 冲 液(phosphate buffer saline,PBS)、青霉素、链霉素、多聚甲醛购自上海沪宇生物科技有限公司;水合氯醛、总核糖核酸提取试剂(TRIzol)试剂购自武汉博士德生物工程有限公司;牛血清白蛋白(bovine serum albumin,BSA)、VEGF、MMP9、HuR抗体购自美国Pierce公司;免疫蛋白印迹(western blot,WB)试剂盒、脂质体LipofectamineTM3000转染试剂购自上海锐谷生物科技有限公司;miRNA-519模拟物(miRNA-519 mimics)和miRNA-519抑 制 物(miRNA-519 inhibitor)由上海吉玛技术有限公司设计完成;辣根过氧化物酶(horseradish peroxidase,HRP)山羊抗兔鼠二抗、血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,CD31)抗体、苏木素染液、伊红染色液购自重庆川东化学试剂厂;BCA蛋白浓度测定试剂盒购自美国Abcam 公司;离心机购自于美国Bio-Rad公司;酶标仪购自于美国贝克曼库尔特公司;台式离心机购自于德国Eppendorf公司。
1.2 方法
1.2.1 动物分组和建模
72只SD雄性大鼠,饲养7 d后,根据随机数字表法分为三组,每组24只,分别为对照组、miRNA-519过表达组和miRNA-519抑制剂组,三组SD大鼠腹腔注射3.5%的水合氯醛麻醉,参考Takako等[9]方法建立大鼠下肢缺血模型,选左侧腹股沟中点到膝部作长度为2 cm的横向切口,贴着腹股沟下方分离股动脉主干,进行股动脉结扎术,建立大鼠下肢缺血模型,术后连续3 d注射青霉素,预防感染。建模后,大鼠下肢皮肤色苍白,跛行行走,彩色多普勒超声显示缺血侧下肢肌肉内的动脉血流信号较正常侧显著下降即可认为建模成功。取3 μl的LipofectamineTM3000转染试剂分别与3 ml 的miRNA-519 mimics 和 miRNA-519 inhibitors混匀静止60 min后,经腹腔注射6 μl携带miRNA-519 mimics混合液为miRNA-519过表达组;经腹腔注射6 μl携带miRNA-519 inhibitors混合液为miRNA-519抑制剂组,对照组给予经腹腔注射等量的PBS,每周注射2次,连续注射3周。
1.2.2 激光多普勒检测
建模前,下肢缺血模型建模的实验当天和21 d对小鼠腿部采用多普勒激光检测仪器测量下肢血流量,将大鼠固定在背景是黑色的海绵板子上面,进行麻醉,将检测仪定位于双后肢扫描,图像呈现红色表示血流高灌注,呈深蓝色表示血流低灌注或无灌注,测量取3次平均值,激光多普勒血流系数=缺血下肢血流量/非缺血下肢血流量×100%。
1.2.3 缺血组织病理学检测
建模后第21天,采用苏木精-伊红染色法(hematoxylineosin staining,HE)注射5 %水合氯醛10 ml/kg,处理大鼠取术侧腓肠肌,采用4%多聚甲醛固定,常规脱水、浸蜡包埋、石蜡切片,将切片放于二甲苯Ⅰ液10 min,后放入二甲苯Ⅱ液中10 min,后放于无水乙醇Ⅰ液5 min,后放入无水乙醇Ⅱ液5 min,后放入95%乙醇5 min,蒸馏水清洗,苏木素染色5 min,染细胞核,伊红染液染色3 min,染色后分别放入90%、70%的乙醇和无水乙醇中各3 min,脱水、透明、晾干、封片,镜下观察,图像采集分析。
1.2.4 毛细血管数量计数
第21天,取每组HE染色的腓肠肌组织切片,高倍镜下观察,随机取5个高倍(×400)视野采集图像,使用图像分析系统对毛细血管数量进行计数。
1.2.5 毛细血管密度
第21天,取SD大鼠左下肢的腓肠肌组织标本进行CD31免疫荧光染色,腓肠肌组织行液氮冷冻,连续切成6 μm的冰冻切片,置于玻片后常温干燥30 min,采用4% 多聚甲醛固定10 min,10%的山羊血清封闭1 h,以鼠抗CD31一抗(1∶100)4℃孵育过夜,PBS清洗5 min,再加入HRP山羊抗兔鼠二抗(1∶100)孵育2 h后,PBS清洗晾干,染核后暗室放置1 h,荧光显微镜拍照。采用Photoshop CS3软件进行图像分析,毛细血管密度通过计算CD31阳性细胞的密度获得,随机选择3个腓肠肌组织进行测量,测得的毛细血管密度求平均值,为此次组织样本的毛细血管密度值。
1.2.6 组织中HuR、VEGF和MMP9蛋白的表达
第21天,WB检 测HuR、VEGF和MMP9的 蛋 白 表达,三组左侧腓肠肌组织切取0.025 g,PBS液清洗,取100 μl RIPA裂解缓冲液进行蛋白裂解,采用BCA试剂盒检测蛋白浓度,加样进行电泳、转膜、室温条件下封 闭90 min,孵 育一抗,HuR(1∶1000)稀释、VEGF(1∶1000)稀释和MMP9(1∶1000)稀释,均采用HRP二抗孵育,以1∶6000稀释,β-actin作内参,使用ECL曝光显影,AlphaEase FC软件分析各组织中HuR、VEGF和MMP9蛋白的灰度值。
1.3 统计学方法
应用SPSS 19.0软件对数据进行统计学分析,计数资料以n表示;计量资料以(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 激光多普勒血流系数比较
实验前和第0天,三组SD大鼠下肢血流激光多普勒血流系数比较,差异无统计学意义(P>0.05);第21天,三组SD大鼠下肢血流激光多普勒血流系数比较,差异有统计学意义(P<0.01);进一步两两比较,miRNA-519过表达组的SD大鼠下肢血流激光多普勒血流系数最低,miRNA-519抑制剂组的大鼠下肢血流激光多普勒血流系数最高,差异有统计学意义(P<0.05)。(表1,图1)
表1 三组SD大鼠下肢血流激光多普勒血流系数比较(%,±s)
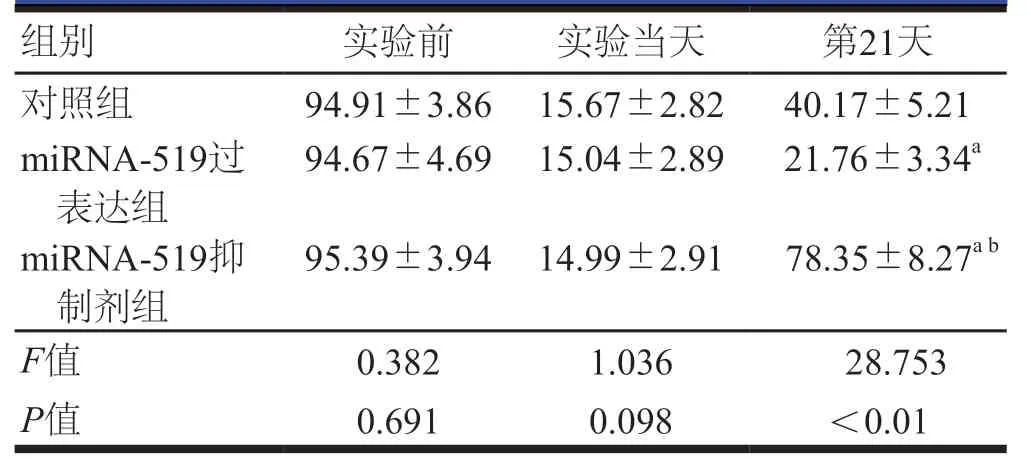
表1 三组SD大鼠下肢血流激光多普勒血流系数比较(%,±s)
注:与对照组比较,aP<0.05;与miRNA-519过表达组比较,bP<0.05
?
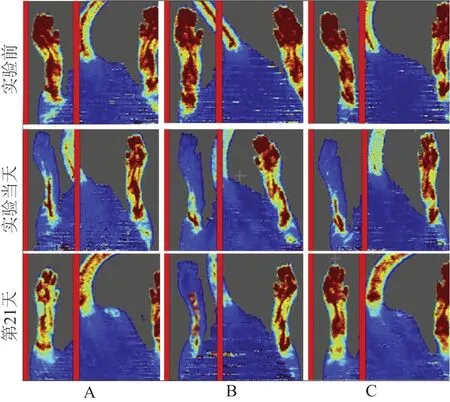
图1 实验前后三组SD大鼠下肢血流情况
2.2 HuR、VEGF和MMP9蛋白表达比较
三组SD大鼠左侧腓肠肌组织中的HuR、VEGF和MMP9蛋白表达比较,差异有统计学意义(P<0.05);miRNA-519抑制剂组中HuR、VEGF和MMP9蛋白表达最 高,miRNA-519过 表 达 组HuR、VEGF和MMP9蛋白表达最低,差异有统计学意义(P<0.01)。(表2,图2)
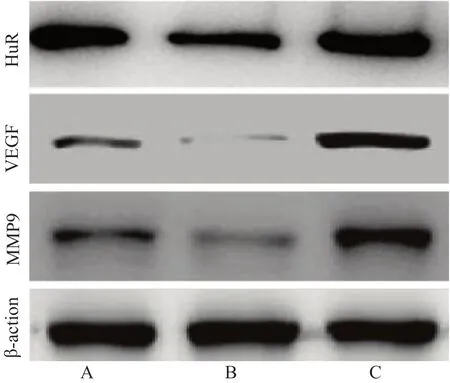
图2 三组SD大鼠左侧腓肠肌组织中HuR、VEGF和MMP9蛋白表达
2.3 腓肠肌组织病理表现及毛细血管数量比较
对照组肌细胞排列紊乱,间质增生;miRNA-519过表达组肌细胞萎缩严重;miRNA-519抑制剂组肌细胞萎缩明显减轻,排列规整;三组SD大鼠左侧腓肠肌组织的毛细血管数量比较,差异有统计学意义(P<0.05);miRNA-519抑制剂组中的毛细血管数量最多,miRNA-519过表达组中的毛细血管数量最少,差异有统计学意义(P<0.01)。(表3,图3)
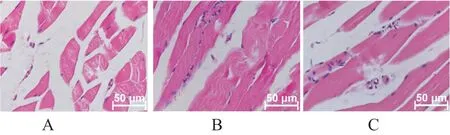
图3 三组SD大鼠腓肠肌组织HE染色(×400)
2.4 毛细血管密度比较
三组SD大鼠左侧腓肠肌组织的毛细血管密度比较,差异有统计学意义(P<0.05);miRNA-519抑制剂组中的毛细血管密度最多,miRNA-519过表达组中的毛细血管密度最少,差异有统计学意义(P<0.05)。(表3,图4)
表3 三组SD大鼠毛细血管数量和毛细血管密度比较(±s)

表3 三组SD大鼠毛细血管数量和毛细血管密度比较(±s)
注:与对照组比较,aP<0.05;与miRNA-519过表达组比较,bP<0.05
?
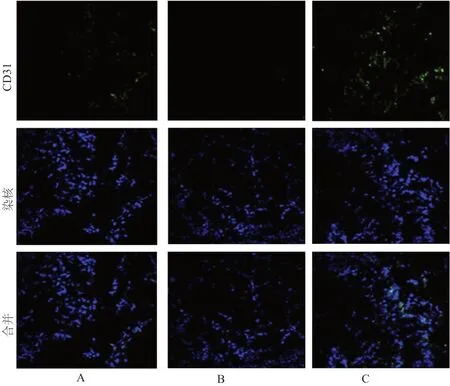
图4 三组SD大鼠腓肠肌组织毛细血管密度免疫组化染色(100 μm)
3 讨论
近年来,慢性周围动脉性疾病的发病率呈上升趋势,如血栓闭塞性脉管炎和下肢动脉硬化闭塞症等,这类疾病的发病机制和发病原因虽然不同,但其共同点是血管管腔逐渐缩窄导致闭塞,从而引起肢体缺血,病情严重的患者致使肢体坏死,引起截肢或死亡,最终导致不良的预后[10],给患者精神和身体带来巨大痛苦,同时也给家庭带来了沉重的负担。血管新生是恢复血流的前提,所以诱导血管新生是治疗下肢缺血的关键[11]。血管新生包括血管发生、动脉生成和血管新生,血管发生是指内皮祖细胞分化形成血管[12];动脉生成是指出现新形成的血管沟重塑形成小动脉;而血管新生是指内皮细胞通过分化和增殖在原有血管基础上以芽生和非芽生方式生成血管,在缺血性血管疾病的血运重建的生理过程中起着非常重要的作用[13]。
miRNA能够调节人类1/3的基因表达,这些基因调控着细胞分化、增殖、周期、凋亡、肿瘤转移侵袭和炎性反应等方面[14]。研究表明,miRNA-126对缺血诱导下的血管新生中起着促进作用[15]。也有研究表明,miRNA-15a可以促进缺血后新血管的形成[16]。 尽管关于miRNA在缺血血管疾病中的报道较多,但关于miRNA-519在缺血血管疾病中报道较少,miRNA-519位于人类染色体19q13.41,具有重要的生理功能,目前研究指出,miRNA-519与多种肿瘤的发生和发展密切相关[17]。本研究通过建立SD大鼠下肢缺血模型,构建miRNA-519在下肢缺血模型中的不同表达,结果显示,过表达miRNA-519可以抑制HuR蛋白表达;HuR广泛存在于神经元细胞和非神经元细胞中,对神经元分化和重塑具有重要的作用[18]。HuR蛋白生物学功能是结合特定靶mRNA,调节其剪接和翻译过程,从而影响其表达。
本研究观察大鼠缺血下肢血流情况,miRNA-519过表达组的大鼠下肢血流激光多普勒血流系数显著低于对照组,miRNA-519抑制剂组的大鼠下肢血流激光多普勒血流系数明显高于对照组和miRNA-519过表达组;miRNA-519过表达组肌细胞萎缩严重,血管数目较少,而miRNA-519抑制剂组肌细胞萎缩明显减轻,排列规整,血管分布较对照组和miRNA-519过表达组明显增多,且清晰可见。通过免疫组织化学染色,比较三组的毛细血管密度,结果显示,miRNA-519过表达组中的毛细血管密度低于对照组,miRNA-519抑制剂组中的毛细血管密度显著高于对照组和miRNA-519过表达组,表明抑制miRNA-519表达可以促进血管生成的作用。相关研究表明,miRNA-320在缺血性疾病中可以促进血管的生成作用[19],表明了miRNA对缺血诱导下的血管新生有着重要的促进作用 。
血管形成是一个复杂动态过程,MMP9在这一过程中具有非常重要的作用,MMP9有助于血管内皮细胞从血管基底膜中迁移和脱离,并促进基质相关生长因子的释放,进而在新生血管的过程中起着重要的作用[20]。VEGF能够诱导血管内皮细胞增殖,促进新生血管形成,并可增加微血管通透性[21]。本研究结果显示,miRNA-519过表达组中的VEGF和MMP9蛋白表达低于对照组,miRNA-519抑制剂组中的VEGF和MMP9蛋白表达显著高于对照组和miRNA-519过表达组,表明抑制miRNA-519表达能够促进新生血管形成,并增加微血管通透性。
综上所述,miRNA-519对血管生成具有重要的作用,其机制可能与抑制HuR、VEGF和MMP9表达相关。

