三碘甲状腺原氨酸激活Nrf2信号通路减轻H2O2诱导的HaCaT细胞损伤
吴俊丽,刘 芳,毛志蓉,高小青,杜 杰
0 引 言
慢性伤口常因组织氧合异常而导致伤口长期停滞于炎症期,从而延迟伤口愈合[1],并且其发病率随着年龄和糖尿病的增加而呈上升趋势[2],因而促进伤口愈合是亟需解决的问题。伤口愈合过程中,中性粒细胞和巨噬细胞在损伤部位浸润,释放炎症细胞因子、趋化因子和活性氧(reactive oxygen species,ROS)等,这些促炎细胞通过吞噬和产生自由基清除碎片和杀死细菌[3-4]。生理水平的ROS也可以促进血管收缩、血栓形成和减少局部血流,因而对伤口愈合有重要意义[5]。但是过度的炎症和ROS产生过量都会延迟伤口愈合。因为过度的炎症会导致持续水肿,阻碍伤口愈合的下一步进展,而且促炎症细胞因子和有毒的自由基对皮肤结构也会造成伤害[6],而过量的ROS或ROS解毒受损则会导致氧化损伤,是慢性伤口无法愈合的主要原因[5]。
核转录因子类红细胞-2因子(nuclear factor erythoid-2 related factor 2,Nrf2)是抗氧化应激防御的重要转录调节因子[7]。Nrf2的过表达可以限制氧化应激引起的细胞损伤。皮肤损伤时,Nrf2表达上调[8]。Nrf2在伤口愈合过程中的主要功能是防止内源性ROS过度累积[6]。研究表明局部外用三碘甲状腺原氨酸(triiodothyronine,T3)可刺激动物皮肤表皮增生,皮肤增厚及毛发生长[9],而缺失甲状腺激素核受体TRα1和TRβ (甲状腺激素结合的主要亚型)会导致表皮增殖、毛发生长和伤口愈合受损[10]。同时,局部外用T3可提高动物皮肤伤口愈合率[11-12]。因而,T3具有促进皮肤伤口愈合的能力,但其作用机制需要深入探讨。本研究通过体外制备人永生化角质形成细胞(human immortalized keratinocytes,HaCaT)氧化应激损伤模型,从细胞毒性、划痕实验、Nrf2及下游信号分子表达,以及炎症因子参数变化等方面,探讨T3对H2O2诱导的细胞损伤的保护机制。
1 材料与方法
1.1 实验材料HaCaT细胞购自湖南丰晖生物科技有限公司。RPMI-1640培养基和胎牛血清购自Hyclone公司;T3购自上海麦克林生化科技有限公司;MTT购自Sigma;Nrf2抑制剂ML385购自上海皓元生物医药科技有限公司;ROS、IL-6、TNF-α的ELISA试剂盒购自北京安迪华泰科技有限公司;丙二醛(MDA)、还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)检测试剂盒试剂盒购自南京建成生物研究所;兔抗Nrf2和HO-1抗体分别购自Cell Signaling Technology和Bioworld Technology、Inc公司。
1.2方法
1.2.1 细胞培养采用含10%胎牛血清的RPMI-1640培养液,于37 ℃,5% CO2饱和湿度环境中培养,待HaCaT细胞密度达到80%融合度时进行传代。
1.2.2MTT法检测细胞增殖活性将HaCaT以5×103个/孔接种在含T3的96孔板,T3浓度为1 nmol/L、0.5 nmol/L和0.1 nmol/L[9]。在分别培养24 h、48 h、72 h、96 h后采用MTT法检测细胞增殖情况。在各时间点,每孔加入20 μL 0.5% MTT溶液,在37 ℃孵育4 h后再加入150 μL DMSO,于振荡器上振荡10 min后,酶标仪上490 nm波长处测定各孔吸光度值。
1.2.3H2O2诱导HaCaT细胞氧化损伤模型构建及分组取对数生长期HaCaT细胞,接种于96孔板或6孔板,在含500 μmol/L H2O2的RPMI-1640培养基培养2 h。将细胞分为9组:正常组(未进行任何干预)、H2O2组(仅用H2O2造模)、ML385组(在用H2O2诱导细胞前,先用含20 μmol/L ML385处理细胞2 h)、1 nmol/LT3组(H2O2诱导2 h后,在含1 nmol/L T3培养液内培养24 h)、0.5nmol/L T3组(H2O2诱导2 h后,在含0.5 nmol/L T3培养液内培养24 h)、0.1 nmol/L T3组(H2O2诱导2 h后,在含0.1 nmol/L T3培养液内培养24 h)、ML385+1 nmol/L T3组(20 μmol/L ML385诱导+1 nmol/L T324h)、ML385+0.5 nmol/L T3组(20 μmol/L ML385诱导+0.5 nmol/L T324h)、ML385+0.1 nmol/L T3组(20 μmol/L ML385诱导+0.1 nmol/L T324h)。每组5个复孔。
1.2.4MTT法检测细胞活性按照2×104个/孔接种于96孔板,分别对9组细胞采用MTT法检测细胞活性。实验步骤同1.2.2。
1.2.5细胞划痕实验观察细胞迁移能力细胞按照5×105个/孔接种于6孔板,当细胞铺满孔底时,按上述9个分组处理细胞。在T3干预前用200 μL枪头垂直孔板划痕,划痕后吸去培养液,PBS清洗,各组加入不同浓度T3进行干预,置入37 ℃,5% CO2培养箱培养。在0 h和20 h时拍照记录,通过Image J v1.8.0软件计算细胞迁移面积,分析各组划痕面积修复率。划痕面积修复率计算如下:
划痕面积修复率=(0 h划痕面积-20 h划痕面积)/0 h划痕面积×100%
1.2.6ELISA法和比色法检测氧化应激和炎症反应相关指标细胞按照5×105个/孔接种于6孔板,按照9个分组处理细胞后,收集细胞上清,通过ELISA法和比色法检测上清中氧化应激相关指标含量,包括MDA、ROS、GSH、CAT和SOD,以及炎症因子IL-6和TNF-α含量。具体实验步骤按照试剂盒说明书操作进行,在酶标仪上测量各孔吸光度值,参照标准曲线计算相应指标的测定值。
1.2.7Western blot检测细胞Nrf2和HO- 1蛋白表达收集上清后的各组细胞加入PMSF/RIPA裂解液进行裂解提取总蛋白,用BCA法测定蛋白浓度,加入上样缓冲液煮样变性。取等质量蛋白样品在聚丙烯酰胺凝胶上进行电泳分离,转移至PVDF膜,5%脱脂奶粉室温封闭1 h,分别加入兔抗Nrf2 (1 ∶ 800)、兔抗HO-1 (1 ∶ 800),以及兔抗Tubulin (1 ∶ 2000),4 ℃孵育过夜。TBST洗涤3次后,辣根过氧化物酶标记的山羊抗兔二抗 (1 ∶ 800)室温孵育1 h,加入增强化学发光剂ECL显色,凝胶成像系统拍照。使用Image Jv1.8.0软件分析蛋白条带灰度值。目的蛋白相对表达量计算公式如下:
目的蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值
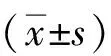
2 结 果
2.1 T3对HaCaT细胞增殖活性的影响1 nmol/L T3、0.5 nmol/L T3、0.1 nmol/L T3细胞的增殖活性显著高于正常细胞(P<0.05),表明各浓度的T3均促进了细胞生长。见表1。

表 1 T3对细胞增殖活性的影响
2.2T3对H2O2诱导的细胞毒性的影响H2O2组和ML385组的细胞活性显著低于正常组(P<0.05);1 nmol/L T3组、0.5 nmol/L T3组和0.1 nmol/L T3组的细胞活性高于H2O2组(P<0.05);ML385+1 nmol/L T3组细胞活性较1nmol/L T3组明显降低(P<0.05);ML385+0.5 nmol/L T3组细胞活性较0.5nmol/L T3组明显降低(P<0.05),ML385+0.1 nmol/L T3组细胞活性较0.1 nmol/L T3组明显降低(P<0.05),见表2。
2.3T3对细胞迁移能力的影响细胞划痕实验所示,培养20 h,H2O2组和ML385组的面积修复率显著低于正常组(P<0.05);1 nmol/L T3组、0.5 nmol/L T3组和0.1 nmol/L T3组面积修复率较H2O2组明显增高(P<0.05);ML385+1 nmol/L T3组较1 nmol/L T3组、ML385+0.5 nmol/L T3组较0.5 nmol/L T3组、ML385+0.1 nmol/L T3组较与0.1 nmol/L T3组面积修复率显著降低(P<0.05),见图1,表2。
2.4T3对H2O2诱导的氧化应激和炎症因子的影响与正常组比较,H2O2组细胞上清内的氧化产物MDA和ROS水平,及炎症因子IL-6和TNF-α水平升高(P<0.05),而抗氧化物GSH、CAT和SOD水平降低(P<0.05)。1 nmol/L T3组、0.5 nmol/L T3组和0.1 nmol/L T3组的MDA、ROS、IL-6和TNF-α水平较H2O2组明显降低(P<0.05),GSH、CAT和SOD水平明显升高(P<0.05)。ML385+1 nmol/L T3组较1 nmol/L T3组、ML385+0.5 nmol/L T3组较0.5 nmol/L T3组、ML385+0.1 nmol/L T3组较0.1 nmol/L T3组MDA、ROS、IL-6和TNF-α水平明显升高(P<0.05),GSH、CAT和SOD水平明显降低(P<0. 05),见表3。

表 2 各组细胞活性和面积修复率比较

图示T3促进了HaCaT细胞迁移,而ML385降低了T3作用
1:正常组;2:H2O2组;3:ML385组;4:1nmol/L T3组;5:0.5nmol/L T3组;6:0.1nmol/L T3组;7:ML385+1nmol/L T3组;8:ML385+0.5nmol/L T3组;9:ML385+0.1nmol/L T3组
图 1 划痕实验检测各组HaCaT细胞迁移( ×100)
Figure 1 The representative images of the migration of HaCaT cells detected by scratch wound assay ( ×100)

表 3 各组细胞上清中氧化应激及炎症相关指标水平比较
2.5T3对Nrf2/HO-1信号通路蛋白的影响H2O2组Nrf2与HO-1的蛋白水平高于正常组(P<0.05),而ML385组低于正常组(P<0.05);与H2O2组比较,1nmol/L T3组、0.5 nmol/L T3组、0.1 nmol/L T3组Nrf2与HO-1表达明显升高(P<0.05);ML385+1 nmol/L T3组较1 nmol/L T3组、ML385+0.5 nmol/L T3组较0.5 nmol/L T3组、ML385+0.1 nmol/L T3组较0.1 nmol/L T3组Nrf2与HO-1蛋白的表达明显降低(P<0.05),见图2,表4。
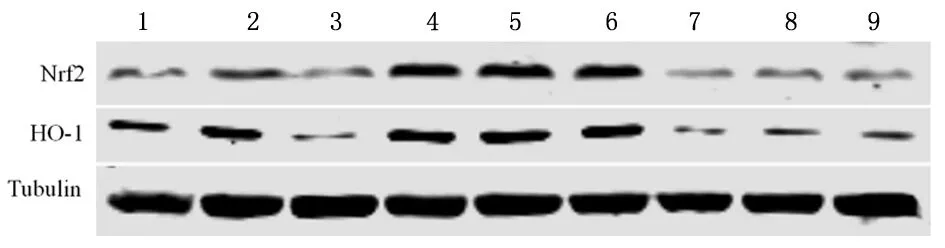
1:正常组;2:H2O2组;3:ML385组;4:1 nmol/L T3组;5:0.5 nmol/L T3组;6:0.1 nmol/L T3组;7:ML385+1 nmol/L T3组;8:ML385+0.5 nmol/L T3组;9:ML385+0.1 nmol/L T3组

表 4 各组细胞的Nrf2和HO-1蛋白相对表达水平比较
3 讨 论
伤口愈合是一个复杂的,高度调节的过程,对维持皮肤屏障功能至关重要。如果伴行多种疾病过程,与伤口愈合有关的连锁反应可能会受到影响,常导致慢性或无法愈合的伤口,令患者感到严重不适和痛苦,同时消耗大量医疗系统资源[13]。研究表明T3在伤口愈合中发挥作用,外用T3治疗加速了啮齿类动物伤口愈合[12, 14]。本实验应用H2O2诱导HaCaT细胞以模拟皮肤伤口氧化损伤,并用T3干预,结果显示T3减轻了H2O2诱导的细胞毒性,提高了划痕面积修复率,后者表明T3增强了氧化应激下的HaCaT迁徙能力,间接表明T3能促进伤口再上皮化。应用Nrf2抑制剂ML385干预后,细胞活性和面积修复率又降低。T3促进伤口愈合的确切机制目前仍然不清楚,因而需要进一步深入研究。因本实验发现T3减轻了H2O2诱导的HaCaT细胞氧化及炎性损伤,因此,T3可能通过抗氧化和抗炎症反应促进伤口愈合。
在正常的伤口愈合过程中,作为对入侵病原体的固有反应,受损组织会产生ROS作为细胞信使刺激与伤口愈合相关的关键过程,包括细胞运动、血管生成和细胞因子作用等[15-16]。然而,ROS产生过多超过了其有益作用则会导致额外的组织损伤[17]。抗氧化机制保护细胞免受ROS诱导的损伤,但若因各种原因造成氧化平衡被打破,组织将经历氧化应激,对包括蛋白质、脂类和核酸在内的多种分子造成损害[15]。已知的抗氧化系统成员有GSH、CAT、SOD和HO-1和醌氧化还原酶-1(quinine oxidoreductase-1,NQO-1)等,而这些细胞保护蛋白均受Nrf2调控[18-20]。本实验发现H2O2会诱导HaCaT细胞氧化产物MDA和ROS含量增多,而抗氧化物GSH、CAT和SOD含量降低,同时,H2O2诱导细胞的Nrf2和HO-1蛋白表达升高,表明H2O2诱导了HaCaT氧化损伤,同时也激活了Nrf2通路。当用3种浓度T3干预后,MDA和ROS含量降低,GSH、CAT和SOD含量升高,而Nrf2和HO-1的表达更强,3个T3组之间的这些指标表达水平没有差异,表明T3激活了Nrf2通路并减轻了细胞氧化损伤,并在0.1~1 nmol/L浓度范围内其作用强度没有差异。为了进一步探讨Nrf2信号通路在T3减轻氧化损伤中的作用,本实验用了Nrf2抑制剂ML385进行干预。结果发现经ML385干预后,ML385+T3与T3相比,其MDA、ROS水平升高,而GSH、CAT、SOD、HO-1和Nrf2水平降低,这些结果说明Nrf2信号通路参与了T3减轻H2O2诱导的细胞氧化损伤作用。
伤口愈合炎症期,受伤部位浸润的中性粒细胞除产生ROS外,还通过呼吸爆发活动释放炎症介质,如IL-6和TNF-α[21]。持续的炎症会损伤修复部位生长中的组织,导致伤口无法愈合[22-23]。因组织损伤后几乎会立即引起急性炎症,因此控制炎症可以优化创伤修复过程。本实验结果发现3个浓度的T3显著降低了H2O2诱导的的IL-6和TNF-α水平,提示T3减轻了H2O2诱导的细胞炎性损伤,而3个浓度之间比较没有显著差异,表明在0.1~1 nmol/L浓度范围内其抗炎作用强度没有差异。使用ML385后,IL-6和TNF-α的水平又升高,表明Nrf2信号通路参与了T3的抗炎作用。
综上所述,本实验表明了T3减轻了H2O2诱导的氧化及炎性损伤,可能是通过激活Nrf2介导的抗氧化信号通路起作用。对T3的作用机制的阐明,有利于为T3治疗皮肤创伤的临床应用提供实验依据,并为皮肤创伤的治疗提供一种既高效、安全而又成本低廉的候选药物。

