红树莓花色苷的纯化及抑菌活性研究
李西波,李泽瑞,米全凤,沈悦萌,刘颖,张晋平,张继
(1.西北师范大学生命科学学院,甘肃兰州730070;2.甘肃特色植物有效成分制品工程技术研究中心,甘肃兰州730070)
红树莓(Rubus idaeus L.)属于蔷薇科悬钩子属灌木、半灌木或匍匐草本植物,又名悬钩子、覆盆子,是目前世界上稀缺的、纯天然绿色可食用浆果,因其富含各种营养和功能活性成分,享有“黄金水果”的声誉[1]。红树莓柔软多汁,风味独特,富含维生素、矿物质等成分,尤其是花色苷、超氧化物歧化酶和鞣花酸[2-4],越来越受到人们欢迎[5]。已有研究表明,红树莓花色苷安全、无毒,具有较强的抗氧化、抗衰老、保护心脑血管健康等功能[6-10],因此提高红树莓花色苷的提取和纯化效率,是目前亟需解决的问题。
红树莓花色苷既溶于水,也溶于极性有机溶剂,且在酸性溶液中稳定性较高,因此常用酸性有机溶剂提取花色苷。肖军霞等[11]和王煜伟等[12]分别采用酸化乙醇和酸化甲醇等单一提取法,而万山等[13]采用超声波辅助酸化乙醇法提取红树莓花色苷,通过对比发现,单一有机溶剂法提取花色苷的提取率远不及超声辅助法,这是由于超声波振荡破坏了植物细胞壁,进而使提取剂进入胞内部分离了结合态花色苷从而提高了花色苷提取率[10,14]。由于AB-8型大孔树脂吸附层析具有吸附性、解吸附性强,设备简单且成本低等特点,成为常用的纯化花色苷方法。谭佳琪等[15]和汪礼洋等[16]对比不同大孔树脂纯化红树莓花色苷,发现采用AB-8型大孔树脂纯化花色苷纯度提高最多。当前研究红树莓花色苷抑菌活性的较少,孙希云等[17]分别采用滤纸片法和菌落计数法初步研究了树莓叶、果的体外抑菌性,并未得到有效结果。
本研究以酸化乙醇作为提取剂,利用超声辅助法和AB-8型大孔树脂纯化法精制红树莓花色苷,结合单因素和正交试验优化工艺,并研究纯化花色苷的抑菌活性,为提升红树莓的高值化利用提供科学依据。
1 材料与方法
1.1 材料与仪器
红树莓冻果:酒泉金硕元生物科技有限公司;果胶酶(食品级):浙江一诺生物科技有限公司;AB-8型大孔树脂:青岛海洋化工厂;黑曲霉(Aspergillus niger)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、啤酒酵母菌(Saccharomycete cerevisiae):西北师范大学微生物实验室保存;PDA培养基、LB肉汤培养基:上海博微生物科技有限公司;其它所用试剂均为分析纯。
V-5000紫外-可见分光光度计:上海元析仪器有限公司;H1850R高速离心机:长沙湘仪离心机仪器有限公司;PHS-3C pH计:上海仪电科学仪器股份有限公司;KQ-250DE型超声波清洗器:昆山市超声仪器有限公司;RE-3000旋转发生器:上海亚荣生化仪器厂。
1.2 溶液配制
1)pH1.0盐酸-氯化钠缓冲液:分别配制0.20 mol/L盐酸和氯化钠溶液,按体积比25∶67将上述两种溶液混匀。
2)pH4.5醋酸-醋酸钠缓冲液:分别配制0.20 mol/L醋酸和醋酸钠溶液,等体积量取上述两种溶液混匀。
3)pH3.0柠檬酸-磷酸氢二钠缓冲液:分别配制0.6 mol/L Na2HPO4·12H2O(准确称取53.72 g定容于250 mL容量瓶)和0.3 mol/L柠檬酸(准确称取14.41 g定容于250 mL容量瓶),按照体积比100∶127将上述两种溶液混匀。
1.3 培养基的配制
1.3.1 牛肉膏蛋白胨培养基
精确称取牛肉膏3.0 g、蛋白胨10.0 g、NaCl 5.0 g、琼脂 20 g、溶解于 1 000 mL水中,调节 pH7.4~7.6,灭菌备用。
1.3.2 LB液体培养基
精确称取25.0 g LB肉汤,溶解于1 000 mL蒸馏水中,121℃灭菌15 min备用。
1.3.3 马铃薯葡萄糖琼脂培养基
精确称取马铃薯葡萄糖琼脂培养基39.0 g,溶解于1 000 mL蒸馏水,121℃灭菌15 min备用。
1.4 试验方法
1.4.1 超声波辅助法提取红树莓花色苷单因素试验
参考徐俐等[18]的文献报道,花色苷浓度与吸光值呈线性关系,对提取剂中花色苷的含量进行衡量,花色苷含量以吸光度表示,分别考察超声温度、提取剂浓度、提取剂pH值、料液比、超声时间对花色苷吸光值的影响,从而确定超声波辅助法提取花色苷的最佳单因素条件。红树莓冻果在25℃~28℃下,避光解冻30 min,组织捣碎制成匀浆,准确称取一定量解冻的红树莓冻果,超声温度30、40、50、60℃,超声时间60、90、120、150 min,料液比 1∶4、1∶6、1∶8、1∶10(g/mL),以及浓度和 pH 值分别为 30%、50%、70%、90%和 1、2、3、4的乙醇提取剂,在510 nm测定吸光值,重复3次,确定最佳提取条件。
1.4.2 正交试验设计
超声辅助法正交试验可以确定提取过程中各因素对提取结果影响的大小和最佳提取工艺,根据单因素试验结果,选取超声温度、提取剂浓度、超声时间、提取pH值和料液比进行五因素四水平正交试验设计,采用L16(45)正交表进行试验,确定最佳工艺参数,见表1。
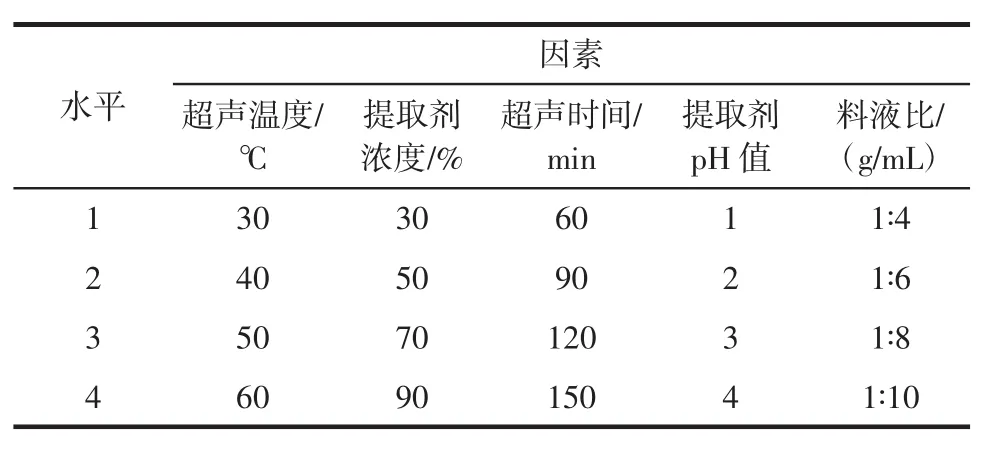
表1 L16(45)正交试验设计Table 1 Orthogonal test condition factor level
1.4.3 pH示差法测定花色苷提取率
利用分光光度法分别在510 nm和710 nm下测定花色苷吸光值,按如下公式计算红树莓花色苷提取率[19]。
花色苷提取率/(mg/g)=(A×Mt×DF×V)/(e×b×m)
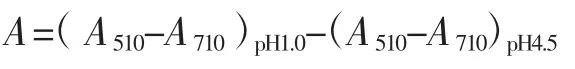
式中:A510为510 nm下待测液的吸光值;A710为710 nm下待测液的吸光值;Mt为锦葵色素-3,5-二葡萄糖苷的摩尔质量,655.2 g/mol;DF为稀释因子;e为锦葵色素-3,5-二葡萄糖苷的消光系数,20 500 L/(mol×cm);V 为提取液的总体积,mL;b为比色杯厚度,1 cm;m为样品质量,g。
1.4.4 红树莓花色苷纯化工艺研究
1.4.4.1 花色苷粗提物的制备
按最佳提取工艺提取花色苷,4 000 r/min离心10 min,取上清液,50℃旋转蒸发浓缩得到花色苷粗提物。
1.4.4.2 树脂预处理
超纯水冲洗除去破碎或细小的树脂,用无水乙醇浸泡24 h,并用无水乙醇多次洗涤,以洗出液中加适量水未出现白色浑浊作为洗涤终点,最后用超纯水反复冲洗除去乙醇,将处理好的树脂浸泡于超纯水中备用。
1.4.4.3 花色苷纯化工艺研究
1)绘制静态吸附曲线和解吸曲线
取粗提液10 mL,稀释至100 mL,称取预处理的AB-8型大孔树脂5.0 g置于三角瓶中,分别于0、30、60、90、120、150、180、210 min 在 510 nm 测定吸光值,绘制静态吸附曲线。取上述饱和吸附的大孔树脂置入锥形瓶中,加入50%乙醇,每隔30 min在510 nm测定吸光值,绘制静态解吸曲线。
2)上样液和洗脱剂对解吸的影响
分别称取1 g预处理后的AB-8型大孔树脂加入锥形瓶中,分别调整花色苷粗提液 pH1、2、3、4、5、6,并分别用不同浓度(50%、60%、70%、80%、90%)和pH值(1、2、3、4)的乙醇为洗脱剂洗脱,pH示差法计算花色苷吸附量,研究上样液pH值、洗脱剂浓度和洗脱剂pH值对解吸的影响。
3)色价的测定
色价是一种表示色素含量的方法,指全部发色物质占样品质量的百分率。方法如下:分别取2 mL样品和溶剂加入18 mL pH3.0柠檬酸-磷酸氢二钠缓冲液中,于510 nm下测吸光值,按如下公式计算其色价。

式中:E为色价;A为510 nm下吸光值;W为取样量,mL;a为样品稀释倍数。
1.4.5 抑菌活性研究
1.4.5.1 敏感性试验
在培养皿(10 cm)内倒入20 mL对应的固体培养基,将活化的0.10 mL大肠杆菌、金黄色葡萄球菌、黑曲霉、啤酒酵母菌液(105CFU/mL)均匀涂布在固体培养基上。将灭菌的牛津杯置于培养基上,每个培养基均匀放置4个牛津杯,其中3个牛津杯中加入不同浓度的花色苷溶液0.10 mL,第4个牛津杯加入0.10 mL无菌水作对照。大肠杆菌和金黄色葡萄球菌置于37℃恒温培养72 h,黑曲霉和啤酒酵母置于28℃恒温培养36 h,通过观察抑菌圈大小判断是否具有抑菌活性。
1.4.5.2 最小抑菌浓度的确定
将精制红树莓花色苷用无菌水按照二倍稀释法稀释并分别加入到LB液体培养基中,并接入不同被抑制的菌株,恒温摇床上培养观察生长情况,以完全不长菌的稀释液的浓度作为最小抑菌浓度(minimal inhibit concentration,MIC)探讨红树莓花色苷的抑菌能力。
2 结果与分析
2.1 单因素试验结果
超声辅助法提取红树莓花色苷的单因素试验结果见图1。
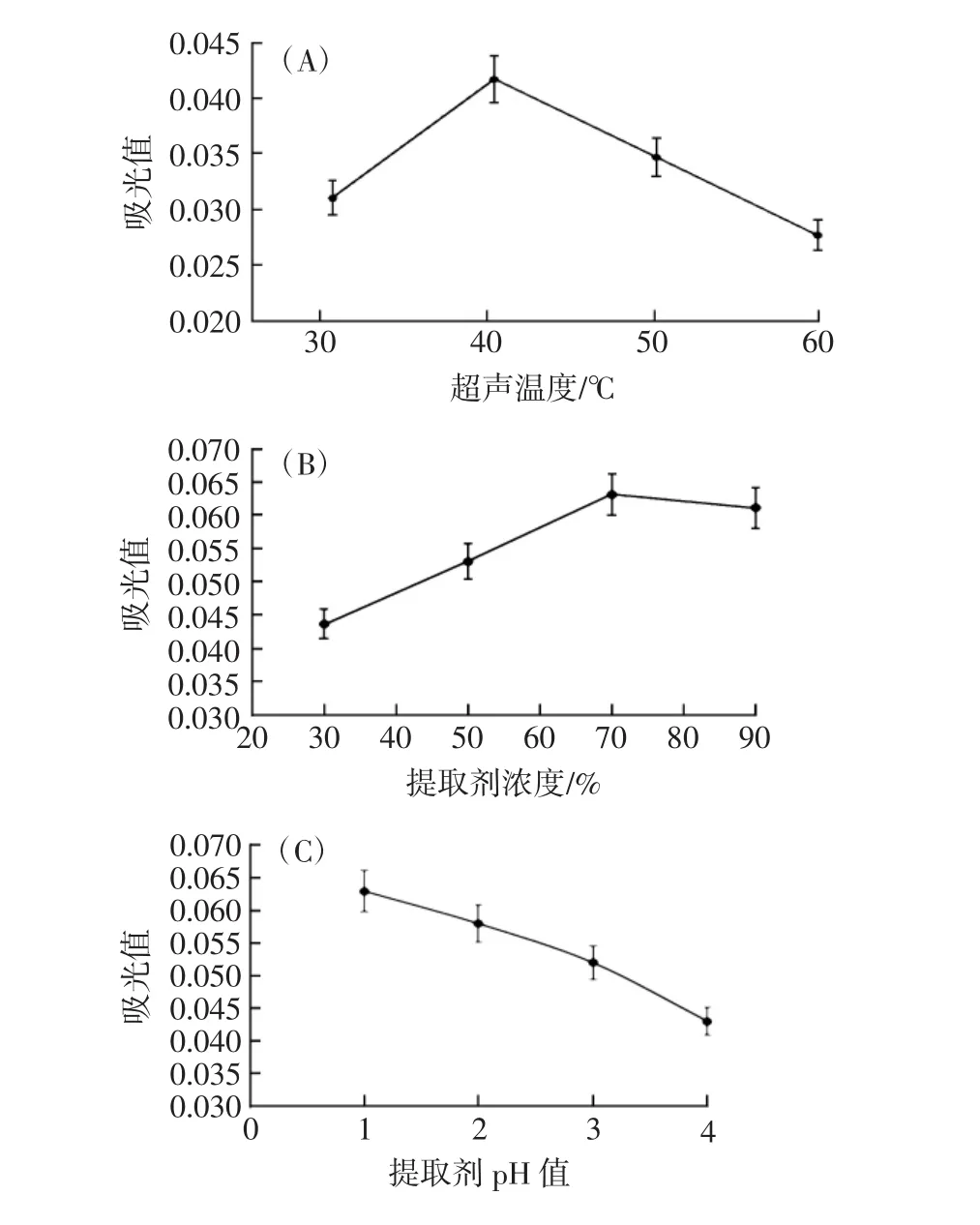
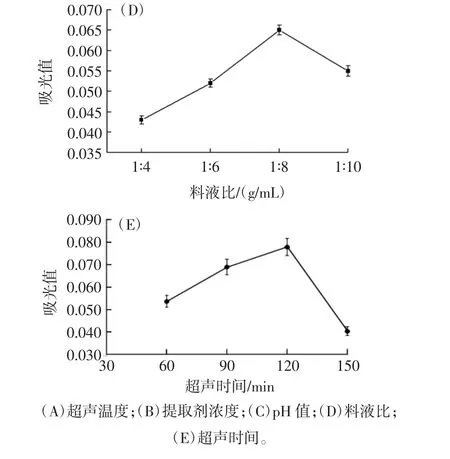
图1 单因素试验结果Fig.1 Single factor test results
由图1可知,随着温度的升高和提取剂浓度的增加,吸光值都呈现先升高再降低的趋势,当超声温度40℃时吸光值最高(图1A),当浓度达到70%时变化趋于平缓(图1B),这是由于温度的升高促进了花色苷的分解,影响了其稳定性[20],同时乙醇对于果胶具有沉淀作用,降低了对花色苷提取的干扰作用[21]。在pH1时花色苷吸光值达到最大(图1C),这和文献报道的花色苷在pH1时稳定性最好一致[22]。料液比和超声时间对花色苷吸光值的影响也是先升高后下降,当料液比1∶8(g/mL)和超声时间120 min时达到最大(图1D和图1E),这是由于提取溶剂增大到一定程度,降低了超声波对细胞的作用,而使得吸光值下降,同时超声时间过长导致花色苷分解而使其含量降低[23]。通过单因素试验,确定红树莓花色苷最适反应条件为超声温度40℃、提取剂浓度70%、提取剂pH1、料液比1∶8(g/mL)、超声时间 120 min。
2.2 正交试验结果
正交试验和多因素方差分析结果分别见表2和表3。
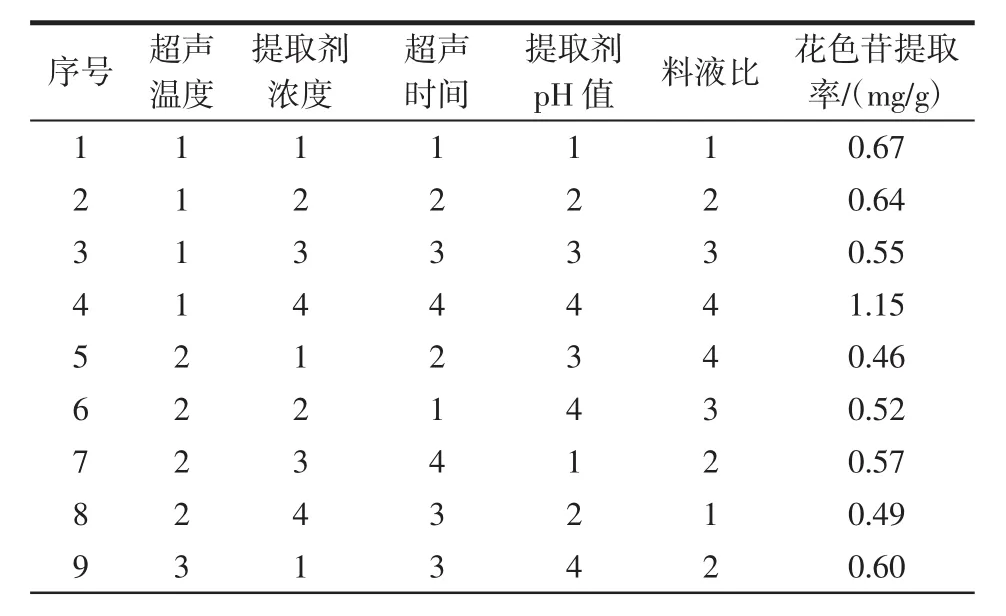
表2 正交试验结果Table 2 Orthogonal test results
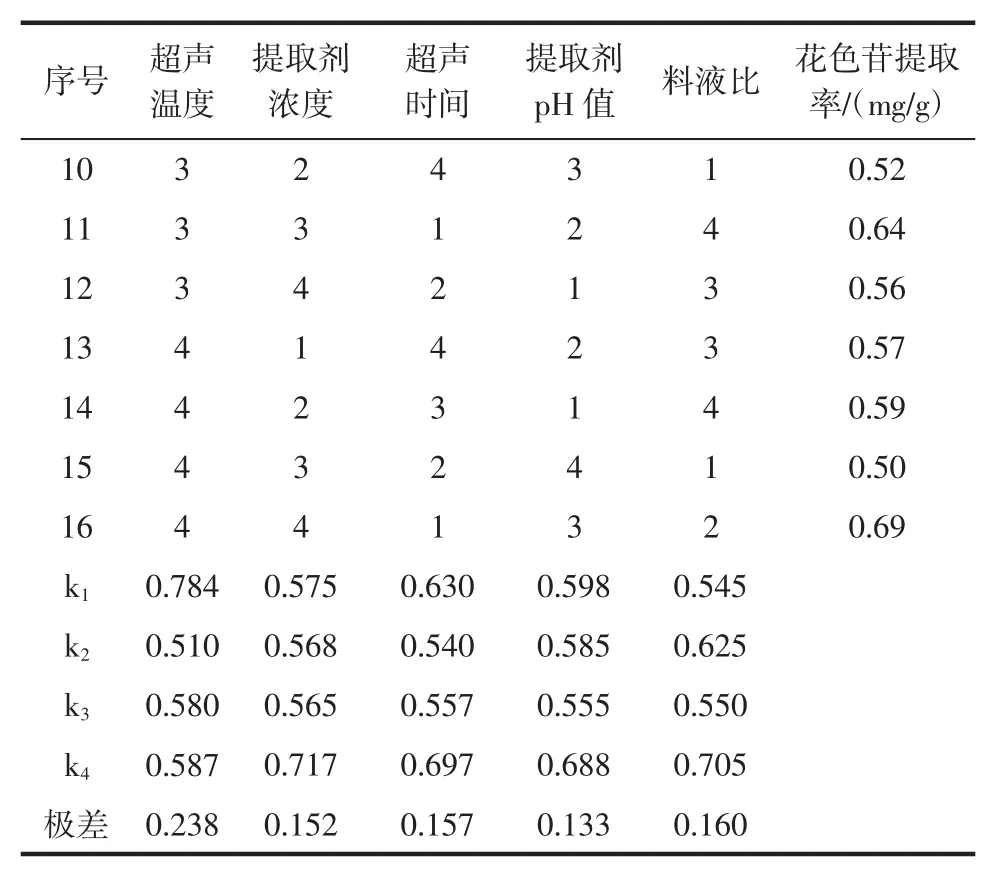
续表2 正交试验结果Continue table 2 Orthogonal test results
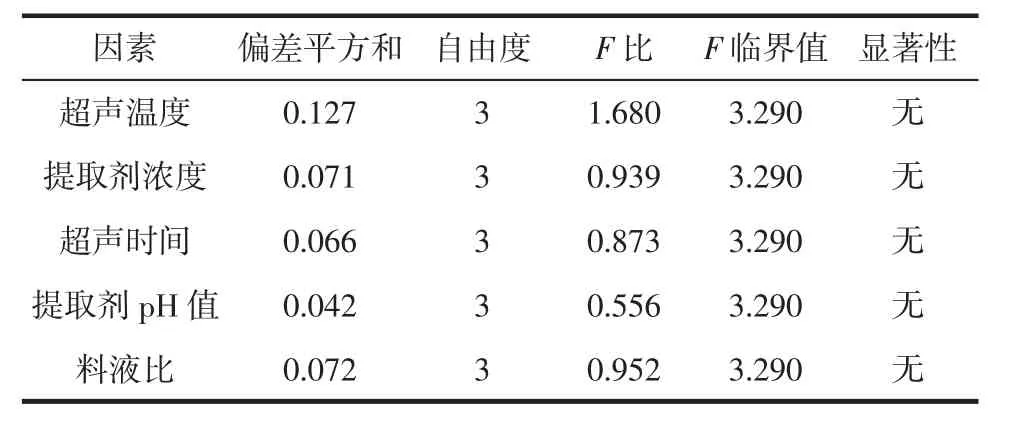
表3 多因素方差分析结果Table 3 Multi-factor analysis of variance results
由表2可知,不同因素对花色苷提率影响的大小依次为超声温度>料液比>超声时间>提取剂浓度>提取剂pH值。由表3方差分析可知,各因素对红树莓花色苷提取率影响差异不显著。综合考虑红树莓花色苷提取效果,影响因素的最优组合为超声温度30℃,提取剂浓度 90%,pH4,超声时间 150min,料液比 1∶10(g/mL),此时花色苷提取率达到了1.15 mg/g,与正交试验结果一致。
2.3 红树莓花色苷纯化工艺研究
2.3.1 静态吸附和解吸曲线的绘制
利用AB-8型大孔树脂的静态吸附试验,绘制静态吸附曲线和解吸曲线见图2。
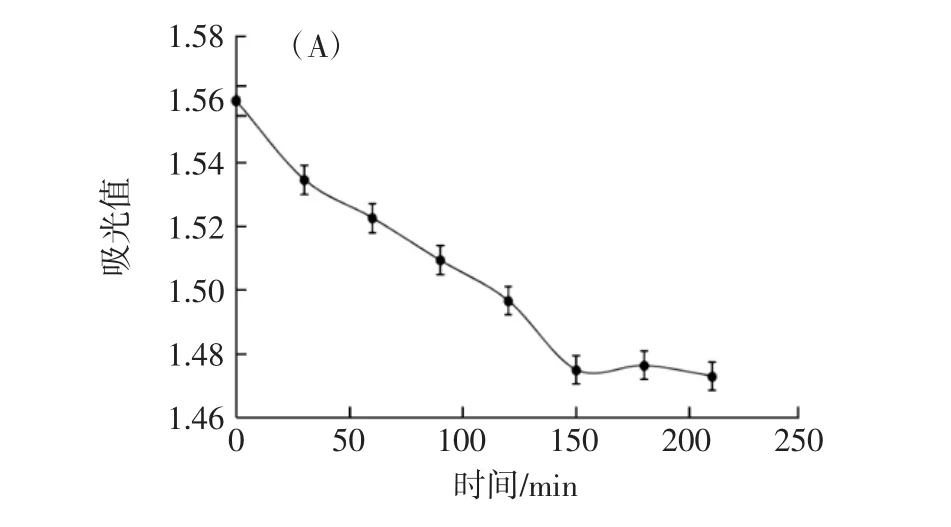
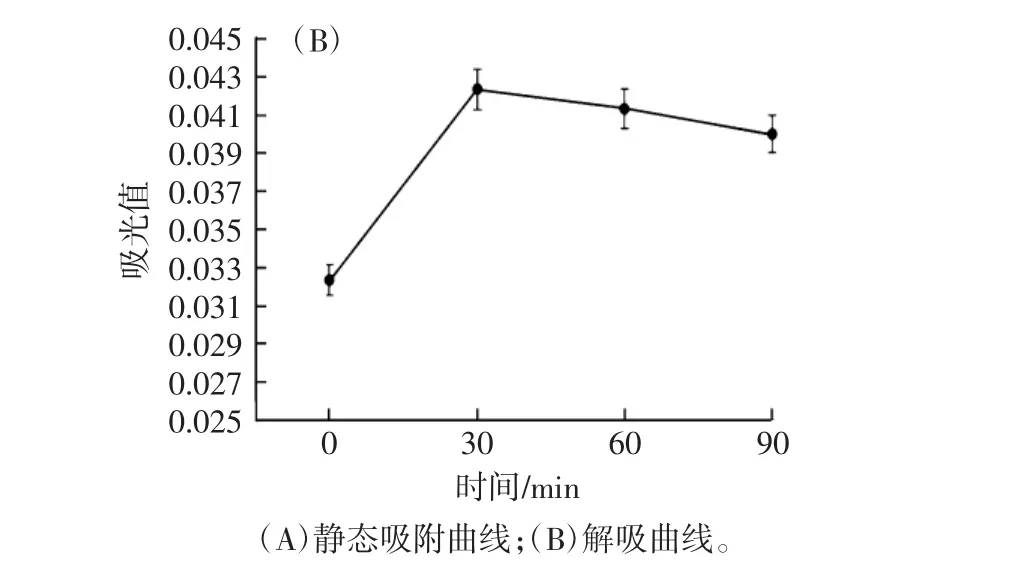
图2 静态吸附曲线和解吸曲线Fig.2 Static adsorption curve and desorption curve
由图2(A)可知,红树莓花色苷吸光值随着试验进行逐渐减小,大孔树脂吸附从未饱和到饱和状态,在150 min后变化越来越小。取饱和吸附红树莓花色苷的大孔树脂AB-8置入锥形瓶中,加入50%乙醇,每隔30 min在510 nm测定吸光值,绘制静态解吸曲线,结果见图2(B),溶液吸光值先快速上升,而后解吸趋于平衡,在30 min时花色苷含量最高,因此表明AB-8型大孔树脂的静态吸附在150 min时,树脂达到了最佳的饱和溶胀状态,而解吸时间为30 min。
2.3.2 上样液和洗脱剂对解吸的影响
上样液pH值对吸附量、洗脱剂浓度及pH值对解吸率的影响见图3。
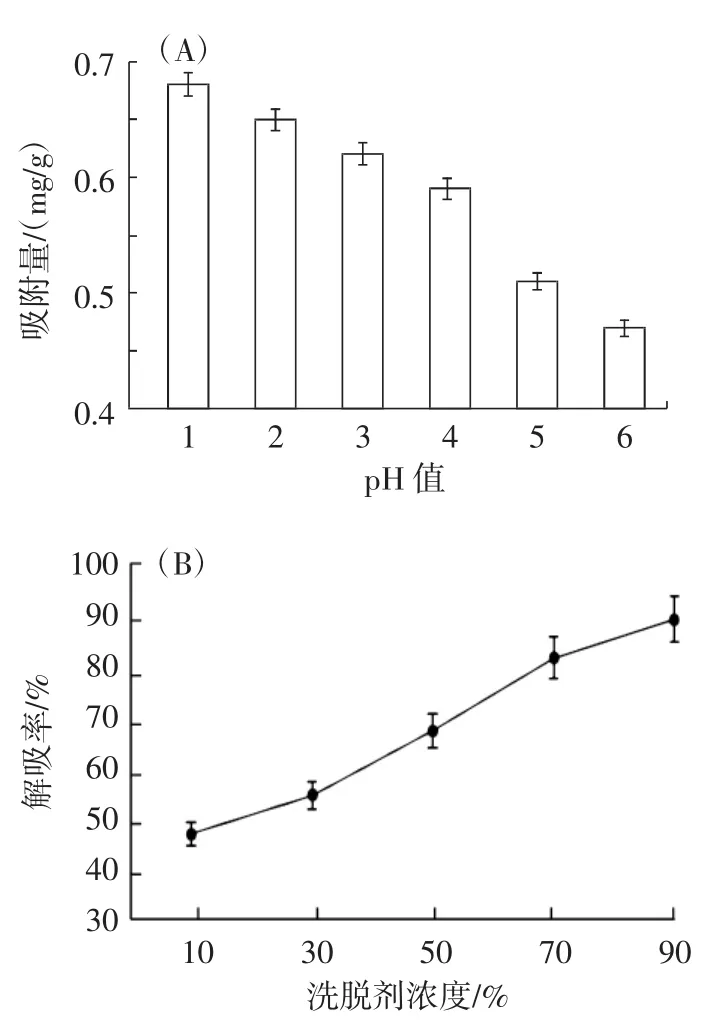
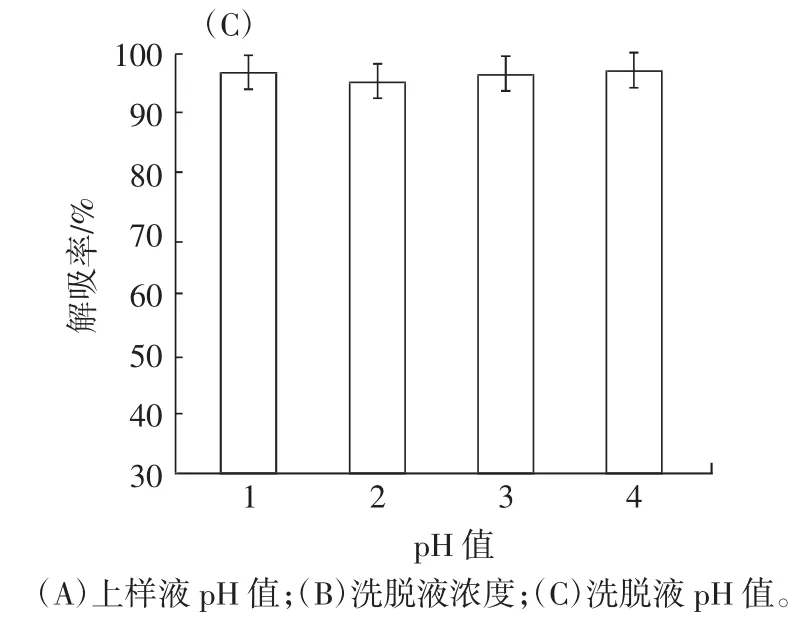
图3 上样液pH值对吸附量、洗脱剂浓度及pH值对解吸率的影响Fig.3 The influence of the pH value of the sample solution on the adsorption capacity,eluent concentration and pH value on the desorption rate
将AB-8型大孔树脂和不同pH值的红树莓花色苷粗提液吸附达到平衡,采用pH示差法计算其吸附量,得到不同pH值上样液对吸附量影响的结果(图3A)。当pH值为1时其吸附率最高,高达0.68 mg/g,而后随着pH值增大,吸附量逐渐降低。这是由于随着酸性降低,花色苷结构发生变化,减弱了树脂对花色苷吸附能力,进而降低了AB-8型大孔树脂对花色苷的吸附量。
由图3B和图3C可知,随着洗脱剂浓度逐渐升高,解吸率逐渐上升,当乙醇浓度达到90%时,解吸率达到最大值88.76%,而不同pH值洗脱剂对解吸率的影响不明显,考虑到花色苷在酸性条件下比较稳定,因此确定浓度90%、pH2的乙醇溶液为最佳洗脱剂。
2.4 色价测定
通过测定纯化前后红树莓花色苷的吸光值,并计算其色价,结果显示纯化后花色苷纯度较纯化前提高了1.68倍,显著提高,说明利用AB-8型大孔树脂纯化红树莓花色苷效果较好。
2.5 花色苷抑菌活性研究
红树莓花色苷敏感性研究结果见表4。

表4 红树莓花色苷对不同菌种的抑菌活性Table 4 Antibacterial activity of red raspberry anthocyanins against different strains
红树莓花色苷对大肠杆菌和金黄色葡萄球菌具有较好的抑制作用,抑菌圈大小分别为(22.91±0.47)mm和(47.24±9.43)mm;但花色苷对啤酒酵母和黑曲霉无明显抑制作用,且加入花色苷的黑曲霉生长比蒸馏水对照组处理后生长效果更好,表明红树莓花色苷黑曲霉的生长具有促进作用[24]。
红树莓花色苷的最小抑菌浓度的研究结果见表5。
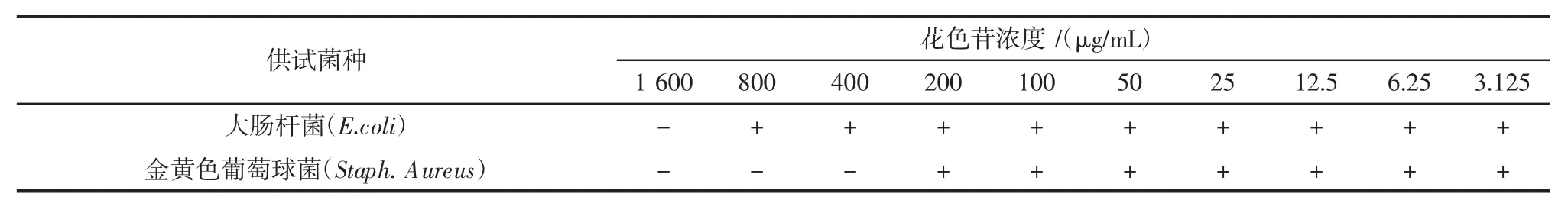
表5 红树莓花色苷最小抑菌浓度的测定结果Table 5 Determination results of the minimum inhibitory concentration of red raspberry anthocyanins
花色苷对于大肠杆菌和金黄色葡萄球菌的最小抑菌浓度分别为1 600 μg/mL和400 μg/mL,抑菌效果明显。大肠杆菌与金黄色葡萄球菌分属革兰氏阴性菌和革兰氏阳性菌,说明花色苷对细菌有广泛的抑制作用[25]。
3 讨论与结论
通过单因素及正交试验,得到红树莓花色苷提取的最佳工艺为超声温度30℃、提取剂浓度90%、提取剂 pH4、超声时间 150 min、料液比 1∶10(g/mL),在此条件下提取率为1.15 mg/g,较单一使用酸化乙醇法提取率高1.58倍[11]。主要是由于超声波破坏植物细胞壁,使有机溶剂易于进入细胞内部,进一步提高了提取效率,减少了提取时间和有机溶剂的浪费[26]。通过对红树莓花色苷纯化工艺研究,确定最佳纯化条件:上样液pH2、静态吸附时间150 min、洗脱剂浓度90%、洗脱剂pH2、解吸时间30 min,纯化后花色苷纯度为纯化前的1.68倍,明显优于采用单一的酸化乙醇纯化工艺。纯化后的红树莓花色苷对于大肠杆菌和金黄色葡萄球菌具有明显抑制生长的作用,而对于啤酒酵母菌及黑曲霉则无抑制作用。通过对红树莓花色苷提取、纯化工艺的优化以及抑菌活性研究,期望对红树莓花色苷的开发利用提供参考依据。

