微流控器官芯片及其在毒理学评价中的应用与展望
苏 曼,李 翔,华辰凤,赵 阁,尚平平,赵俊伟,王 昇,谢复炜
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号450001
微流控芯片技术又称芯片实验室(Lab-on-a-chip),即把样品制备、反应、分离、检测等基本操作单元集成到一块芯片上,用来实现常规生物或化学实验室的各种功能的一种技术,是目前公认的生物学研究主要技术平台之一[1]。最初,微流控芯片被用于以微型色谱和毛细管电泳构建“微全分析系统µ-TAS”或“芯片实验室”模型来代替实验室分析的传统分析方法[2]。随着微流控芯片技术的广泛应用,研究人员开始将其应用于细胞生物学领域,利用微加工技术实现芯片上的细胞培养[3],在微流控芯片上制造出能够模拟人类器官主要功能的仿生系统,也称为“器官芯片(Organ-on-chip)[4-5]”。器官芯片利用微流控技术可以产生精确可控的流体剪应力、周期性变化的机械力和溶质浓度梯度变化的灌注液体[6-7]。通过多种细胞的灵活组合,还可以在微流控芯片平台上研究组织-组织、器官-器官的相互作用,从而模拟人体器官的复杂结构、微环境和生理功能[8-9],其中微环境的模拟、组织-器官的相互作用模型以及类器官模型的可变性是器官芯片面临的技术挑战和未来致力的研究方向[10]。器官芯片在细胞三维培养方面具有的独特优势,弥补了传统二维细胞培养模式难以实现人体组织器官复杂生理功能的局限,解决了动物实验周期长、成本高、难以预测人体对于各种药物响应的问题[11],符合“21世纪毒理学”的愿景与策略,实现了体内研究的体外代替,在微纳尺度上实现多维度的生命分析。
目前,肺[12]、肝[13]、肾[14-15]、肠[16]、神经[17]和心脏[18]等器官芯片的构建已经实现。器官芯片通过与细胞生物学、工程学和生物材料等各个学科的技术相结合,可以模拟多种组织和器官微环境,反映人体器官的主要结构和功能特征,已被应用于生物医学和环境科学等领域。基于微流控芯片在毒性评估中的优势,器官芯片将在烟草制品风险评估领域具有重要的应用价值。本文中着重介绍了肺、肠、肝芯片以及多细胞组合的多器官芯片[19]的研究进展和器官芯片在药物毒性评估和环境毒理学中的应用,在此基础上展望了器官芯片在烟草制品毒理学评价领域的研究趋势。
1 微流控器官芯片研究进展
1.1 肺芯片
在以往的肺部疾病相关研究中已经建立了许多体外模型和动物模型,但是这些模型是否与临床结果相一致还存在争议[20-22]。实验室内广泛使用的啮齿动物,由于种属差异的存在,生理过程与人类有很大不同[23-24]。另一方面,现有的体外模型通常利用二维单层培养的细胞系或未分化的原代细胞,与实际生理环境差异大,而微流控芯片技术可以实现细胞的三维培养,这为疾病研究的体外建模[25]和毒性评估[26]提供了新的平台。目前已经建立了小气道疾病、肺水肿、哮喘和外源性肺损伤等模型[27]。
2010年,哈佛大学的Ingber研究团队设计了双层夹膜结构的肺芯片经典模型[12],这种仿生肺模型又被称为“会呼吸的肺”,芯片上层为气体腔室,培养肺泡上皮细胞;下层为液体层,培养血管内皮细胞;中间由微孔膜分隔开,通过对两侧腔室的规律性抽吸带动细胞生长层的伸缩来模拟呼吸运动(图1)。之后,Ingber课题组在该肺芯片上建立了肺水肿模型[28],研究发现,在呼吸运动的存在下白介素-2(IL-2)对肺气血屏障的损坏作用更为显著。2018年,Ingber团队的Jain等[29]将原代肺泡上皮细胞与内皮细胞共培养在这种肺芯片模型上,用于评估血栓的形成,结果表明脂多糖(Lipopolysaccharide,LPS)通过激活肺泡上皮间接刺激血管内血栓形成,为研究人类肺血栓形成机制提供了新方法。2016年,Ingber团队的Benam等[30]设计了一种“小气道芯片”,包含上层气液界面培养的原代细支气管上皮细胞层和下层微血管内皮细胞层,微血管通道内流过含有中性粒细胞的培养液,可实时分析生理剪切力作用下内皮细胞捕获白细胞的情况。这种小气道芯片可用于在体外模拟复杂、动态的炎症反应,进一步拓展了肺芯片技术在体外模型构建中的应用。2016年,大连医科大学的Xu等[31]报告了一种用于研究肺癌细胞转移的多器官芯片,该芯片包括一个上游的“肺”和3个下游器官:脑、骨骼、肝,CXCR4蛋白、RANKL蛋白、AFP蛋白等标志物的过表达表示癌细胞转移后细胞受损,该芯片系统为模拟体内肿瘤转移的微环境和研究转移过程中细胞-细胞相互作用提供了一种可靠的体外平台。2018年,加拿大多伦多大学的Humayun等[32]设计了一种肺气道芯片模型,发现随培养时间的延长,人气道平滑肌细胞(Human airway smooth muscle cells,HBSMCs)趋向于呈现出与体内类似的纵向排列的情况。

图1 肺芯片示意图[12]Fig.1 Schematic diagram of a lung chip
1.2 肠芯片
口服药物必须经小肠才能进入血液,肠是吸收代谢的重要器官,许多药物在肠中发生首过作用[33-34]。肠芯片通过在体外复制肠绒毛的结构或与基质细胞的共培养来模拟体内肠道细胞的生理微环境[35],以维持各种转运蛋白和代谢酶的表达。2010年,德国Saarland大学的Leonard等[36]建立了一个模拟肠道黏膜炎症的三维细胞培养模型,人结肠腺癌细胞Caco-2细胞与巨噬细胞和树突状细胞共培养状态下,炎性细胞因子反应强于单独培养的Caco-2细胞。2013年,中科院大连化学物理研究所(大连化物所)的Li等[37]在胶原蛋白凝胶层上共培养Caco-2细胞和经甲氨蝶呤诱导后的人结肠腺癌细胞HT29-MTX细胞,凝胶中还掺入了基质细胞(成纤维细胞和免疫细胞),与单独培养模型相比,跨膜电阻值较低,更接近体内值。2017年,韩国Hongik大学的Choe等[38]设计了一种肠-肝共培养芯片,在动态共培养条件下表现出细胞色素P450代谢酶活性的显著增强。2018年,大连化物所的Guo等[16]利用器官芯片模拟人肠道内药物的代谢(图2),在涂敷I型胶原蛋白的硝酸纤维素膜上接种Caco-2细胞,融合后的肠上皮细胞保持了紧密连接蛋白ZO-1的持续表达以及绒毛蛋白、蔗糖酶异麦芽糖酶和碱性磷酸酶基因的高表达。一些研究人员将Caco-2细胞培养在人工制造的胶原绒毛支架上,发现细胞形成类似于肠道绒毛的三维形状[39-40]。另外,一些研究中还进行了肠上皮细胞和其他细胞的共培养,如2019年,巴西Brazilian Biosciences National Laboratory的Marin等[41]设计了一种双层腔室肠-肝微流控芯片,将Caco-2和HT-29两种细胞混合共培养形成体外肠屏障,肠屏障上跨膜电阻值在21 d内随细胞分化程度的增大而增加。这些结果均显示了共培养在肠芯片中对肠功能的促进作用,但与真实的人体相比,肠芯片在吸收和代谢功能方面仍有一定的差距,另外肠道菌群的存在对于肠功能研究也具有非常重要的意义,未来肠芯片在对人体高度仿生方面仍然需要投入更多精力。
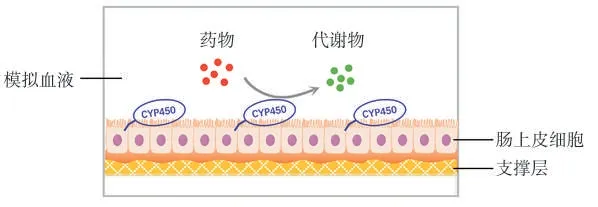
图2 肠芯片示意图[16]Fig.2 Schematic diagram of an intestinal chip
1.3 肝芯片
肝脏是药物和其他外源性物质毒性作用的主要靶器官[42]。传统体外毒理学评价实验中,肝毒性的评估主要利用二维培养的永生化肝细胞系HepG2和原代肝细胞,这类模型的缺点是代谢活性较低,肝脏特异性功能下降较快[43],三维培养条件下的肝芯片可模拟体内肝组织的结构和功能。
2016年,美 国 哈 佛 医 学 院 的Bhise等[44]将HepG2/C3A细胞嵌入甲基丙烯酸水凝胶中制成球状体排列在微流控芯片中,可通过检测特定标志物的变化来评估肝脏毒性。2017年,波兰华沙理工大学的Zuchowska等[45]利用三维培养的HepG2细胞球体来研究抗癌药5-氟尿嘧啶(5-FU)的肝细胞毒性,表明肝芯片可用于药物毒性评估。2018年,澳大利亚莫纳什大学的Delalat等[46]利用含有微沟的硅芯片实现肝原代细胞的三维培养,芯片上的肝细胞表现出更高代谢酶活性,细胞色素酶CYP1A2、2E-1、3A-4活性水平以及白蛋白和尿素水平均高于二维细胞培养。2019年,德国海德堡大学的Theobald等[47]利用永生化肝细胞系HepG2和肾小管上皮细胞RPTC构建了肝-肾微流控芯片,维生素D在芯片上能够代谢活化并对人原髓细胞白血病细胞HL60产生毒性作用,证明芯片上的肝细胞具备一定的代谢功能。
以上这些芯片中模拟器官结构的设计对于芯片上细胞的代谢活性均具有积极的作用,但这些研究只是一种肝细胞的培养,对肝细胞的选择比较单一。
肝脏中的代谢活动和毒性反应往往由多种细胞参与,非实质细胞的存在对于实现细胞间信号分子的传导以及肝细胞功能的增强非常重要。一些研究人员在芯片模型中引入非实质细胞(内皮细胞、星状细胞、库普弗细胞等),例如,2016年西北农林科技大学的Ma等[48]利用HepG2和非实质细胞HAECs的共培养开发了模拟肝小叶结构的芯片装置,肝酶测定结果表明,芯片上细胞能够保持较高的基础CYP1A1/2活性和UDP-葡萄糖醛酸转移酶(UGT)活性,以及较强的药物代谢能力。2017年,中科院力学研究所的Du等[49]利用肝窦内皮细胞、库普弗细胞、肝星状细胞和肝细胞的共培养在体外复制肝窦的结构,发现另外3种非实质细胞的存在促进了中性粒细胞在肝窦内皮细胞上的聚集。2019年,Draper实验室的Bale等[50]将原代肝细胞与库普弗细胞共培养在一种双层芯片中,肝细胞在7 d的连续培养中显示出稳定的蛋白分泌和代谢功能。2019年,大连理工大学的Deng等[13]设计了类似的多细胞肝窦结构芯片(图3),肝细胞保留了细胞色素P4501A1/2和UGT的酶活性,药物肝毒性的测试结果与经典的原代肝细胞孔板模型结果相似,这类多细胞衍生的肝脏模型为研究药物肝毒性、药物-药物相互作用提供了一种替代方法。

图3 肝芯片模型[13]Fig.3 A liver chip model
1.4 多器官芯片
多器官微流控芯片将不同器官和组织来源的细胞在芯片上培养,能在体外模仿体内不同器官、组织之间的生理相互作用,在评价组织间相互作用方面具有优势[51]。2015年,德国柏林工业大学的Maschmeyer等[52]设计了共培养肠、肝、皮肤和肾细胞的多器官芯片,细胞在28天内均保持高活性并能够自发形成功能化的结构。2016年,清华大学的Jie等[53]将Caco-2细胞、HepG2细胞、人神经胶质细胞瘤细胞U521分别模拟肠道、肝和胶质母细胞瘤在芯片上进行共培养,在体外成功建立了芯片上药物吸收和代谢模型。美国中佛罗里达大学的Oleaga等[54]使用无泵重力驱动流体体系将功能性心脏、肝脏、骨骼肌和神经细胞共培养14 d,用于研究4种药物——阿霉素、阿托伐他汀、丙戊酸和对乙酰氨基酚的毒性作用。2016年,大连化物所的Li等[55]利用多层器官芯片装置评估不同器官特异性细胞(肝脏细胞、乳腺癌细胞、肺癌细胞和正常胃细胞)中药物代谢和细胞毒性效应,研究发现卡培他滨对于肿瘤细胞有较强的细胞毒性,但对正常胃细胞无明显的细胞毒性,这种体外模型不仅用于评价药物在不同靶组织上的生物活性,也可用于不同细胞对受试物刺激的毒理学反应研究。2020年,大连理工大学的黄恒顺等[56]基于微流控技术构建了肠-肝-乳腺多器官芯片并将其用于药物的体外代谢动力学-药物效应动力学(Pharmacokinetics-pharmacodynamics,PK-PD)研究。类似的肠-肝芯片[40]也用来模拟脂肪酸在肠道和肝脏的吸收和积累。
多器官芯片的发展为未来的“人体芯片”提供了初级模型,但在还原人体复杂度方面的发展任务依然艰巨。
2 微流控器官芯片在毒理学中的应用
2.1 药物毒性评估
药物毒性评估是器官芯片技术的重要应用领域,器官芯片能够在单个芯片系统中同时实现药物的代谢和作用过程,为药物开发和研究提供高通量平台,这是二维细胞培养模型和动物模型所不具备的[10]。
药物引起的肝损伤是影响药物研发和使用的最常见原因,肝芯片可作为药物肝损伤体外评 价 的 有 效 工 具[57]。2012年,法 国Centre de Recherche de Royallieu的Prot等[58]利 用 肝 芯 片 评价对乙酰氨基酚对肝癌细胞的毒性作用,观察到对乙酰氨基酚处理可引起钙离子稳态失调、脂质过氧化和细胞凋亡等现象,证明了肝芯片在毒性预测研究方向的潜力。2015年,德国柏林工业大学的Maschmeyer等[52]设计了一种皮肤、肠、肝和肾共培养的多器官芯片系统,该芯片可以模拟口服药物在体内的作用方式,在模拟体内药物作用与毒性方面潜力非常大。2017年,韩国Hongik大学的Lee等[59]在含有肝脏和肿瘤细胞的多器官芯片中测定了木犀草素的抗癌活性,木犀草素经HepG2细胞代谢后对Hela细胞产生抑制作用。
微流控芯片在其他靶器官的药物毒性研究中也有应用,如用于神经毒性和肾毒性的研究。2014年,美国伦斯勒理工学院的Meli等[60]开发了用于人类神经干细胞(hNSC)生长和分化的高通量分析的三维细胞微阵列系统,能够用于筛选不同物质对hNSC的毒性。2013年,美国塔夫斯大学的DesRochers等[61]在三维肾组织模型上比较顺铂、庆大霉素和阿霉素诱导的急性和慢性毒性,与二维细胞培养相比,三维组织培养系统具有能够长期监测细胞毒性的优势,并且对药物剂量更加敏感。2013年,哈佛大学Ingber研究团队的Jang等[62]在芯片上培养原代肾上皮细胞用于药物转运和肾毒性评估,与常规培养条件相比,芯片上毒性测试结果更接近体内情况,在临床前安全性研究的肾脏毒性评估中具有应用潜力。
2.2 环境毒理学评价
由于环境污染物对人类的未知不良健康影响,迫切需要对其进行筛选和评估。器官芯片系统可用于环境毒理学中污染物的毒理学预测和机制研究,目前,已经出现了器官芯片在有机污染物化合物、颗粒物和金属离子等方面的应用研究。
环境污染物中的小分子化学物质在体内代谢后对靶器官产生毒性。2012年,法国里昂大学的Shintu等[63]利用微流控芯片与核磁共振氢谱(1H NMR)结合,研究了几种毒性分子(氨气、二甲基亚砜、对乙酰氨基酚)在肝脏细胞、肾脏细胞单独培养以及共培养条件下的器官特异性代谢反应,并确定了这几种分子暴露和毒性损伤的代谢标志物。2018年,德国海德堡大学的Theobald等[64]提出了一种肺-肝脏芯片模型,用于研究黄曲霉毒素B1(Aflatoxin B1,AFB1)和苯并芘(B[a]P)的生物转化和毒性作用。2020年,韩国Konyang大学的Dong等[65]在培养人肝细胞的微柱/微孔芯片平台上研究了沙梨(Pyrus pyrifolia)提取物对典型环境污染物双酚A毒性作用的影响,在沙梨提取物存在下双酚A的毒性降低,双酚A对HepG2细胞的半数致死浓度(IC50)从151 μmol/L变为451 μmol/L,这可为物质的相互作用研究提供一种新思路。
环境中颗粒物的暴露也是影响公共健康的重要因素之一。2018年,武汉理工大学的Li等[66]利用纤维素蛋白凝胶作为支架进行了人肺成纤维细胞(HLF细胞)的三维培养,并进行了纳米级颗粒物的暴露实验,结果表明,纳米颗粒物(Nano-particulate matter,NPM)与富含蛋白质的液体接触时形成的“蛋白冠”能够降低NPM的细胞毒性,刺激HLF细胞的增殖,并可能导致肺纤维化。该结果为研究PM2.5诱导的肺功能受损(尤其是肺纤维化)提供了合适的体外模型。2018年,大连化物所的Zhang等[67]提出了一种共培养人肺上皮细胞和人血管内皮细胞的三维人肺芯片模型,用于模拟人肺的纳米颗粒暴露,在纳米颗粒暴露(TiO2-NPs和ZnO-NPs)下,分析了上皮细胞和内皮细胞的细胞形态变化、ROS的产生和凋亡,该芯片能够实现纳米颗粒毒理学影响的预测,可用于环境安全评估。2019年,武汉理工大学的Li等[68]基于纤维蛋白凝胶支架构建了三维微血管结构,用于研究室内空气中纳米级颗粒物(Airborne nanoscale particles,ANPs)进入血液后对凝血功能的影响,结果表明,ANPs可刺激人血管内皮细胞产生活性氧(Reactive oxygen species,ROS),并进一步导致凝血因子(TF、TM和t-PA)的异常表达,为ANPs导致凝血异常提供了细胞层面上的解释。
金属离子也是环境污染物中的主要毒性物质之一。2019年,台湾大学的Tan等[69]开发了一种器官芯片用来评估暴露于金属铜和铊诱导的细胞毒性。与传统静态培养的细胞毒性实验相比,在芯片上可以通过增加剪应力进而增加细胞对金属暴露的敏感性,为细胞毒性的定量分析提供更为灵敏的平台。
2.3 烟草制品毒理学评价
卷烟燃吸产生的烟气作为环境污染物的来源之一,其体外毒理学研究对于烟草制品危害性评价具有重要意义。相较于传统的二维细胞培养模型,器官芯片在烟草制品毒性评估方面具有优势。2018年,东南大学的Zhang等[70]提出了一种可发生多液体梯度的微流体细胞系统,用于在高通量方式下研究卷烟烟气有害成分B[a]P诱导的支气管上皮细胞损伤,结果显示,暴露后上皮细胞出现明显的细胞萎缩、细胞骨架解体、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)活化、活性氧增多、多种炎症细胞因子(肿瘤坏死因子-α、白介素-6、白介素-8)分泌。这一实验结果与以往动物实验和二维体外细胞模型中的结果一致,并且具有高通量的优点。之后该课题组又在芯片上共培养了肺泡上皮细胞和微血管内皮细胞,对烟气中两种化学成分(B[a]P、烟碱)刺激的多种肺部反应动力学(包括炎症信号、细胞骨架、组织结构和凋亡)进行了检测和定量评价[19]。2018年,大连化物所的Wang等[71]在微流控芯片上构建了一种人源诱导多能干细胞(hiPSC)衍生的大脑类器官系统,研究了暴露于烟碱的大脑类器官的细胞凋亡,这种大脑类器官芯片为研究烟碱暴露引起的神经发育障碍提供了合适的平台。2017年,菲莫烟草公司的Iskandar等[72]构建了基于气液界面的人三维鼻黏膜上皮细胞体外模型,用来评估新型烟草制品THS烟草加热系统2.2(THS2.2)产生的气溶胶与参比卷烟3R4F产生的烟气气溶胶的毒理学影响的差异,发现在细胞毒性水平、组织形态变化、促炎因子分泌、纤毛功能受损以及转录组和miRNA表达谱紊乱增加等方面,3R4F卷烟烟气气溶胶的毒性影响均远远大于THS2.2气溶胶。2019年,菲莫烟草公司的Poussin等[73]利用原代人冠状动脉内皮细胞建立了芯片上内皮微血管的三维(3D)模型,用3D血管芯片模型来评估新型烟草制品THS2.2和参比卷烟3R4F对单核细胞粘附到内皮微血管的影响,结果表明,与3R4F烟气气溶胶相比,THS 2.2气溶胶对单核细胞-内皮细胞粘附的影响降低,这为研究动脉粥样硬化的形成机制以及与烟草制品的风险相关性提供了替代性体外模型,同时也为新型烟草制品风险评估提供了新方法。2019年,吉林大学的Hou等[74]利用仿生肺芯片模型对上皮细胞和血管内皮细胞进行动态的共培养,发现持续的烟气暴露可引起肺气-血屏障的破坏和上皮间充质转化,证实了信号传导与转录激活因子3(Signal transducer and activator of transcription 3,STAT3)是烟气引起的炎症发生恶性转变的关键作用点,这提示微流控芯片可以作为卷烟烟气诱发恶性转化相关研究的合适平台。2016年,Ingber研究团队的Benam等[30]设计的小气道芯片将呼吸运动模拟和卷烟烟气暴露相结合,再现了体内的氧化应激反应,并发现了新的吸烟引起的纤毛病理现象。2018年,郑州烟草研究院的Liu等[75]设计并制作了一种可实现气液双梯度暴露的微流控芯片(图4a),在琼脂糖凝胶表面接种人肺腺癌细胞A549并形成气液接触界面,下层可形成4个液体梯度(图4b),上层形成4个气体梯度(图4c),利用构建的芯片平台研究了卷烟烟气暴露对A549细胞的氧化损伤,检测了细胞内ROS变化(图4d)。该芯片不仅实现了基于气-液界面的细胞烟气暴露,还能够产生多个气体和液体梯度,实现高通量分析,可用于卷烟烟气的毒性效应评估。

图4 气-液双梯度全烟气暴露芯片[75]Fig.4 Microfluidic liquid-air dual-gradient chip for whole smoke exposure
3 展望
器官芯片技术可以为体外培养的细胞、组织提供良好的生理环境,并增强其功能和对毒性物质刺激的敏感性。尽管器官芯片在材料、细胞来源、通量和验证方面均面临一些挑战,但其已在毒理学评估中显示出了巨大的应用潜力。在未来发展中,多器官芯片以及“人体芯片”的发展将成为新的趋势,开发“人体芯片”对促进生理健康和药物筛选研究意义重大。在模拟体内结构的条件下,如何精准模拟体内的微环境已成为芯片发展中的挑战,基于仿生体内微环境的机制研究将减小因实验数据从动物向人群外推带来的不确定度,更加直观地反映疾病风险。
器官芯片技术有可能在烟草制品风险评估研究中发挥其优势,并替代动物模型和常规细胞模型,如在卷烟烟气的肺吸入毒性评价、吸烟相关疾病模型的建立与机制研究以及烟气成分代谢动力学等研究方面。以往烟草制品风险评估中的毒理学评价通常使用体外二维细胞培养模型或体内动物实验研究烟草制品的健康影响,由于烟气气溶胶的复杂特性以及人体实际吸烟过程中长期低剂量的烟气成分暴露特点,如何快速、准确、科学地评估烟草制品的健康影响是当前面临的重要难题和挑战。通过借助多学科的交叉合作,从材料学、分析化学、生物学、流体力学和生物信息学等领域可能实现突破创新:
(1)遵循“21世纪毒理学”和动物实验“3R原则”,设计研发例如肺芯片、肝芯片等单器官芯片和多器官组合芯片,模拟烟气暴露和代谢的体内微环境,建立基于器官芯片技术的吸烟相关疾病体外评估模型。
(2)整合器官芯片技术和多组学分析技术,开展烟气有害成分的快速、高通量代谢动力学研究和生物标志物筛选,阐释烟草相关疾病的有害结局路径(AOP),在微纳尺度上实现多维度的生命分析。

