术前预后营养指数、白蛋白/碱性磷酸酶比值对肾癌患者预后的评估价值
陈 峰,陈益金,邹永胜,王云霄,吴小刚,蒲永昌,唐铁龙
(1.射洪市人民医院泌尿外科,四川 射洪 629200;2.川北医学院附属医院泌尿外科,四川 南充 637000)
肾癌是泌尿系统常见的恶性肿瘤之一。目前,随着人们饮食结构及生活习惯的改变,肾癌的发病率也逐年上升,严重威胁着人们的生命健康。手术切除是肾癌的重要治疗方法,但对于中晚期肾癌患者,即便切除原发病灶,也容易出现复发及转移,严重影响患者的生存预后[1]。预后营养指数(prognostic nutritional index,PNI)是由血清白蛋白和外周血淋巴细胞计数计算而来,可用于评估患者的营养状况、手术风险、术后并发症等[2]。研究发现,PNI与胰腺癌、结直肠癌、宫颈癌等多种恶性肿瘤的预后密切相关[3-5]。白蛋白/碱性磷酸酶比值(albumin/alkaline phosphatase ratio,AAPR)是反映机体营养状态及炎症程度的新指标,AAPR降低与恶性肿瘤的预后不良密切相关[6]。恶性肿瘤患者的营养状态对预后有重要影响,但PNI、AAPR对肾癌患者预后的评估价值尚未明确。因此,本研究回顾性分析我科收治的肾癌患者的临床资料,探讨术前PNI、AAPR对肾癌患者预后的预测价值。
1 资料与方法
1.1 临床资料
选取2012年1月至2015年1月在射洪市人民医院泌尿外科接受根治性肾切除术的肾癌患者127例作为肾癌组,其中男71例,女56例;年龄30~78岁,平均(56.24±10.13)岁。纳入标准:①经CT和病理学检查诊断为肾癌;②年龄≥18岁;③术前未接受放疗、化疗等抗肿瘤治疗;④临床随访资料完整。排除标准:①合并其他器官恶性肿瘤;②伴有严重心、肝、肺等功能障碍;③合并自身免疫性疾病或免疫缺陷疾病;④术前存在急慢性感染。另选取于射洪市人民医院体检的健康志愿者80例作为对照组,其中男40例,女40例;年龄25~78岁,平均(54.71±8.69)岁。2组性别、年龄相比,差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会审批(SHSYY-2011-12-25),患者及其家属均签署知情同意书。
1.2 方法
1.2.1 外周血PNI、AAPR检测 在术前24 h或体检时空腹抽取外周静脉血10 mL,以3 500 r/min离心10 min,分离血清,置于-80 ℃冰箱保存待测。应用OLYMPUS AU2700型全自动生化分析仪及配套试剂自动检测血清碱性磷酸酶、白蛋白水平;采用希森美康XE-5000型血常规分析仪检测淋巴细胞计数。PNI=5×淋巴细胞计数+血清白蛋白;AAPR=血清白蛋白/碱性磷酸酶。
1.2.2 临床资料收集 收集肾癌患者的资料,包括年龄、性别、BMI、高血压、糖尿病、肿瘤家族史、美国麻醉师协会(American Society of Anesthesiologists,ASA)分级、肿瘤直径、病理类型、病理分期、Fuhrman分级、肿瘤转移情况等资料。
1.3 随访及观察指标
采取门诊及电话随访方式对127例肾癌患者进行为期5年的随访,术后2年内每3个月随访1次,2年后每6个月随访1次,以死亡作为随访终点时间,随访截止日期为2020年1月30日。根据患者预后状况将肾癌组患者分为预后良好组(n=86)和预后不良组(n=41)。比较肾癌组与对照组、预后良好组与预后不良组的外周血PNI、AAPR。
1.4 统计学方法
2 结果
2.1 肾癌组和对照组外周血PNI、AAPR比较
肾癌组患者的外周血PNI、AAPR均低于对照组,差异有统计学意义(P<0.05),见表1。

表1 肾癌组和对照组外周血PNI、AAPR比较
2.2 预后不良组与预后良好组外周血PNI、AAPR比较
预后不良组患者的外周血PNI、AAPR均低于预后良好组,差异有统计学意义(P<0.05),见表2。

表2 预后不良组与预后良好组外周血PNI、AAPR比较
2.3 ROC曲线
ROC曲线结果显示,PNI预测肾癌患者预后的曲线下面积(areaunderthecurve,AUC)为0.756(95%CI:0.651~0.860,P<0.001),截断值为41.25,敏感度和特异度分别为0.779、0.632;AAPR预测肾癌患者预后的AUC为0.839(95%CI:0.759~0.919,P<0.001),截断值为0.40,敏感度和特异度分别为0.735、0.789;联合检测PNI、AAPR预测肾癌患者不良预后的AUC为0.907(95%CI:0.852~0.962,P<0.001),敏感度和特异度分别为0.900、0.725,见图1。根据截断值将患者分为高PNI组(PNI≥41.25,n=80)和低PNI组(PNI<41.25,n=47),高AAPR组(AAPR≥0.40,n=85)和低AAPR组(AAPR<0.40,n=42)。

图1 术前PNI、AAPR预测肾癌患者预后的ROC曲线
2.4 不同组别肾癌患者的临床资料比较
低PNI组患者与高PNI组患者在肿瘤直径、病理分期、Fuhrman分级、肿瘤转移方面相比,差异有统计学意义(P<0.05);低AAPR组患者与高AAPR组患者在肿瘤直径、病理分期、Fuhrman分级、肿瘤转移方面相比,差异有统计学意义(P<0.05),见表3、4。
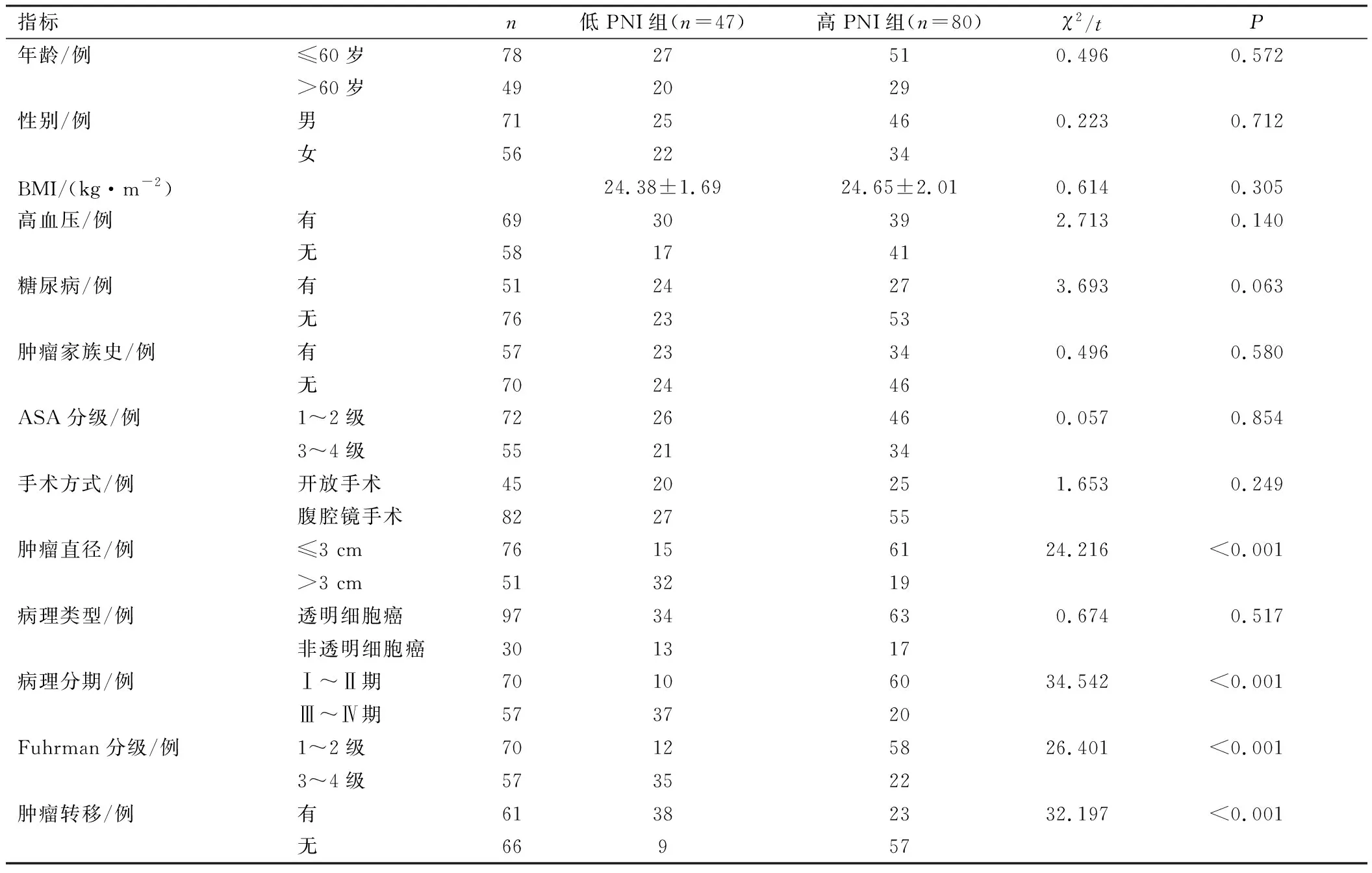
表3 不同PNI组肾癌患者临床资料比较
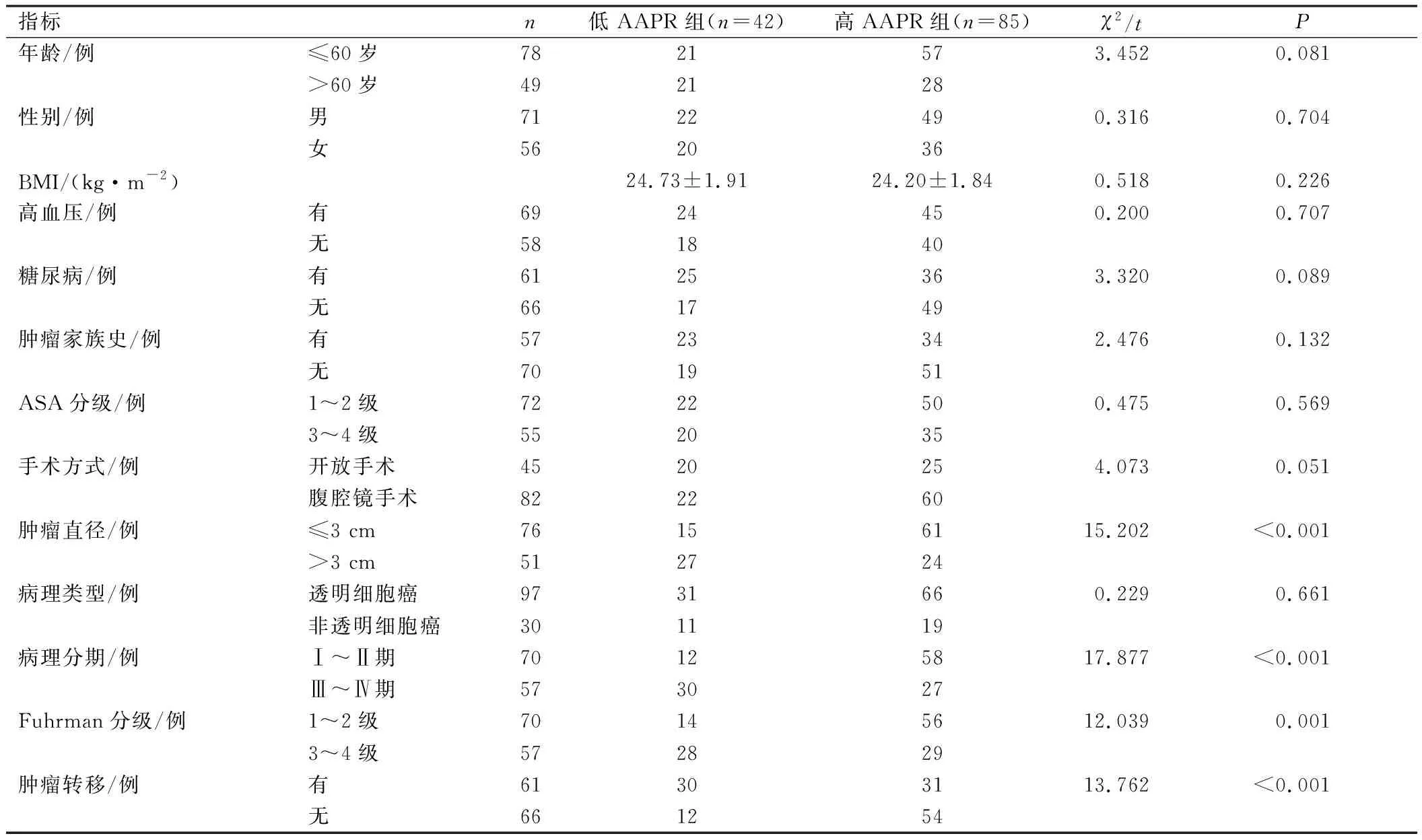
表4 不同AAPR组肾癌患者临床资料比较
2.5 不同组别肾癌患者的5年总生存率比较
Kaplan-Meier生存曲线结果显示,低PNI组患者5年总生存率为34.04%(16/47),低于高PNI组患者5年总生存率87.5%(70/80),差异有统计学意义(P<0.05);低AAPR组患者5年总生存率为35.71%(15/42),低于高AAPR组患者5年总生存率83.53%(71/85),差异有统计学意义(P<0.05),见图2。
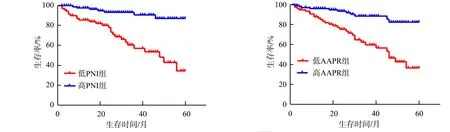
图2 不同PNI、AAPR组的肾癌患者5年总生存率比较
2.6 多因素Logistic回归分析结果
多因素Logistic回归分析结果显示,肿瘤直径>3 cm、病理分期为Ⅲ~Ⅳ期、Fuhrman分级为3~4级、肿瘤转移、术前PNI<41.25和术前AAPR<0.40是影响肾癌患者预后的独立危险因素(P<0.05),见表5。
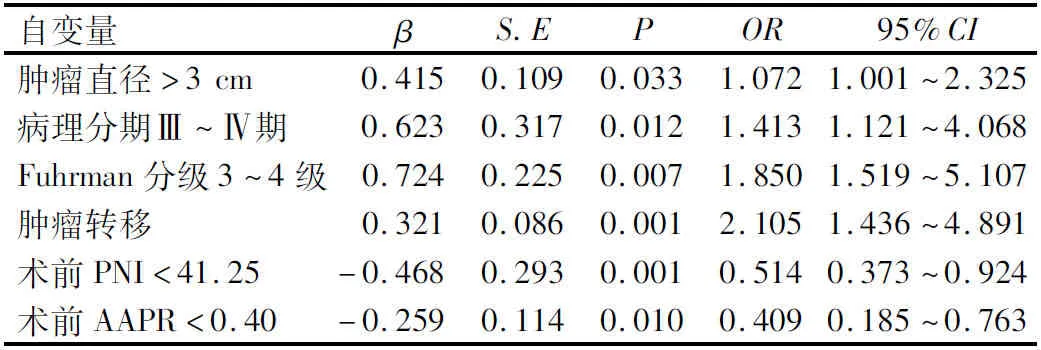
表5 影响肾癌患者不良预后的多因素Logistic回归分析
3 讨论
肾癌是一种起源于肾实质泌尿小管上皮系统的恶性肿瘤,其发病率较高,占肾恶性肿瘤的80%~90%[7]。肾癌患者起病隐匿,早期临床症状不明显,大部分患者就诊时已处于中晚期,治疗难度大,对患者生活质量造成极大影响。肾癌患者对放化疗不敏感,手术是其首选的治疗方法,但是近30%的患者术后会出现局部复发或远处转移,预后较差[8]。刘静红等[9]的研究显示,经手术切除癌组织后,约30%的肾透明细胞癌患者可出现癌转移甚至死亡,患者5年生存率较低。因此,术前寻找能预测肾癌患者预后的相关指标,对制定个体化的临床决策及降低患者病死率有重要意义。
机体自身的营养不良及免疫功能下降可促进肿瘤的发生发展,且会对患者治疗方案和生存预后产生一定影响。PNI是由血清白蛋白和淋巴细胞计数两项指标组成,是评估机体营养、免疫状态及手术风险的重要指标。研究证实,血清白蛋白降低与结肠癌[10]、肺癌[11]等多种恶性肿瘤患者的预后不良密切相关。淋巴细胞是反映机体免疫功能的重要参数,其可通过激活细胞毒性淋巴细胞增殖来遏制癌细胞的增殖与迁移,从而延缓肿瘤的进展、复发[5]。研究表明,与低淋巴细胞计数结直肠癌患者相比,高淋巴细胞计数患者的无进展生存期更长[12]。余亚英等[13]研究发现,术前PNI降低与胃癌患者预后不良有关,并可预测患者生存结局。本研究发现,肾癌患者的PNI明显低于健康志愿者,提示肾癌患者在肿瘤发生发展过程中存在营养过度消耗和免疫受损;预后不良组患者PNI明显低于预后良好组,提示术前PNI与肾癌患者预后状况密切相关,PNI越低,患者营养及免疫状况越差,预后越差,与既往研究结果[14]一致。
碱性磷酸酶是一种水解酶,主要分布于肝、骨骼、肾等组织中。研究发现,碱性磷酸酶参与机体肿瘤的发生发展及免疫微环境的塑造,并与多种恶性肿瘤的不良预后有关[15-17]。AAPR是根据血清白蛋白与血清碱性磷酸酶的比值计算得出,在一定程度上可反映患者全身炎症反应、免疫力及营养状态。研究发现,对于行根治性肾输尿管切除术的上尿路上皮癌患者,若术前AAPR降低,其5年生存率和无瘤生存率也较低[18]。本研究发现,肾癌患者的AAPR明显低于健康志愿者,预后不良组AAPR明显低于预后良好组,提示低AAPR的肾癌患者自身可能存在较严重的炎症反应、营养不良和免疫功能低下等情况,从而促进了肿瘤的发生发展;同时,由于肿瘤细胞侵袭性较强,患者术后出现肿瘤复发或死亡的风险较大[19]。
本研究结果显示,低PNI组患者5年总生存率低于高PNI组,低AAPR组患者5年总生存率低于高AAPR组,且多因素Logistic回归分析显示,术前PNI和AAPR降低是肾癌患者预后不良的独立危险因素,说明术前PNI、AAPR降低,患者自身的营养状况较差、免疫功能降低,术后可造成残留肿瘤细胞的再生、复制,进而导致肿瘤的复发,影响患者的生存预后,与既往报道[14,20-21]相似。本研究联合检测术前PNI、AAPR预测肾癌患者不良预后的AUC为0.907,提示术前联合检测PNI、AAPR对预测肾癌患者的预后有较高的价值。
综上所述,术前PNI、AAPR降低是肾癌患者预后不良的独立危险因素,术前联合检测PNI、AAPR对评估肾癌患者的临床预后有一定参考价值。

