促甲状腺激素受体抗体检测技术的研究进展
王海,李丽(东南大学附属中大医院检验科,南京210009)
自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)是一组器官特异性自身免疫性疾病,可引起甲状腺功能亢进或减退。临床上以弥漫性毒性甲状腺肿伴甲亢(Graves′disease,GD)和桥本甲状腺炎(Hashimoto′s thyroiditis,HT)为2种主要疾病类型。针对甲状腺来源抗原的自身抗体是区分AITD与其他甲状腺疾病最重要的生物标志物,如甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)以及促甲状腺激素受体(thyrotropin receptor,TSHR)自身抗体(TSHR autoantibodies,TRAb)等。特别是TRAb在自身免疫性甲状腺功能亢进和功能减退的疾病发展中发挥独特的作用,直接参与了GD和HT的病理生理过程。GD是甲状腺机能亢进的主要原因之一,影响约0.5%的普通人群,尤其是年轻女性。美国(2016)和欧洲(2018)甲状腺协会发布的《甲状腺功能亢进诊断和管理指南》以及中国(2019)《甲状腺功能亢进症基层诊疗指南》均推荐检测血清TRAb用于GD的诊断和鉴别诊断[1-2]。在许多病例中,由于没有甲状腺相关眼病和甲状腺功能变化等特征性临床表现,GD的病因诊断并不明确且不容易与其他能够导致甲状腺功能亢进的疾病进行区分。与甲状腺放射性核素扫描、超声等其他检查相比,TRAb的检测更具体、经济,显示了该抗体作为疾病可靠的生物标志物的临床效用和实用性[3]。本文主要介绍TRAb检测方法学的最新进展,并评价不同检测方法的优劣。
1 TSHR及TRAb非首次出现
TSHR是调节甲状腺生长和分化的主要开关,含有1个7-跨膜结构域的G蛋白偶联受体,存在于甲状腺细胞和其他多种细胞(纤维细胞、脂肪细胞和成骨细胞等)的质膜表面[4]。TSHR分子由α亚基(胞外结构域)和β亚基(跨膜锚定结构域和胞质结构域)组成,这2个亚基由同一个基因编码。由于其结构的复杂性,点突变或者自身抗体诱导的结构变化使TSHR表现出不稳定的分子完整性以及激活或抑制的生物功能特点[5]。在GD发生的自身免疫病理过程中,甲状腺细胞和其他组织细胞上的TSHR分子是机体自身抗原的主要来源。有研究发现TSHR分子中能够进入血循环的可溶性α亚基也是自身抗原的重要来源[6]。究竟是完整的TSHR分子还是游离的可溶性α亚基作为主要抗原诱导自身抗体的产生,目前仍没有定论。
TRAb是异质性抗体,在机体内表现为不均一性。根据其对TSHR作用的功能特性差异,可以将其分为促甲状腺激素受体刺激性抗体(thyrotropin receptor-stimulating antibody,TSAb)、促甲状腺激素受体阻断性抗体(thyrotropin receptor-blocking antibody,TBAb)以及中性抗体。TSAb与TSHR结合后能够产生与促甲状腺激素(thyroid-stimulating hormone,TSH)相同的功能效应,即激活环腺苷单磷酸(cyclic adenosine monophosphate,cAMP)信号转导通路,进而导致异常的甲状腺滤泡上皮细胞增生和甲状腺激素生成。而TBAb的生物作用与之相反并介导甲状腺功能减退。中性抗体与TSHR结合后既不激活也不阻断受体功能活性,有研究报道中性抗体结合TSHR后能激活MAPK/PI3K信号通路,诱导甲状腺细胞凋亡的发生[7]。目前认为TSAb对GD的诊断、预后以及疗效判断具有良好的临床效用,而TBAb在自身免疫性甲状腺功能减退症中的意义尚未得到充分的论证。需要注意的是,目前大部分临床实验室测定的都是患者血清中总TRAb的含量,而临床上一般亦将TRAb视为TSAb用于GD患者诊断。研究发现这2种抗体能够同时出现在同一个患者体内,并可能存在相互转换,这可能与GD患者的临床表现可以从甲状腺功能亢进转变为功能减退有关[8]。早期关于TSHR胞外结构域上TSAb和TBAb识别抗原表位的研究表明,TSAb主要识别的抗原表位在TSHR胞外结构域的N端8—165氨基酸残基,而TBAb主要识别的抗原表位在TSHR胞外结构域的C端270—395氨基酸残基[9]。事实上,TRAb并不是单一的抗体群,TSH、TSAb及TBAb识别的TSHR表位空间上相近且存在一定的重叠现象[10]。
TRAb的检测方法目前主要有免疫学方法和生物学方法。在过去的几十年里,随着单克隆抗体技术的发展以及检测方法的改良革新,TRAb的免疫学分析法已经广泛运用于临床,实现了自动化检测并具有很好的检测灵敏度和特异性。然而,不同于生物学方法能够很好地区分样本中TRAb的功能活性,TRAb免疫学分析法检测的是样本中TRAb与TSHR的结合总量,包括TSAb、TBAb以及中性抗体。2015年Frank等[11]利用桥联法建立了一种新的检测方法,能够只检测血清中TSAb。该方法已实现化学发光自动化检测,并于2019年在中国国家药品监督管理局(National Medical Products Administration,NMPA)注册使用。
2 TRAb测定的免疫学分析法
TSH和TRAb识别并结合相同的TSHR结构域是早期利用竞争抑制法检测TRAb含量的方法学前提。1974年,研究者首次利用I125标记的牛TSH与血清中TRAb竞争性结合从GD患者甲状腺组织中提取的甲状腺细胞膜TSHR来测定TRAb,由于患者样本中血清免疫球蛋白介导的非特异性干扰明显,该检测方法的诊断敏感性较低[12]。该方法测定的是患者血清TRAb对I125标记TSH与TSHR结合的抑制率,故也称为TSH结合抑制免疫球蛋白法(TSH binding inhibiting immunoglobulin assay,TBII法)。随着技术的革新与突破,TRAb的免疫学分析方法经过不断改良,其检测性能得到了很好的提升(见表1)。
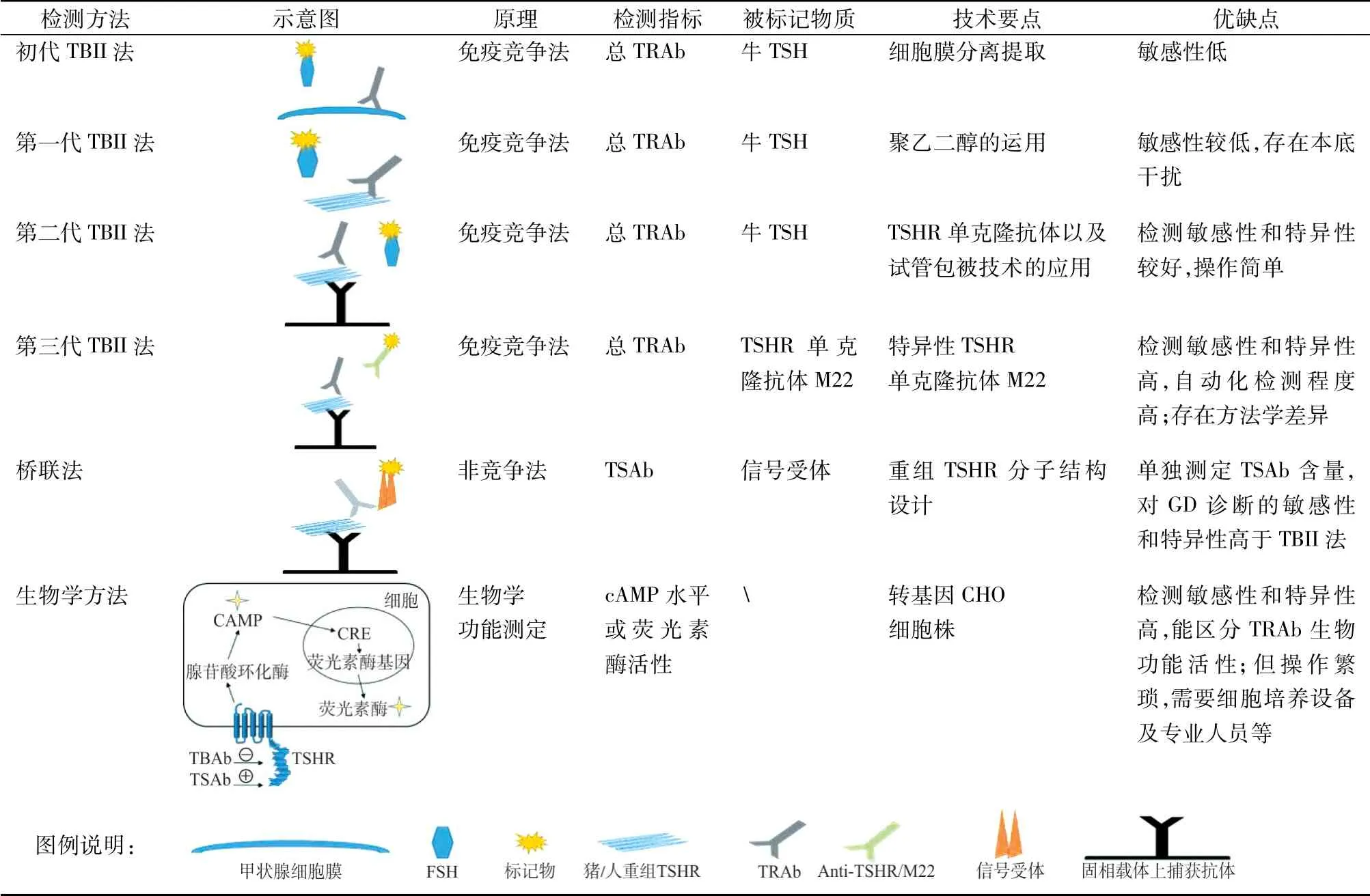
表1 TRAb测定的免疫学分析法和生物学方法
2.1 第一代TBII法 第一代TBII法是利用液相法检测TRAb,利用去垢剂(聚乙二醇,PEG)溶解的猪TSHR和I125标记的牛TSH开启了液相检测TRAb的时代。PEG能够有效沉淀分离TSHR-TSH复合物,将游离I125标记的牛TSH分离出来,因此能够较为准确地计算样本血清TRAb对TSH与TSHR结合的抑制活性。该方法中健康人血清及免疫球蛋白对TSH与TSHR的相互作用影响不大,而且可以直接使用血清样本,不需要单独分离浓缩样本中免疫球蛋白[13-14]。由于PEG能够将少量游离的I125标记的TSH沉淀下来,该方法的检测敏感性和特异性不高。TRAb具有种属特异性,后期利用人重组TSHR替代猪TSHR能够提高检测的敏感性和特异性[15]。
2.2 第二代TBII法 20世纪90年代末,TSHR单克隆抗体的出现以及固相包被技术的应用使得在不改变功能性TSHR构象的情况下将猪或人重组TSHR固定在固相载体上,经过样本添加-温育-洗涤-添加标记的TSH-洗涤-检测等多个步骤,通过检测同位素放射信号强度等来测定血清样本中TRAb对TSH和TSHR的结合抑制活性。基于此,新一代TRAb免疫分析方法被运用到临床实践中[16]。其他非同位素TRAb检测方法也逐渐被开发出来,如用吖啶酯替代I125标记TSH的化学发光检测方法以及基于过氧化物酶标记的ELISA法等[17]。与第一代TBII法比较,第二代TBII法操作得到简化,检测敏感性更高,并可实行大样本检测,为自动化检测奠定了基础。
2.3 第三代TBII法 第一代和第二代TBII法均采用标记的牛TSH作为示踪剂与患者血清中的TRAb竞争结合TSHR。2003年,研究者从GD患者的淋巴细胞中获得一种TSHR刺激性单克隆抗体M22[18],M22及其Fab片段与TSHR具有高度亲和力,能够替代牛TSH在TRAb检测中的作用,与患者血清中的TRAb竞争性结合固相载体上的TSHR。随后又分离出2种具有TSHR阻断活性的人单克隆自身抗体(K1-70和5C9)和另一种刺激性单克隆抗体K1-18[19]。基于M22的第三代TBII法同样不局限于放射性同位素法,还包括化学发光法、ELISA法等免疫分析方法[20-21]。Tozzoli等[22]分别采用第三代和第二代TBII法测定GD患者以及非GD患者血清中TRAb含量,发现基于M22的自动免疫分析显示了对GD的高诊断敏感性和特异性,比第二代TBII法更灵敏,且检测时间短。
需要注意的是,通过比较赛默飞BRAHMS TRAK Kryptor和罗氏cobas e601 2种TRAb免疫分析检测系统发现,对于同一样本,虽然两者之间得到的TRAb测定值具有良好的一致性,但当cobas e601检测的TRAb值>20 IU/L时,Kryptor检测系统得到的TRAb的测定值与之相比具有很大的偏移差异[23]。在一项比较第二代TBII法与2种第三代TBII法对GD的诊断性能评价研究中,尽管使用了相同的参考标准进行校准,在未治疗的GD患者中,3种方法测定的TRAb结果存在较大的差异[24]。此外,使用5种不同公司的第三代TRAb检测试剂盒检测同一份样本,得到的TRAb测定值之间同样存在一定差异[21]。这种差异可能源自于TRAb识别TSHR的不同表位以及与固相载体上抗原结合能力的差异。以上结果表明,在基于M22的第三代TBII法中不同检测系统得到的TRAb测定值有较大的方法学间差异,不同厂家的TBII检测系统具有不同的临床相关截断值。因此,临床上在解释TRAb结果的时候,需要关注所使用的检测方法和检测系统。
在判断新生儿甲状腺功能以及GD诊断中,用第三代TBII法分别测定肝素锂血浆和血清样本中的TRAb,结果间存在较大差异,且在肝素锂血浆中TRAb的测定值经常出现假阳性,这在甲状腺功能正常的母亲、活动性GD患者以及健康志愿者的婴儿中均存在,对于导致这种差异的原因尚不清楚。由于来自脐带血的肝素锂血浆广泛运用于分娩时的实验室检测,临床测定新生儿血液中TRAb时,尤其需要关注所检测的样本类型[25]。
竞争性抗TSHR自身抗体检测方法存在一个共同弊端,其检测的都是与TSHR结合的抗体总量,并不能区分TSAb、TBAb和中性抗体。因此,在临床上检测TRAb用于GD的诊断中,有可能因为存在TBAb而导致“假阳性”的结果。第三代TBII法的发展使临床TRAb检测灵敏度显著提高,并且实现了自动化检测,提高了工作效率,是目前使用最为广泛的检测技术。
2.4 甲状腺刺激性免疫球蛋白(thyroid stimulating immunoglobulin,TSI)检测系统 上述测定TRAb的竞争免疫分析方法不能区分TSAb和TBAb。2015年,Frank等建立了一种只检测患者血清TSAb的检测系统(Immulite TSI免疫分析系统)。该方法基于抗体的2个抗原结合位点在2个不同的重组TSHR分子之间形成桥梁,该重组TSHR去除了与TBAb结合的主要位点。在检测过程中,一条抗体臂与固定在微孔板上的捕获受体结合,捕获受体的密度使其间距只允许抗体分子的单臂与捕获受体相互作用,一旦抗体分子与捕获受体结合,一个嵌合分泌性碱性磷酸酶的信号受体将与抗体的另一单臂结合,检测信号强度取决于样本中TSAb的含量[11]。该方法对GD的诊断敏感性、特异性和诊断准确性分别达到99.8%、99.1%和0.998。一些评估桥联试验的研究表明,这种桥式免疫分析法在GD的诊断与鉴别诊断方面具有很高的临床敏感性[26-28]。Kim等[29]评估了西门子Immulite TSI免疫分析法与罗氏TRAb电化学发光法(第三代TBII法)对GD的诊断效能,2种方法分别得到的TSAb值和总TRAb值之间存在显著相关性,总符合率达93.0%,在13例结果不一致的患者中,TSI免疫分析系统得到的结果更符合患者的临床诊断。
值得注意的是,Frank等研究发现,3例临床表现和生化检测均提示为甲状腺功能减退的患者中,有1例患者血清用桥联法检测结果为阳性[11]。此外,一项评估桥联法和2种功能性生物学方法对患者血清TRAb的测定结果的研究表明,桥联免疫法和2种生物测定法对TRAb的检测均高度敏感[30]。在35例HT患者的血清标本中,使用桥联法和刺激性TRAb生物学方法分别检测出2例和5例阳性结果。此外,对于2例GD患者的血清样本,使用刺激性TRAb生物测定法检测结果为阴性时,而桥联法检测结果为阳性。考虑到TRAb的异质性,可能存在罕见的TBAb和TSAb均与TSHR的N端结合,或者桥联法不能完全区分刺激性和阻断性TSHR抗体。另外,鉴于生物测定法检测的是TSAb净活性,也不能排除TSAb生物测定法造成的假阴性结果的可能[30]。对于这种差异的结果解释存在一定的争议。一项中国的多中心研究比较了Immulite TSI免疫分析系统与Cobas e601竞争免疫分析系统测定的TSAb和TRAb对中国人群GD的临床诊断性能,两者在对GD诊断敏感性(100%vs 95%,P=0.799)和特异性(97.1%vs 97.6%,P=0.943)方面差异无统计学意义,但Immulite TSI免疫分析系统与生物学分析法的一致性高于Cobas e601竞争免疫分析系统[28]。此外,在韩国的一项研究中,Immulite TSI免疫分析系统与TRAb免疫竞争法检测TRAb对GD的诊断性能同样具有较好的一致性[31]。就目前的研究数据而言,Immulite TSI免疫分析系统与第三代TBII法在检测的灵敏度和特异性方面均具有很好的表现,鉴于前者能够单独测定TSAb,因此在GD诊断和病情判断中可能具有更优的临床价值,但还需要更多的临床研究来支持。
临床上甲状腺相关自身抗体检测目前主要有TgAb、TPOAb和TRAb 3项指标。血清中TgAb的存在会干扰Tg测定的结果,不同Tg检测方法会引起Tg检测结果的假性升高或降低,因此,血清TgAb的测定主要用于血清Tg测定的辅助检查。TgAb或TPOAb阳性一般提示甲状腺功能减退由自身免疫甲状腺炎所致[32]。此外,2019年中国《妊娠和产后甲状腺疾病诊治指南》推荐根据妊娠期患者血清TPOAb阳性与否选择不同的治疗方案[33]。TRAb是GD发生发展的病理生理基础,由于TRAb检测的灵敏度、特异性和稳定性得到显著提高,且对GD的诊断具有很好的敏感性和特异性,中国《甲状腺功能亢进症基层诊疗指南(2019)》将TRAb阳性列为GD的辅助诊断条件之一,并推荐临床检测TRAb以用于对GD患者病情活动的判断,评价抗甲状腺药物的停药时机以及预测疾病复发的风险[34]。由于TSI检测系统在国内尚未广泛开展且在临床应用中缺乏足够的临床研究数据,该指标尚未被纳入甲状腺相关疾病的诊疗指南中。
3 TRAb测定的生物学方法
虽然临床上广泛采用免疫学方法检测TRAb,但是只有生物学分析方法才能够区分功能性TSHR抗体的活性,且具备很好的敏感性和特异性,其不足之处在于生物学分析法需要有经验的实验室人员以及细胞培养等设备,操作繁琐、耗时,目前主要存在于一些专门实验室中。
自身抗体及对靶细胞TSHR直接作用的配体是TSHR自身反应性的主要激发因素。TRAb通过模拟TSHR的天然配体功能来影响细胞的代谢分泌,但并不破坏靶细胞。TRAb测定的生物学方法是基于体外细胞基础上的功能性测试,通过TRAb对TSHR-cAMP途径依赖的信号通路的活化或抑制效果来测定TRAb的含量和功能活性。最初关于TRAb的初步探索是在动物体内进行的。科研人员在GD患者体内发现一种长效甲状腺刺激素,后被鉴定为TSHR自身抗体[35-36]。在此基础上,McKENZIE通过向小鼠注射I131,然后利用甲状腺素抑制内源性TSH的产生,通过检测静脉注射TSH或试验物质后血液中I131的增加百分比来评估血液中试验物质的功能活性[37]。随着cAMP在受刺激的甲状腺细胞中的生物学作用的认知不断深入以及TSHR分子克隆技术的发展,第一代生物学分析法利用放射性cAMP终点法来检测样本中TRAb在甲状腺组织切片中诱导cAMP的积累,进而评估TRAb的活性水平[38]。由于大鼠甲状腺细胞系FRTL-5在低温冻存复苏后仍表现出良好的活性,且在GD患者的血清刺激下能够稳定产生cAMP,基于FRTL-5细胞的生物测定法逐渐兴起,随后也开发出其他细胞系如人甲状腺细胞、甲状腺杂交瘤细胞等[39]。基因修饰细胞技术的发展使功能完整且更稳定的野生型TSHR或嵌合TSHR的重组细胞系占据绝对优势,与FRTL-5等细胞相比,表达人重组TSHR细胞系具有易培养、周期短、受体数目多等优点,尤其是TSH或TRAb与嵌合人TSHR结合后,细胞内cAMP的水平显著提升,提高了检测的灵敏度[6],其中以重组中国仓鼠卵巢细胞株(Chinese Hamster Ovary,CHO)-TSHR细胞系使用最为广泛。虽然放射性同位素cAMP检测生物学方法在底物浓度较低的情况下具有较高的敏感性,但是处理同位素废弃物比较繁杂且对环境有害,该方法使用受限。
Himmler等[40]利用质粒构建了稳定的含荧光素酶报告基因的CHO细胞株,该报告基因受cAMP效应元件CRE的转录调控,细胞内cAMP水平能够影响细胞内荧光素酶转录表达。基于此研究发现,Watson及其同事构建了1株稳定转化荧光素酶报告基因的嵌合人TSHR的CHO细胞系,该细胞系在牛或人TSH刺激下显示出剂量依赖性的荧光素酶活性增加,基于该细胞的生物学检测结果与直接测定细胞内cAMP水平的生物学方法具有显著的相关性,并且在方法学上更简便、灵敏和快速[41]。这一研究首次用荧光素酶生物学方法测定TRAb。一系列在CHO细胞系上嵌合TSHR的结构活性的研究中,将野生型人TSHR的262-368氨基酸残基替换为黄体生成素受体的262-334氨基酸残基所获得的Mc4嵌合TSHR仅能识别刺激性TRAb,对阻断性TRAb没有反应,这种结构性改良显著提高了生物学方法对TSAb检测的敏感性和特异性[6]。目前经美国食品药品监督管理局(Food and Drug Administratia,FDA)批准的已商品化的Thyretain TSI试剂盒就是基于嵌合Mc4-TSHR的CHO细胞系[30]。需要注意的是,虽然阻断性抗体在Thyretain TSI检测中不产生效应,但阻断性抗体的存在有可能会干扰试验对刺激性抗体的测定[42]。
一些能够实时测量活细胞内cAMP水平的新的传感器不断被开发出来。Araki等[43]用含有人TSHR、环核苷酸门控钙通道和水母发光蛋白的表达载体转染CHO-K1细胞系,当TSAb激活TSHR时,细胞内cAMP水平升高将导致门控钙通道的激活,钙离子内流从而直接激活细胞内发光蛋白。该方法检测GD的阳性率为98.9%,在不灭菌条件下4 h内就可以完成实验。相比于其他生物学方法,极大地缩短了检测时间。此外,基于cAMP与带有荧光激活和淬灭基团的DNA结合蛋白结合的均相荧光分析方法被开发出来,并具有很好的检测性能[44]。
尽管TRAb生物学测定方法法具有比免疫学分析法更高的敏感性和特异性,但目前仍缺乏国际化标准,而且检测的是患者血清TRAb的净活性。当血清中同时含有TSAb和TBAb时,将造成检测结果的假性减低。
4 总结和展望
高敏感性和特异性的第三代TBII法是目前临床主要运用的TRAb检测方法。随着技术的发展,TRAb的检测技术和方法将得到进一步改良和提升,通过嵌合TSHR受体的结构研究或许能更灵敏、准确地检测和区分TSAb和TBAb。更简便、快速的生物学测定法可能将运用到日常临床工作中。基于桥联法特异性检测TSAb的方法学的成功应用,通过免疫分析方法分别检测样本中TSAb和TBAb亚型,这对临床GD的诊断和鉴别诊断、疾病活动监测和预后判断具有重要的临床意义。

