NOX4-siRNA 转染对AngⅡ诱导的心肌成纤维细胞增殖和胶原合成影响
何兆辉,王志谦,王国良,郑先杰,滕伟
(河南大学第一附属医院心血管内科,河南开封 475000)
心肌纤维化是心血管疾病终末期共同的生理病理过程[1]。心肌成纤维细胞(CFs)异常增殖和胶原蛋白合成增多是心肌纤维化的重要表现,研究影响CFs增殖和胶原蛋白合成的分子机制,寻找有效的干预靶点对心血管疾病的治疗具有重要意义。还原型烟酰胺腺嘌呤双核苷酸磷酸(NADPH)氧化酶非吞噬细胞氧化酶4(NOX4)是NADPH NOX 家族成员,在成纤维细胞、内皮细胞和平滑肌细胞等中广泛表达,与肺、肾、肝和心脏等多种组织纤维化过程密切相关[2-3]。本研究通过观察转染NOX4小干扰RNA(siRNA)对血管紧张素Ⅱ(AngⅡ)诱导的CFs增殖和胶原蛋白的影响,揭示NOX4在心肌纤维化过程中的作用机制。
1 材料与方法
1.1 实验材料
出生2 d雄性清洁级SD乳鼠(河南省实验动物中心)。AngⅡ(美国Sigma),胎牛血清和胰蛋白酶(美国Hyclone),青霉素-链霉素(青链霉)双抗和DMEM 培养基(美国Gibico公司),转染试剂LipofectineTM2000(美国Invitrogen公司),RIPA 裂解液和SDS-PAGE凝胶配制试剂盒(碧云天生物技术研究所),CCK-8试剂盒(日本同仁化学研究所),ECL化学发光剂和BCA 蛋白浓度测定试剂盒(索莱宝生物公司),CollagenⅠ、CollagenⅢ抗体(武汉博士德生物公司),GAPDH、p38MAPK、p-p38MAPK 和NOX4抗体(美国CST 公司),HRP 标记山羊抗鼠IgG(天津三箭生物公司)。CO2培养箱、酶标仪和凝胶成像分析系统(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 CFs分离与培养 无菌条件下取SD乳鼠的心肌组织并剪碎后,加入1.25 g/L 胰蛋白酶消化,收集上清液,加入含体积分数0.01青链霉双抗和体积分数0.10胎牛血清的DMEM 培养基,置于37℃含体积分数0.05 CO2培养箱中培养。根据CFs比心肌细胞贴壁速度快的特点采用差速贴壁法贴壁培养2 h。除去未贴壁的细胞,获得的贴壁的细胞多数为CFs,并采用波形蛋白免疫荧光法鉴定为CFs(纯度达98%)。培养达80%融合度时,胰蛋白酶消化并按1∶2传代,收集第3~5代对数生长期细胞进行实验。
1.2.2 实验分组与转染 本实验分为如下4 组。①对照组(A 组):正常培养;②AngⅡ组(B 组):加10-6mol/L AngⅡ刺激48 h;③AngⅡ+siNC组(C组):阴性对照NC-siRNA 转染CFs后加10-6mol/L AngⅡ刺激48 h;④AngⅡ+siNOX4组(D 组):采用NOX4干扰序列NOX4-siRNA 转染CFs后,加入10-6mol/L AngⅡ刺激48 h。每组设3个重复。将对数生长期的CFs以每孔106个接种至6孔细胞板上,置于37 ℃、含有体积分数0.05 CO2培养箱,培养至达70%融合时进行瞬时转染。其中,NOX4-siRNA 和NC-siRNA 由上海吉玛公司合成。NOX4-siRNA 和NC-siRNA 的RNA 序列见表1。参照转染试剂LipofectineTM2000说明书,根据实验分组将NC-siRNA 和NOX4-siRNA 转染至CFs中。转染5 h后更换新鲜培养液,继续培养48 h。

表1 NOX4-siRNA和NC-siRNA的RNA序列
1.2.3 NOX4蛋白表达的检测 采用免疫印迹法检测。收集AngⅡ刺激48 h的AngⅡ组、AngⅡ+siNC组、AngⅡ+siNOX4组和正常培养的对照组CFs,加入RIPA 裂解液抽提各组细胞总蛋白后,参照BCA 蛋白检测试剂盒说明书检测总蛋白的浓度。将热变性处理后的蛋白样品以每孔70μg上样至SDS-PAGE凝胶中进行电泳分离,待分离结束后转膜。使用50 g/L脱脂奶粉封闭处理2 h后,NOX4抗体(1∶500)、GAPDH 抗体(1∶1 000)4℃孵育过夜。次日,再以HRP 标记山羊抗鼠IgG 抗体(1∶2 000)室温孵育2 h。以ECL 在暗室内显影后,将GAPDH 作为内参照,采用凝胶成像系统扫描分析。实验重复3次。
1.2.4 细胞增殖活力检测 采用CCK-8法检测。将AngⅡ处理结束后的CFs和正常培养的对照组CFs以每孔104个接种至96孔细胞板,在37 ℃、含体积分数0.05 CO2培养箱中常规培养48 h后,参照CCK-8试剂盒说明书检测各组细胞在450 nm 波长处的光密度值。光密度值越大代表细胞增殖越活跃。实验重复3次。
1.2.5 Collagen Ⅰ、Collagen Ⅲ、p-p38MAPK 和p38MAPK 蛋白表达的检测 采用免疫印迹法检测。详细步骤可参照1.2.3。其中,在脱脂奶粉封闭后,分别采用Collagen Ⅰ抗体(1∶1 000)、CollagenⅢ抗体(1∶1 000)、p-p38MAPK 抗体(1∶800)和p38MAPK 抗体(1∶800)孵育。
1.3 统计学方法
采用SPSS 22.0软件进行统计学分析。计量资料数据以±s形式表示,多组间比较使用单因素方差分析,组间多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 转染NOX4-siRNA 对CFs中NOX4 蛋白表达的影响
免疫印迹法检测的结果表明,对照组、AngⅡ组、AngⅡ+siNC 组和AngⅡ+siNOX4组细胞中NOX4蛋白的表达水平分别为0.35±0.03、0.57±0.04、0.62±0.05和0.12±0.02,各组间NOX4蛋白的表达水平之间存在明显差异(F=349.556,P<0.001)。见图1。两两比较结果显示,与对照组相比,AngⅡ组细胞中NOX4蛋白表达水平明显升高(q=17.963,P<0.05);与AngⅡ组比较,AngⅡ+siNC组NOX4蛋白表达无明显改变(P>0.05),但AngⅡ+siNOX4组NOX4蛋白表达水平明显降低(q=36.742,P<0.05)。
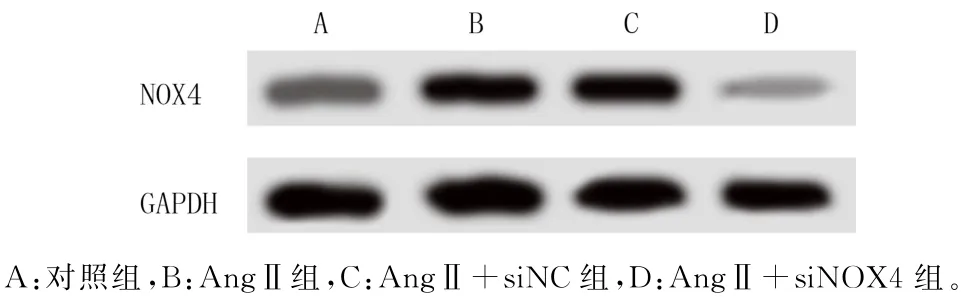
图1 免疫印迹法检测NOX4蛋白的表达
2.2 转染NOX4-siRNA 对CFs增殖的影响
CCK-8实验检测结果表明,对照组、AngⅡ组、AngⅡ+siNC组和AngⅡ+siNOX4组细胞增殖活力存在明显差异(F=140.134,P<0.001)。两两比较结果显示,与对照组相比,AngⅡ刺激明显促进了CFs增殖活力(q=25.587,P<0.05);与AngⅡ组相比,NOX4-siRNA 转染后CFs增殖活力明显降低(q=15.839,P<0.05),而转染NC-siNRA 对CFs增殖活力无明显影响(P>0.05)。见图2。
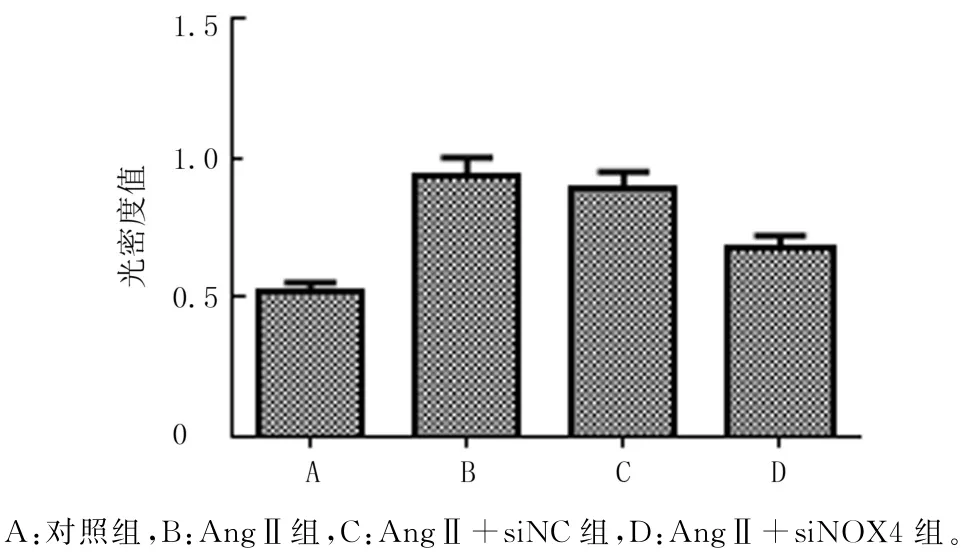
图2 转染NOX4-siRNA对CFs增殖的影响
2.3 转染NOX4-siRNA 对CFs胶原蛋白合成影响
免疫印迹法检测各组细胞中胶原蛋白CollagenⅠ和Collagen Ⅲ的表达结果表明,与对照组相比,AngⅡ刺激可引起CollagenⅠ和CollagenⅢ蛋白的表达水平升高(F=142.742、404.800,P<0.001)。与AngⅡ组相比,转染NC-siNRA 后CFs中CollagenⅠ和Collagen Ⅲ蛋白的表达无明显变化(P>0.05),但转染NOX4-siRNA 可使CFs中CollagenⅠ和Collagen Ⅲ蛋白的表达水平明显降低(q=17.242、27.727,P<0.05)。见图3和表2。
表2 各组细胞中CollagenⅠ和Collagen Ⅲ蛋白表达的比较(n=3,±s)
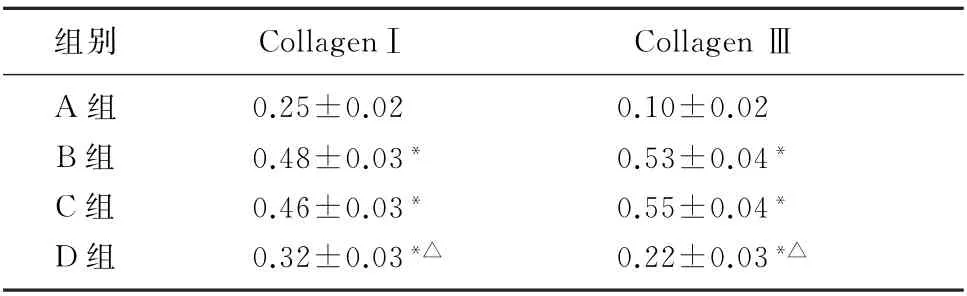
表2 各组细胞中CollagenⅠ和Collagen Ⅲ蛋白表达的比较(n=3,±s)
注:多组比较,F=142.742、404.800,P<0.001。与A 组相比,*q=10.733~15.087,P<0.05;与B组相比较,△q=17.242、27.727,P<0.05。
组别CollagenⅠ Collagen ⅢA 组0.25±0.02 0.10±0.02 B组0.48±0.03*0.53±0.04*C组0.46±0.03*0.55±0.04*D组0.32±0.03*△0.22±0.03*△
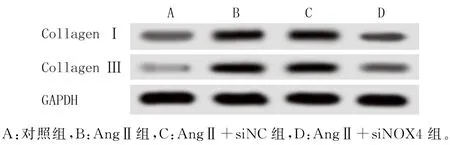
图3 免疫印迹法检测CollagenⅠ和CollagenⅢ蛋白的表达
2.4 转染NOX4-siRNA 对CFs中p38MAPK 信号通路相关蛋白表达的影响
免疫印迹法检测各组细胞中p38MAPK 信号通路相关蛋白p-p38MAPK 和p38MAPK 的表达结果显示,各组细胞中p38MAPK 蛋白的表达水平无明显差异,但AngⅡ刺激后CFs中p-p38MAPK 蛋白的表达水平较对照组明显升高(F=182.909,P<0.001);转染NOX4-siRNA 组p-p38MAPK 蛋白的表达水平明显降低(q=18.434,P<0.05),而转染NC-siRNA 组p-p38MAPK 蛋白的表达无明显变化(P>0.05)。见图4和表3。
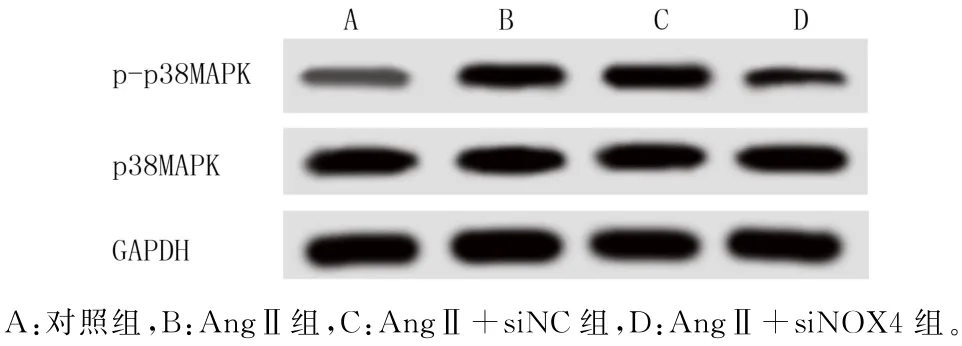
图4 免疫印迹法检测p38MAPK 信号通路相关蛋白的表达
表3 各组细胞中p38MAPK 信号通路相关蛋白表达的比较(n=3,±s)
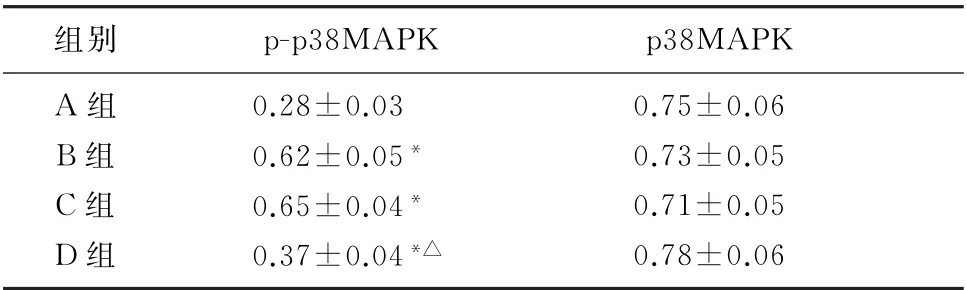
表3 各组细胞中p38MAPK 信号通路相关蛋白表达的比较(n=3,±s)
注:p-p38MAPK多组比较,F=182.909,P<0.001。与A组相比,*q=6.647~25.111,P<0.05;与B组相比,△q=18.434,P<0.05。
组别p-p38MAPK p38 MAPK A 组0.28±0.03 0.75±0.06 B组0.62±0.05*0.73±0.05 C组0.65±0.04*0.71±0.05 D组0.37±0.04*△0.78±0.06
3 讨 论
AngⅡ是经典的肾素-血管紧张素系统的重要活性成分,可刺激CFs增生和胶原蛋白的分泌等,在心肌的纤维化过程中发挥着重要作用,常被用来作为体外研究心肌纤维化的诱导因子[4-5]。本研究参照文献的方法[6]选用浓度为10-6mol/L AngⅡ刺激体外培养的CFs构建心肌纤维化细胞模型。结果显示,AngⅡ刺激后CFs增殖活力和胶原蛋白CollagenⅠ、Collagen Ⅲ表达水平均明显升高。这表明本研究中10-6mol/L AngⅡ可诱导CFs增殖和胶原蛋白合成,心肌纤维化细胞模型构建成功。
NOX4是一种与肝组织发生纤维化密切相关的NADPH 氧化酶,可以通过ROS信号通路在细胞的增殖、分化和凋亡等过程中发挥着重要作用;抑制NOX4信号通路可以减弱结核性胸膜纤维化[7-8]。NOX4在非小细胞肺癌细胞增殖过程中发挥着重要的促进作用,siRNA 抑制NOX4表达可通过PI3K/Akt信号传导抑制人神经母细胞瘤SH-SY5Y 细胞增殖[9]。此外,NOX4抑制剂可以逆转TGF-β1 诱导的肺癌细胞胶原蛋白CollagenⅠ的表达;靶向干扰NOX4可抑制TGF-β1诱导CFs胶原合成[10-11]。本研究结果显示,AngⅡ可诱导CFs中NOX4蛋白表达上调。这提示NOX4在AngⅡ诱导的CFs纤维化过程中发挥着重要作用。转染NOX4-siRNA后AngⅡ诱导CFs增殖和胶原蛋白CollagenⅠ、Collagen Ⅲ的表达明显受到抑制。这提示,NOX4在AngⅡ诱导的CFs增殖和胶原合成过程中发挥着重要的促进作用。
p38MAPK 信号通路是MAPK 通路的重要分支,可通过磷酸化作用影响相关基因的表达,在细胞增殖、分化和发育等过程中发挥重要作用[12]。研究显示,在AngⅡ诱导的CFs增殖和胶原合成过程中p38MAPK 信号通路发挥着重要的促进作用[13-14]。已有研究指出,沉默NOX4表达可抑制胰腺癌细胞中p38MAPK 信号通路活化[15]。为了探讨NOX4调控CFs增殖和胶原合成的分子机制,本研究进一步检测结果表明,转染NOX4-siRNA 后AngⅡ诱导p38MAPK 磷酸化水平明显降低,p38MAPK 信号通路的活化明显受到抑制。结果表明,在AngⅡ诱导的CFs中NOX4 可调控p38MAPK 信号通路。这提示NOX4介导的CFs增殖和胶原合成可能与p38MAPK 信号通路的活化有关。
综上所述,NOX4-siRNA 转染可抑制AngⅡ诱导的CFs增殖和胶原合成,其作用机制可能与抑制p38MAPK 信号通路活化有关。该研究结果进一步阐述了心肌成纤维化发生发展的分子机制,也为以NOX4为靶点预防和改善心肌纤维化提供了新的参考依据。然而,本研究未涉及体内实验探究NOX4对心肌成纤维化的影响尚显不足,后续研究将通过动物模型对此进行补充和探究。

