川芎素对大鼠肾脏缺血再灌注损伤的作用及其机制
蒋欣,曲青山,梁韶峰,房军,孙东
(郑州人民医院器官移植科,河南郑州 450000)
肾脏缺血再灌注损伤(I/R)是引起急性肾损伤(AKI)的主要病因[1]。AKI和肾I/R 均导致肾功能迅速下降[2-3],但目前缺乏预防或治疗AKI的有效策略[3]。肾I/R 发展过程涉及活性氧(ROS)的产生、促炎症反应和细胞死亡等[4-7],且导致肾小管上皮细胞的损伤[8-9]。细胞凋亡是肾脏I/R 中肾小管上皮细胞死亡的主要类型[10]。长期以来川芎一直被应用于心血管疾病的治疗,如卒中[11]和冠心病[12],特别是在我国、日本和韩国应用广泛[13]。已有研究结果表明,川芎素(LC)可以保护急性缺血性肾损伤[14],而鲜见其对缺血后再灌注肾损伤保护作用的研究。因此,本研究的目的是探讨LC 对大鼠肾I/R 的保护作用,并探讨Notch通路对大鼠肾脏I/R 中介导的炎症反应和细胞凋亡的作用及其可能机制,为LC作为治疗肾脏I/R 的新策略提供数据支持。现将结果报告如下。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 选择健康雄性、SPF级Sprague-Dawley(SD)大鼠60只,体质量211~248 g,购于我院实验动物中心,饲养于SPF 级动物实验室,动物自由饮食、饮水。本研究严格遵守《实验动物护理和使用指南》的执行原则。
1.1.2 主要试剂及药物 LC 购于中国河北安国神农中草药公司;兔抗大鼠的肿瘤坏死因子α(TNFα)(ab6671)、白细胞介素-6(IL-6)(ab208113)、半胱天冬酶3(Caspase3)(ab13847)、B细胞淋巴瘤/白血病相关X 的蛋白(BAX)(ab32503)、B细胞淋巴瘤/白血病-2(Bcl-2)(ab196495)、缺口蛋白1(Notch1)(ab52301)、锯齿状蛋白1(Jagged1)(ab233101)的第一抗体、辣根过氧化物酶(HRP)标记山羊抗兔第二抗体(ab6721)、甘油醛-3-磷酸脱氢酶(GAPDH,ab9485)等均购于美国Abcam 公司;SYBR Green qPCR Master Mix 试剂购于Med Chem Express公司;组织蛋白抽提试剂购自上海碧云天生物科技有限公司。血清肌酐(Scr)和尿素氮(BUN)试剂盒购于美国R&D Systems公司。
1.2 实验方法
1.2.1 实验分组 取雄性SD大鼠60只,适应性喂养1周后,随机分为假手术组(a组)、I/R 组(b组)、LC组(c组)和LC+Notch1 通路激活剂rh NF-κB组(LC+rh NF-κB组,d组),每组15只。
1.2.2 模型建立及标本采集 大鼠术前禁食8 h,不禁水,100 g/L水合氯醛(3.5 m L/kg)腹腔注射麻醉。常规固定、消毒、铺巾,腹正中切口,游离肾蒂,I/R 组以无创小血管夹同时夹闭双侧肾蒂50 min,之后松开血管夹,让血流再通。假手术组、LC 组、LC+rh NF-κB组大鼠手术方式与I/R 组相同,但假手术组不用血管夹阻断血流,而LC 组、LC+rh NFκB组在松开血管夹时予LC(10μmol/kg)腹腔注射,I/R 组与假手术组则以等量生理盐水注射液腹腔注射。各组分别于再灌注6、12、24、48 h共4个时点取血标本(腹主动脉穿刺),在48 h取肾脏组织标本。右肾用冰生理盐水冲洗后置液氮保存,行实时定量PCR(qRT-PCR)和蛋白免疫印迹(Western blot)检测;左肾用40 g/L 甲醛固定缓冲液固定,待制备石蜡切片。
1.2.3 酶联免疫吸附(ELISA)检测 将血清保存在-80 ℃冰箱,通过ELISA 试剂盒检测血清肌酐(Scr)和血尿素氮(BUN)水平。
1.2.4 苏木精-伊红(HE)和免疫组织化学染色 按照HE染色试剂盒说明将5μm 肾组织石蜡切片进行HE染色。使用常规免疫组织化学法(IHC)检测Notch1在肾脏组织表达,Notch1 抗体的稀释度为1∶100。使用GTVsionTMⅢ检测系统(GK5007,Gene Tech,中国)记录所有IHC图像。
1.2.5 qRT-PCR 检测 按照TianGen试剂盒说明书步骤提取大鼠肾组织总RNA,并按照TAKARA(RR047A)试剂盒说明进行反转录。参照SYBR Green Master Mix PCR 试剂盒说明进行qPCR 扩增,所用引物及其序列见表1。以人GAPDH基因作为内参照,采用2-ΔΔCT法计算IL-6和TNF-α的m RNA 相对表达量。

表1 qPCR 引物及其序列
1.2.6 Western blot检测 按照RIPA 裂解缓冲液试剂盒说明书提取肾脏组织的总蛋白,并使用BCA试剂盒检测浓度。蛋白经过SDS-PAGE 电泳和转膜操作后,分别孵育TNF-α(1∶600)、IL-6(1∶600)、Caspase3(1∶500)、Bax(1∶800)、Bcl-2(1∶400)、Notch1(1∶500)和Jagged1(1∶500)抗体和对应的二抗。蛋白条带显色后,用Image J软件分析比较目的条带/内参照(GAPDH)条带灰度值。
1.3 统计学处理
应用SPSS 20.0 统计软件对数据进行处理分析。其中计量资料数据采用±s的形式表示,两组均数的比较采用两独立样本比较的t检验;多组间的均数比较采用单因素方差分析,均数两两之间的比较采用Bonferroni法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 I/R 模型大鼠肾脏结构和功能变化
HE染色结果显示,假手术组大鼠肾脏结构无明显形态学改变;而与假手术组相比,I/R 组的肾组织结构出现严重破坏,包括肾小管扩张、肾上皮细胞扁平、刷状缘丧失和核染色丧失等(图1A)。另外,I/R 组大鼠血BUN 和Scr水平在12、24和48 h等3个时间点均明显高于假手术组,差异均有显著性(t=10.532~17.693,P均<0.05)。见图1B。
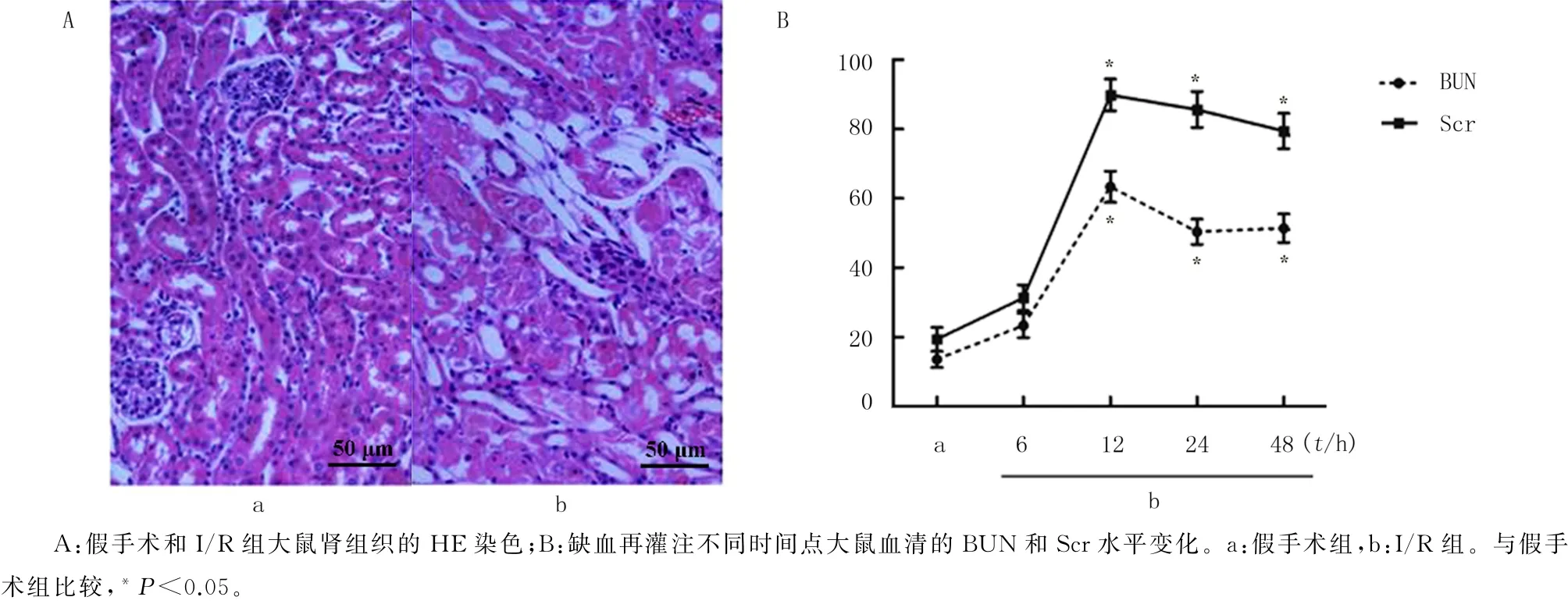
图1 I/R模型大鼠的肾损伤相关指标检测
2.2 LC 对I/R 大鼠肾组织结构和Notch1信号通路的影响
HE染色结果显示,与I/R 组相比,LC 组破坏的肾组织的结构有明显恢复;与I/R+LC 组相比,I/R+LC+rh NF-κB 组的肾组织结构破坏又加重。见图2A。肾组织中的Notch1和Jagged1表达检测结果显示,4组Notch1和Jagged1的均数差异有统计学意义(F=256.311、189.106,P均<0.05)。两两比较的结果显示,与假手术组相比较,I/R 组中Notch1和Jagged1 在肾组织中表达上调(P均<0.05);与I/R 组相比,LC 组Notch1和Jagged1的表达下调(P均<0.05);使用Notch1 信号激活剂rh NF-κB处理后与LC 组相比,LC+rh NF-κB 组的Notch1和Jagged1的表达明显恢复(P均<0.05),见图2B~E。另外,4组的BUN、Scr均数差异有统计学意义(F=182.060、183.772,P均<0.05)。两两比较结果显示,与I/R 组相比,在LC 组中BUN、Scr水平降低(P均<0.05);但是与LC 组相比较,LC+rh NF-κB组的BUN、Scr水平又增加,但并未超过I/R 组,差异均有统计学意义(P均<0.05)。见图2F。
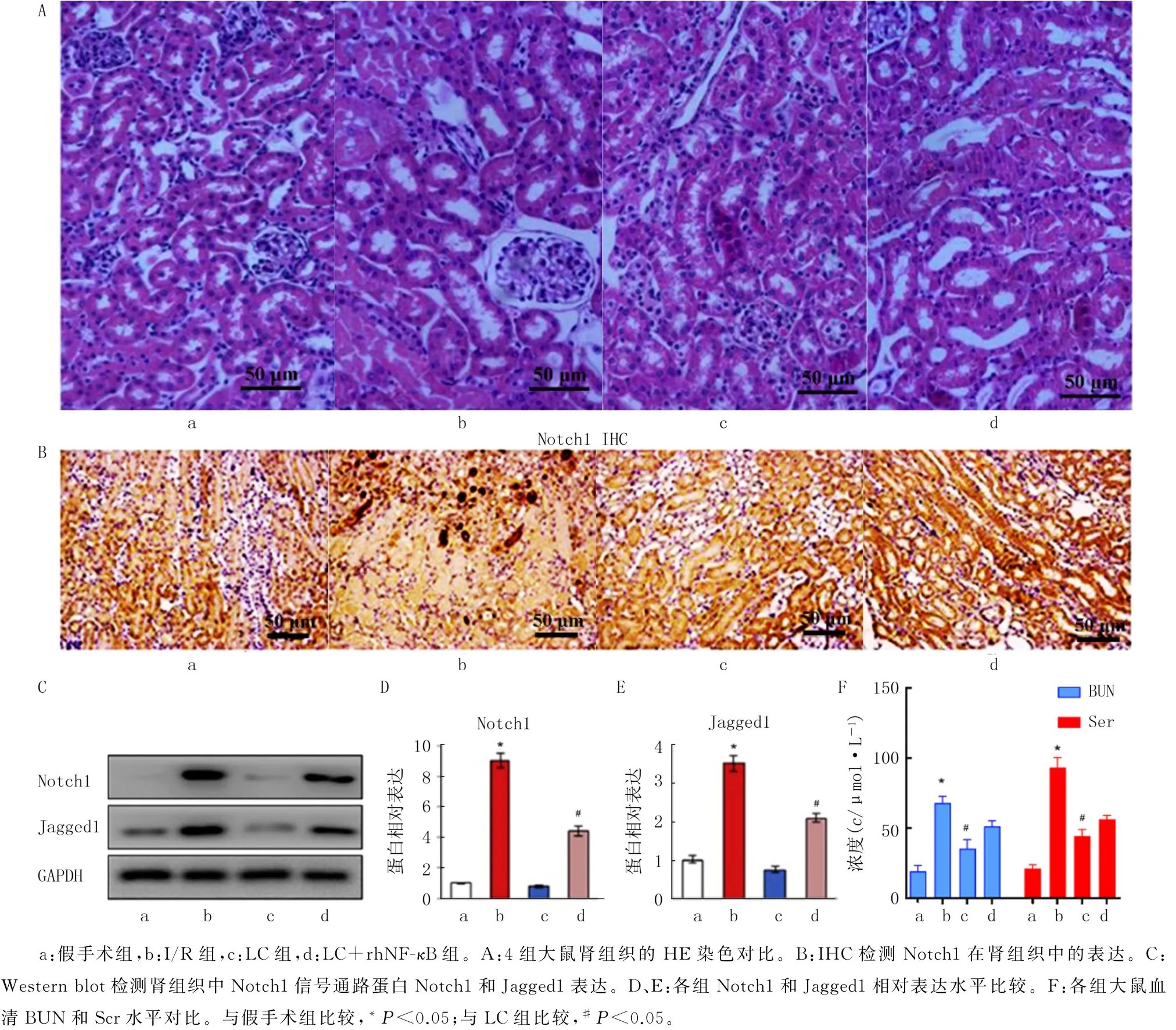
图2 LC对I/R模型大鼠肾组织结构和Notch1信号通路的影响
2.3 LC对I/R 大鼠肾脏炎症相关指标表达的影响
本文4组肾脏组织IL-6和TNF-α的mRNA表达差别有显著意义(F=203.012、214.310,P均<0.05)。两两比较结果显示,与假手术组相比,I/R组肾脏组织IL-6和TNF-α的m RNA 表达升高(P均<0.05);而与I/R 组相比,LC 组肾脏组织IL-6和TNF-α的m RNA 表达水平降低(P均<0.05);但是LC+rh NF-κB组IL-6和TNF-α的m RNA 表达部分恢复(P均<0.05)。见图3A、B。4组大鼠肾脏组织IL-6和TNF-α的蛋白表达水平差异有显著意义(F=113.412、128.204,P均<0.05)。两两比较结果显示,与假手术组相比,I/R 组肾脏组织IL-6和TNF-α的蛋白表达水平升高(P均<0.05);而与I/R 组相比,LC组肾脏组织IL-6和TNF-α的蛋白表达水平降低(P均<0.05);但是LC+rh NFκB组IL-6和TNF-α的蛋白表达水平部分恢复(P均<0.05)。见图3C~F。
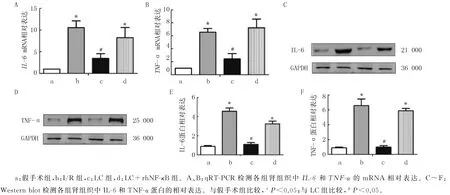
图3 各组肾组织中IL-6 和TNF-α 的mRNA和蛋白表达
2.4 LC对I/R 大鼠肾脏细胞凋亡相关标志物表达的影响
本文4组Caspase3和Bax/Bcl-2表达差别有统计学意义(F=156.205、143.337,P均<0.05)。两两比较结果显示,Caspase3和Bax/Bcl-2在I/R 组的表达均高于假手术组(P均<0.05),而二者在LC组的表达均低于I/R 组(P均<0.05),二者在LC+rh NF-κB组大鼠肾组织表达均高于LC 组(P均<0.05)。见图4A~C。
3 讨 论
AKI是一种潜在的致命疾病,病人死亡率高。肾脏I/R 是AKI的主要原因[15]。有研究显示,当肾动脉灌注压力处于10.64~23.94 k Pa范围时,肾血流将随着灌注压力的变化相应地变化。但是,当灌注压力低于10.64 k Pa时,肾血流量急剧降低,形成缺血并造成不可逆性损伤[16]。不幸的是,唯一合适的治疗方法是肾移植和肾透析。因此,迫切需要找到一种有效的药物来预防或者治疗I/R。LC 可能对AKI具有保护作用,但是否能够改善肾I/R 仍不明确。因此,我们分析了在体内LC 对肾I/R 大鼠的影响。结果表明,LC 可通过抑制Notch1 活化,抑制I/R 大鼠的肾组织损伤和炎症反应,从而发挥肾脏保护作用。
炎症反应增强是肾I/R 的另一个明显的特征,I/R 可以引发肾脏炎性细胞增多、促炎性因子(如TNF-α、IL-1β、IL-6等)的水平升高以及黏附分子增加,这些因子共同作用激发炎症的级联反应,放大局部炎症反应,甚至引起器官损伤[17]。本研究检测肾I/R 后肾组织中IL-6和TNF-α的m RNA 和蛋白表达水平,结果表明,无论在血清中还是在肾脏组织中炎症因子的表达水平都伴随着I/R 过程增加。已有相关研究同样观察到,大鼠肾I/R 后炎症因子表达增加[18]。
Notch1信号通路存在于多种动物体内,影响机体的发育和细胞分化、增殖、凋亡等,并参与多种疾病的发生和发展[19-20],与肾脏炎症级联反应增加具有密切关系[21]。本文的研究结果也表明,LC 能够改善I/R 肾功能和肾组织的形态变化,而这些保护作用可能通过调节Notch1 信号通路活化实现的。首先,Notch1信号通路蛋白Notch1和Jagged1 的表达水平在I/R 组中表达显著上调,而已有研究表明Notch1信号激活能够加剧I/R 的损伤[22]。本研究结果则显示,LC 腹腔注射能够明显抑制I/R 导致的Notch1和Jagged1的上调,当使用Notch1信号通路激活剂rh NF-κB时,LC的作用明显被削弱。其次,I/R 肾组织中IL-6和TNF-α的m RNA 和蛋白表达同样被LC所抑制,LC 的作用也可被rh NFκB部分逆转。表明LC也可能通过抑制Notch1信号减弱I/R 的炎性损伤。
由于雄性激素更容易使肾脏受到I/R 侵害,因此本研究采用雄性大鼠作为实验对象[23]。而本实验对肾I/R 大鼠的研究表明,I/R 增加了Scr和BUN 的水平,加重了肾组织学损伤。另外,I/R 增加了肾组织Caspase3 和Bax/Bcl-2 的表达,通过HE染色也观察到细胞体积缩小、细胞核固缩、碎裂等凋亡特征,这表明I/R 能够诱导更多肾组织细胞凋亡。LIU 等[24]观察到I/R 对大鼠肾脏的损伤特征与本研究结果一致。值得注意的是,LC 注射后I/R 组的肾脏组织形态具有明显的改善,与此同时I/R 组大鼠中血BUN 和Scr的高水平及肾组织中的凋亡标记物Caspase3和Bax/Bcl-2都被LC所抑制。已有研究结果表明,LC 对系膜细胞、神经元细胞中的Caspase3 和Bax/Bcl-2 水平具有同样的调节作用[25-26]。而且Notch1信号被敲低后可以抑制足细胞的Bcl-2依赖性凋亡[27]。而本研究反向验证中使用rh NF-κB激活Notch1信号通路后,LC对肾组织Caspase3 和Bax/Bcl-2 的抑制作用被减弱。以上研究结果表明,LC 通过抑制Notch1信号可能减弱I/R 肾组织的Caspase3 和Bax/Bcl-2 依赖的细胞凋亡。
综上所述,LC可通过抑制Notch1信号保护I/R 肾脏损伤。LC治疗后,肾组织中促炎性细胞因子(TNF-α和IL-6)和促凋亡蛋白(Caspase3 和Bax/Bcl-2)的表达下调。rh NF-κB 激活Notch1信号后,该保护作用减弱。但本研究仍存在大鼠样本量较少、动物模型较单一等缺点。因此,今后仍需加大动物样本量,或者以不同方法,或者以多种模式动物构建I/R 模型进一步验证LC 对肾脏I/R 的保护作用。本研究可为肾脏I/R 的保护提供新的治疗策略和研究靶点。但是LC的保护作用和机制仍需进一步在体外和体内进行研究。

