兰紫解毒颗粒的制备工艺优化及质量控制*
杨美娜,王世信,丁洪青,闫国强,李宝芬,刘爱朋
(河北省沧州中西医结合医院,河北 沧州 061001)
兰紫解毒糖浆为河北省沧州中西医结合医院院内制剂,属纯中药制剂,源自崔树德主编《中药大全》中的抗毒汤,经加减化裁而来,全方由板蓝根、大青叶、山豆根、茵陈、紫草、金银花6味中药组成[1]。方中板蓝根味苦性寒,清热解毒,为君药;大青叶、山豆根清热解毒,凉血利咽,辅助君药加强清热解毒之效,为臣药;茵陈清热利湿,紫草清热凉血解毒,二者共为佐药;金银花辛凉微苦,清热解毒,体轻可上达发散为使药,以上诸药配伍合用,共奏清热解毒之功效。兰紫解毒糖浆为我院治疗流感、乙型脑炎、病毒性肺炎、流行性腮腺炎、手足口病等病毒感染性疾病的首选药物,长期临床应用以来疗效确切,安全可靠,无不良反应,在儿童患者中应用尤为广泛[2-3]。然而,兰紫解毒糖浆剂在临床使用中存在不易保存,运输携带不方便等缺点,且缺乏全面的质量控制,基于此,我院拟对糖浆剂进行剂型优化,制成质量稳定,贮存、运输、携带方便的兰紫解毒颗粒剂。为更好地控制药品质量,确保制剂安全有效,稳定可控,本实验对兰紫解毒颗粒进行了制备工艺优化和质量标准研究,具体汇报如下。
1 仪器与试药
1.1 仪器LC-10AVPPlus岛津高效液相色谱仪,标配Shim-pack VP-ODS色谱柱(4.6 mm×250 mm,5 μm)(日本岛津公司);AG-135型电子分析天平(Mettler Toledo公司);KQ3200 DB型数控超声波清洗器(昆山市超声仪器有限公司);DZF-6050型真空干燥箱(上海博讯实业有限公司);AriumRcomfortⅡ超纯水系统(德国赛多利斯公司)。
1.2 试药处方中药材均购自安国市常兴药材有限公司,并经沧州市药检所鉴定为正品。(R,S)-告依春对照品(北京万佳首化生物科技有限公司,批号:SH-281353);绿原酸对照品(中国食品药品检定研究院,批号:110753-202018);可溶性淀粉、糊精(药用级,国药集团化学试剂有限公司);乳糖、木糖醇、甘露醇(药用级,江苏西典药用辅料有限公司);乙腈、磷酸(色谱纯,德国Merck公司),水为实验室自制超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 兰紫解毒颗粒处方组成板蓝根600 g,大青叶600 g,山豆根360 g,紫草600 g,茵陈360 g,金银花80 g。
2.2 原料药浸膏的制备参照原糖浆剂的提取工艺,取处方量药材加水煎煮两次,每次1 h,滤过,合并两次滤液,浓缩至相对密度为1.10(60℃)的清膏,加乙醇使含醇量达65%,静置24 h沉淀后取上清液,回收乙醇并浓缩至相对密度为1.32~1.33(60℃)的稠膏,备用。
2.3 兰紫解毒颗粒制备工艺优化
2.3.1 稀释剂的选择 采用湿法制粒,以制粒情况、成型率、吸湿率、溶化性及口味为考察指标,分别以淀粉、糊精、乳糖、木糖醇和甘露醇作为稀释剂,稠膏与稀释剂比为1∶1,90%乙醇为润湿剂,进行制粒,可见淀粉和甘露醇作为稀释剂制粒效果不佳,成型率和口味均较差;糊精、乳糖和木糖醇制粒效果均较佳,但考虑到部分人对乳糖的不耐受,故将其排除;糊精作为稀释剂制粒,成型率较高,但口感不佳,味苦;木糖醇成型率稍低,口味偏甜。综合考虑,最终选择糊精和木糖醇共同作为兰紫解毒颗粒的稀释剂。(见表1)
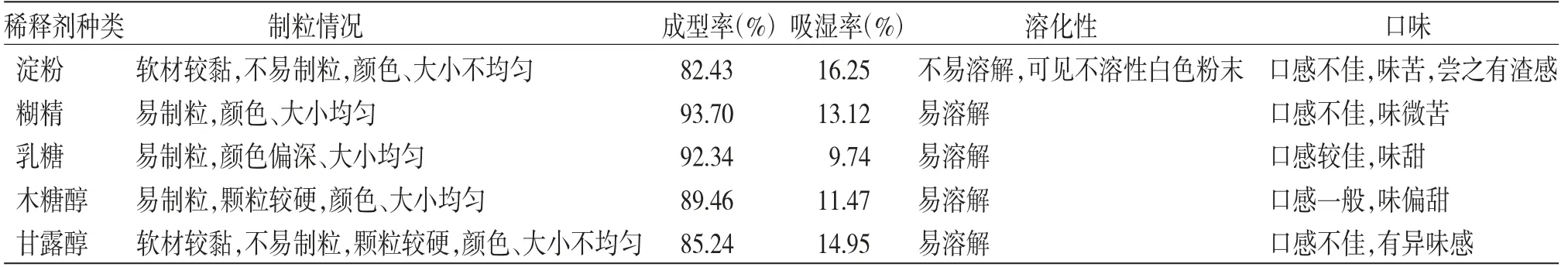
表1 稀释剂的选择
2.3.2 稀释剂配比的考察 以制粒情况、成型率、吸湿率、溶化性及口味为考察指标,对糊精和木糖醇的配比进行了考察,稠膏与稀释剂质量比为1∶1,90%乙醇为润湿剂,进行制粒,可见糊精和木糖醇质量配比为2∶1时,制粒效果最佳,成型率、吸湿率和口味均较好,故选择m(糊精)∶m(木糖醇)=2∶1为兰紫解毒颗粒的稀释剂。(见表2)

表2 糊精和木糖醇配比的考察
2.3.3 评价指标的选择
2.3.3.1 成型率[4]将制备好的颗粒称质量,依次通过1、5号筛,收集能过1号筛而不能过5号筛者,再次称质量,计算成型率。成型率(%)=过筛后颗粒质量/过筛前颗粒质量×100%。
2.3.3.2 吸湿率[4-5]将制备好的颗粒平铺于105℃干燥至恒重的称量瓶中,称定质量,将称量瓶(瓶盖打开)放置于相对湿度75%的容器内,于20℃恒温箱中放置48 h,再次称质量,计算吸湿率。吸湿率(%)=[(吸湿后颗粒质量-吸湿前颗粒质量)/吸湿前颗粒质量]×100%。
2.3.3.3 休止角[4,6]采用休止角测定仪测量休止角,评估颗粒流动性。将漏斗(锥度60°,出料口内径10 mm)固定于测定仪上,距离下方玻璃皿75 mm,将制备好的颗粒沿漏斗壁缓慢倒入漏斗中至玻璃皿中的颗粒装满为止,测量颗粒圆锥体的最大高度h和圆锥半径r,计算休止角(度),公式为tg α=h/r,α为休止角,测量3次,取平均值。
2.3.4 正交试验优化兰紫解毒颗粒最佳制备工艺 本研究采用湿法制粒,以正交试验设计对颗粒制备过程中影响较大的3个因素:药辅比、乙醇浓度和干燥温度进行考察[7-8],优化兰紫解毒颗粒的最佳制备工艺,每个因素设3个水平,具体见表3。

表3 正交试验因素水平表
取“2.2”项下制备的9份稠膏,参照L9(34)正交表试验设计条件进行制粒,以成型率(%)、吸湿率(%)、休止角(度)为考察指标,筛选出最佳制备工艺,3个指标的权重系数分别为0.4、0.3、0.3。正交试验结果见表4,方差分析结果见表5。

表4 正交试验结果表

表5 方差分析结果表
由表4~5结果可见,3个因素对颗粒制备效果的影响顺序为A>B>C,其中,药辅比(A)和乙醇浓度(B)2个因素对制备效果有显著影响(P<0.05),干燥温度(C)对制备效果无显著影响(P>0.05)。综合正交试验及方差分析结果,得出兰紫解毒颗粒的最佳制备工艺为A3B2C2,即稠膏与稀释剂比为1∶2,以95%乙醇为润湿剂制粒,湿颗粒干燥温度为60℃。
2.3.5 工艺验证 取“2.2”项下制备的3份稠膏,按照筛选出的最佳制备工艺条件进行3次平行工艺验证,结果见表6,可见制得的3批颗粒剂的成型率、吸湿率、休止角结果均较为稳定,RSD值均小于1.0%,提示本实验优选的兰紫解毒颗粒制备工艺稳定可行。
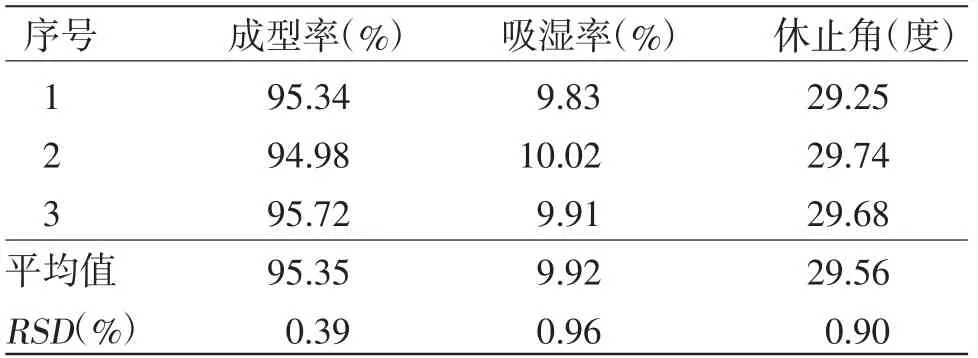
表6 验证实验结果
2.4 兰紫解毒颗粒的质量检查
2.4.1 外观性状检查 本品为干燥、大小形态均匀、色泽一致的颗粒剂,无吸潮、软化、结块等现象,符合《中华人民共和国药典》规定[9]。
2.4.2 粒度检查 本品不能通过一号筛和能通过四号筛的颗粒和粉末总和均低于8.0%,符合《中华人民共和国药典》规定[9]。
2.4.3 干燥失重检查 本品于105℃干燥至恒重,减失质量低于2.0%,符合《中华人民共和国药典》规定[9]。
2.4.4 溶化性检查 取本品10 g,加热水200 mL搅拌5 min,观察均全部溶化,符合《中华人民共和国药典》规定[9]。
2.4.5 兰紫解毒颗粒中(R,S)-告依春、绿原酸的含量测定
2.4.5.1 色谱条件 色谱柱:Shim-pack VP-ODS色谱柱(4.6mm×250 mm,5 μm);流动相:乙腈(A)-0.05%磷酸溶液(B),梯度洗脱[10-13],洗脱顺序见表7,(R,S)-告依春检测波长245 nm,绿原酸检测波长327 nm;柱温:30℃;流速:1.0 mL/min;进样量:10 μL。

表7 流动相梯度洗脱顺序
2.4.5.2 对照品溶液的制备 精密称取(R,S)-告依春、绿原酸对照品适量,置具塞量瓶中,加甲醇配制成每1 mL含(R,S)-告依春4.5 μg和绿原酸100.2 μg的混合对照品溶液,即得。
2.4.5.3 供试品溶液的制备 取本品适量,研细,过80目筛,取细粉约2 g,精密称定,置50 mL具塞量瓶中,精密加入60%甲醇至刻度,摇匀,超声处理30 min(500 W,40 kHz),放冷,用60%甲醇补至刻度,摇匀,过0.22μm微孔滤膜,取续滤液,即得。
2.4.5.4 阴性对照溶液的制备 将处方中去掉板蓝根、茵陈和金银花3味药,同兰紫解毒颗粒的制备工艺制成缺以上3味药的阴性样品,按照上述供试品溶液处理方法,制成缺板蓝根、茵陈和金银花的阴性对照溶液。
2.4.5.5 专属性考察 精密吸取上述混合对照品溶液、供试品溶液和阴性对照溶液各10 μL,如色谱条件进样检测,色谱图见图1。由图1可知,各对照品峰与前后组分峰均可达基线分离,理论板数按(R,S)-告依春和绿原酸峰计算均高于5 000,且阴性对照溶液色谱未见干扰峰。
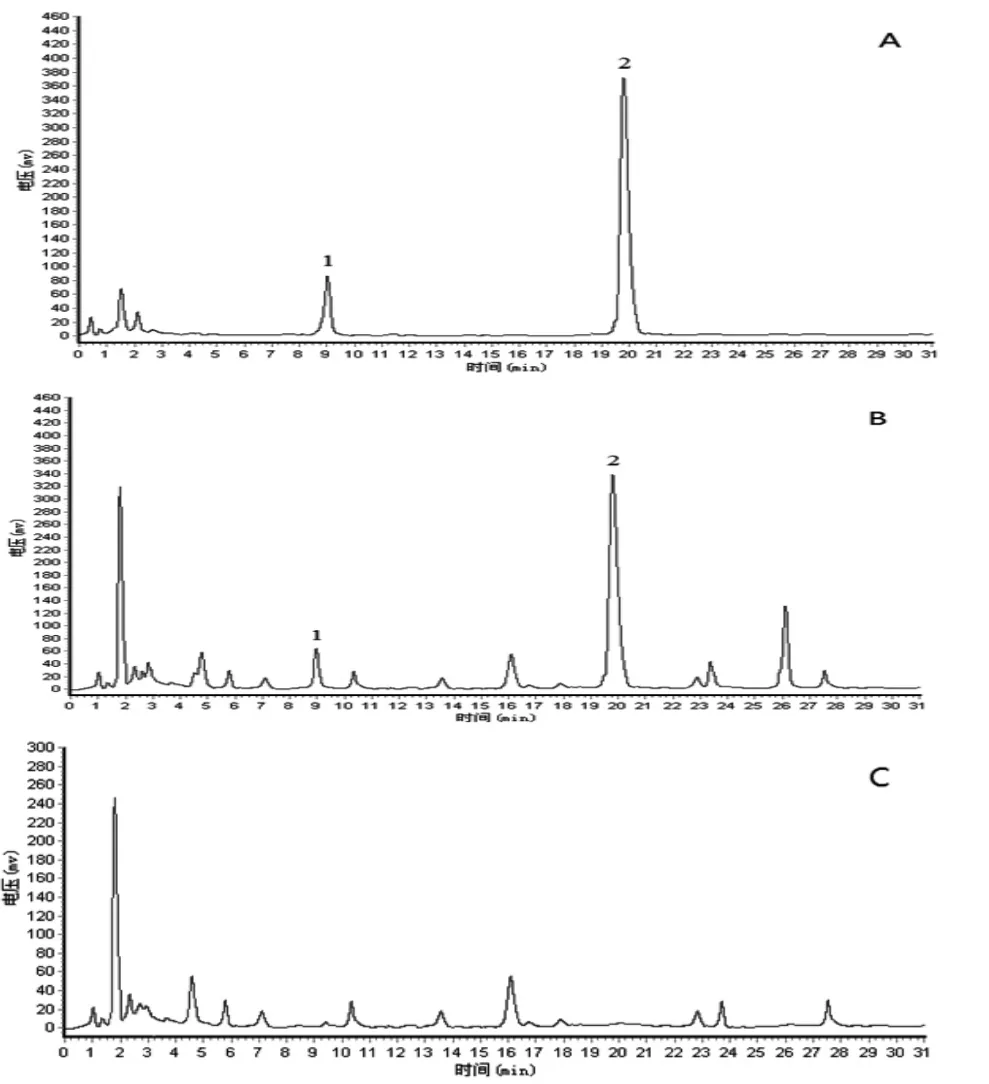
图1 HPLC色谱图
2.4.5.6 线性关系考察 精密吸取混合对照品溶液各1.0、2.0、3.0、4.0、5.0 mL,分别置于5 mL具塞量瓶中,加甲醇定容至刻度,摇匀,依次进样检测。以各对照品溶液的浓度为横坐标(x),峰面积为纵坐标(y),计算得(R,S)-告依春的回归方程为y=8 262.8x-152.19(R2=0.999 7),绿原酸的回归方程为y=7 412.2x-2 543.1(R2=0.999 8),表明(R,S)-告依春和绿原酸分别在0.90~4.50 μg/mL与20.04~100.20 μg/mL范围内与峰面积呈良好的线性关系。
2.4.5.7 精密度试验 精密吸取同一混合对照品溶液10 μL,重复进样检测6次,以峰面积计算得(R,S)-告依春、绿原酸的RSD值分别为0.58%和0.77%,表明本实验仪器的精密度良好。
2.4.5.8 稳定性试验 取同一新处理的供试品溶液,分别于室温下放置0、2、4、6、8、12、24 h后,依次进样检测,以峰面积代入回归方程,计算得(R,S)-告依春、绿原酸含量的RSD值分别为0.92%和1.14%,表明供试品溶液在24 h内稳定性良好。
2.4.5.9 重复性试验 取同一批兰紫解毒颗粒样品(批号:20200501)6份,按照上述供试品溶液处理方法,分别制得6份供试品溶液,依次进样分析,以峰面积计算得(R,S)-告依春、绿原酸的RSD值分别为0.82%和0.89%,表明本方法的重复性良好。
2.4.5.10 加样回收率试验 取同一批兰紫解毒颗粒样品(批号:20200501)6份,各取约0.5 g,精密称定,置于具塞量瓶中,依次精密加入(R,S)-告依春对照品(0.020 0 mg/mL)、绿原酸对照品(0.450 0 mg/mL)各1 mL,按照上述供试品溶液处理方法,分别制得6份加样供试品溶液,依次进样分析,以峰面积代入回归方程计算得样品中(R,S)-告依春和绿原酸的平均加样回收率分别为97.04%和97.87%,RSD值分别为0.88%和0.93%,表明本方法的加样回收率良好。(见表8)

表8 加样回收率实验结果
2.4.5.11 含量测定结果 取3批兰紫解毒颗粒样品,按照上述供试品溶液处理方法,制得3份供试品溶液,依次进样分析,以峰面积代入回归方程计算得样品中(R,S)-告依春和绿原酸的平均含量分别为0.038 3 mg/g和0.903 3 mg/g。(见表9)以每克样品中各成分含量的85%作为兰紫解毒颗粒含量测定的限度,则规定生产中本品每克含(R,S)-告依春和绿原酸计不得少于0.032 mg和0.768 mg。
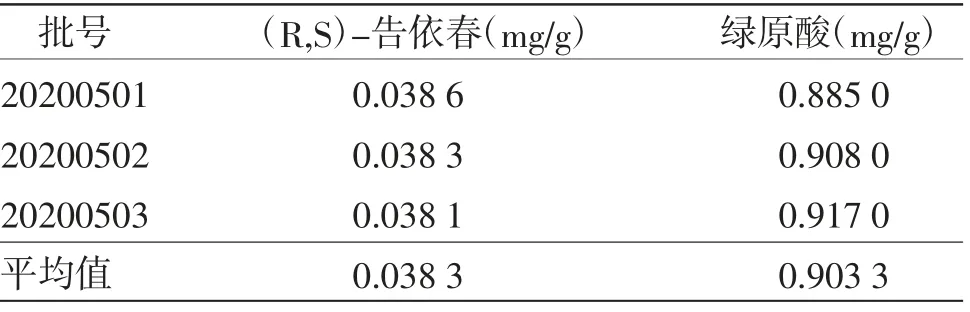
表9 样品含量测定结果
3 讨 论
本研究在兰紫解毒糖浆剂原有处方条件和提取工艺基础上,进行了剂型优化,采用传统湿法制粒,制备成兰紫解毒颗粒剂。首先通过单因素实验对稀释剂种类及配比进行了考察,分别考察了淀粉、糊精、乳糖、木糖醇和甘露醇几种不同稀释剂的制粒效果,其中,糊精、乳糖和淀粉是中药颗粒剂制备中最常选用的稀释剂品种,本研究在以糊精制粒时,颗粒的外观性状、成型率、溶化性均较佳,但由于糊精甜度较低,口感略苦;乳糖不具有吸湿性,且性质稳定,在本研究中制粒效果较佳,但考虑到该制剂在儿童中应用较多,部分儿童患者由于先天缺少乳糖酶,易发生乳糖不耐受,引起腹泻、胀痛、呕吐等不良反应[14-15],故将乳糖排除;在以淀粉制粒过程中,因制得软材较黏,不利于颗粒成型,且由于淀粉的冲溶性不良,所得颗粒表面色泽不均匀,颗粒溶化后可见白色粉末状物,故而排除淀粉。甘露醇、木糖醇均易溶于水,但在使用甘露醇制粒时,效果不太理想,颗粒成型率较低,颗粒偏硬,且尝之有异味感,而单以木糖醇制粒时,除口味偏甜,其他方面均较为理想,且木糖醇本身具有矫味功能,使用其为稀释剂既能够减少病人对糖分的摄入,又能同时掩盖中药的苦味。综合考虑,故选择以糊精和木糖醇共同作为兰紫解毒颗粒的稀释剂,在对二者配比的考察中,发现在m(糊精)∶m(木糖醇)为2∶1时,制粒效果及口味均为最佳。
制备颗粒剂时,润湿剂的选择也很重要。预实验发现,用乙醇制得的软材黏度适中,颗粒成型较好,故选择乙醇作为兰紫解毒颗粒的润湿剂。制粒后的干燥温度对颗粒中的有效成分含量和水分均有影响,温度过高可能会破坏药物中的不耐热成分,而温度过低会增加颗粒中的水分,不利于制剂的储存、运输[16]。本研究采用正交试验设计,对颗粒制备过程中影响较大的3个因素:药辅比、乙醇浓度和干燥温度进行了额外考察,以成型率、吸湿率、休止角为考察指标,优化兰紫解毒颗粒的最佳制备工艺。在对不同干燥温度进行预实验时,发现在以80~90℃进行干燥后,所得颗粒颜色较深,质地稍硬,而以50~70℃进行干燥后,颗粒质地、颜色均较佳,故选择以50~70℃作为干燥温度的考察范围。正交试验结果显示,在稠膏与稀释剂质量配比为1∶2,以95%乙醇为润湿剂,干燥温度60℃时,制备的颗粒效果最佳。
板蓝根是处方中的君药,功效清热解毒,主要药效成分为(R,S)-告依春;茵陈和金银花为佐使药,辅助君药清热解毒、凉血利湿,二者均以绿原酸为主要药效成分,且在药材中含量较高,并相对稳定,故在对兰紫解毒颗粒的质量标准研究中,本研究拟对处方中(R,S)-告依春和绿原酸同时进行含量测定,以控制药品的质量。研究参考《中华人民共和国药典》和文献中方法[10-13],分别考察了乙腈-0.1%甲酸水、乙腈-0.05%磷酸水、乙腈-0.1%磷酸水等不同流动相系统的洗脱效果,结果表明兰紫解毒颗粒以乙腈-0.05%磷酸水溶液为流动相时,各对照品峰型最佳,与前后组分峰分离度最好。由于(R,S)-告依春和绿原酸化学结构差异较大,最大吸收波长亦不同,故采用波长切换法,选用不用的波长进行检测,设定(R,S)-告依春、绿原酸检测波长分别为245 nm和327 nm,测得兰紫解毒颗粒样品中(R,S)-告依春和绿原酸的平均含量分别为0.038 3 mg/g和0.903 3 mg/g,可见该含量测定方法准确度高、专属性强、重现性好。以每克样品中各成分含量的85%为限度,则规定生产中本品每克含(R,S)-告依春和绿原酸计不得少于0.032 mg和0.768 mg。
4 结 论
本研究筛选出的兰紫解毒颗粒制备工艺稳定可行,建立的含量测定方法准确度高、专属性强、重现性好,能够作为兰紫解毒颗粒的质量控制标准。

