基于自噬途径探讨黄芪甲苷抑制糖尿病肾病系膜细胞NLRP3炎症小体活化通路及机制*
赵 静,张丽英,康红霞
(石家庄市第八医院,河北 石家庄 050000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病中后期的严重并发症,其致病机制较为复杂,氧化应激、炎症反应等均参与了DN的不同病理过程并发挥重要作用[1-2]。当前研究表明,高糖状态可引起氧化应激并激活核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体信号通路,促使IL-1β、IL-18等炎症因子成熟与分泌,活性氧(reactive oxygen species,ROS)与炎症因子等致病因子会增强机体的炎症反应,加重机体的微炎症状态,并推动肾脏损伤纤维化的进展[3-4]。自噬是细胞清除受损物质,避免出现凋亡、坏死,维持自身稳态的自我保护机制。线粒体自噬可以有效清除受损线粒体减少ROS的产生,从而减轻机体的氧化应激状态[5]。同时,自噬可以减轻机体过度免疫炎症反应,可能对NLRP3炎症小体信号通路起到一定的调节作用。当前,对于高糖条件下肾系膜细胞自噬及相关调节机制研究较少,临床上也未出现能够有效防治DN的特效药物。但近些年的中医学研究指出,DN病机在于机体阴阳失和,需治以补气生血化瘀之法[6]。黄芪是临床中常用的补中益气类中药,其可升阳举陷、排毒消痈,常用于糖尿病、尿蛋白等病症的治疗。黄芪甲苷是黄芪的活性提取物,现代药理研究表明,其具有较好的抗炎作用,可纠正细胞炎症状态,改善免疫功能紊乱[7]。有研究发现,黄芪甲苷可以减轻细胞氧化应激状态,从而延缓DN病情进展[8],我们猜想这与黄芪甲苷上调线粒体自噬水平,改善机体微炎症状态有关。本次研究基于自噬途径探讨了黄芪甲苷对高糖刺激的小鼠肾小球系膜细胞NLRP3炎症小体活化通路的影响,旨在为DN的治疗实验依据。
1 材 料
1.1实验细胞 小鼠肾小球系膜细胞株SV40 MES13购自American Type Culture Collection。
1.2 药物与试剂黄芪甲苷(成都德恩特生物,批号:10083-24-6);低糖DMEM培养基(美国Hyclone,批号:66754);胎牛血清FBS(美国Gibco Life Technologies,批号:101917171027);0.25%胰蛋白酶消化液(碧云天生物技术研究所,批号:P0013B);ROS活性氧检测试剂盒(碧云天生物技术研究所,批号:091217180110);CCK-8细胞增殖毒性检测试剂盒(日本Dojindo,批号:BS3701);Western blotting一抗稀释液(碧云天生物技术研究所,批号:101617171102)。
1.3 主要仪器DYY-6C型凝胶电泳仪、Chem Doc XRS型凝胶成像分析系统(美国Bio-Rad Laboratories);Spectra Max 190型荧光酶标仪(美国BioTek Instruments)。
2 方 法
2.1 细胞培养将小鼠SV40细胞从液氮罐内取出并于37℃恒温水浴箱中解冻,持续摇动冷冻管确保细胞在2 min内完全融化。采用医用酒精对冷冻管表面消毒,在超净工作台内将细胞悬浮液转移至离心管,700 r/min离心5 min。弃上清加入5 mL培养基,使用移液枪充分吹打后转移至培养瓶,放入37℃5%CO2恒温培养箱中培养。
2.2 小鼠SV40细胞分组将小鼠SV40细胞分为5组,分别在含有0、10、20、40、80 μmol/L黄芪甲苷的DMEM培养基中体外培养48 h,采用CCK-8试剂盒检测各组细胞活力,筛选出适宜的黄芪甲苷浓度进行后续实验。根据CCK-8检测结果,本实验选取10、20、40 μmol/L黄芪甲苷作为低、中、高剂量。
2.3 高糖刺激小鼠SV40细胞复苏后制备成细胞悬液接种于35 mm2培养基,放入37℃5%CO2恒温培养箱中培养。细胞长至70%~80%汇合时换不含胎牛血清的DMEM培养基继续培养24 h至90%汇合。将细胞在含胎牛血清的DMEM培养基内培养并分为5组,即正常对照组(葡萄糖5.6 mmol/L)、高糖组(葡萄糖30 mmol/L)、黄芪甲苷低剂量组(葡萄糖30 mmol/L+黄芪甲苷10 μmol/L)、黄芪甲苷中剂量组(葡萄糖30 mmol/L+黄芪甲苷20 μmol/L)、黄芪甲苷高剂量组(葡萄糖30 mmol/L+黄芪甲苷40 μmol/L),以上各组均培养24 h。
2.4 细胞增殖毒性检测采用移液枪取100 μL细胞悬液加入96孔板中,37℃5%CO2恒温培养箱预培养24 h。培养皿内加入不同浓度黄芪甲苷,37℃5%CO2恒温培养箱培养48 h。更换培养基,孔内加入10 μL CCK-8溶液37℃5%CO2恒温培养箱继续培养2 h,酶标仪检测450 nm处样品OD值。Ap:含细胞培养基+CCK-8溶液+黄芪甲苷;Ac:含细胞培养基+CCK-8溶液;A0:空白孔。细胞活力(%)=[(Ap-A0)/(Ac-A0)]×100%。
2.5 TUNEL细胞凋亡检测收集小鼠SV40细胞并用PBS溶液漂洗1次,室温条件下4%多聚甲醛浸泡30 min后,用PBS溶液漂洗2次。室温条件下在含0.1%Triton X-100的PBS溶液中孵育5 min后,漂洗3次,加入50 μL TUNEL混合溶液,37℃避光孵育1 h。PBS漂洗3次,荧光显微镜下镜检。
2.6 炎症因子水平检测收集小鼠SV40细胞离心取上清液,按比例稀释样品之后加入相应孔内,盖上封口膜室温孵育2 h。板洗净5次,用吸水纸干燥。孔内加入100 μL辣根过氧化物标记链霉亲和素,封闭后室温避光孵育20 min。板洗净5次,用吸水纸干燥。孔内加入100 μL TMB显色溶液,封闭后室温避光孵育20 min。孔内加入50 μL终止液,酶标仪检测450 nm处样品OD值,计算IL-1β、IL-18、TNF-α、TNF-β1水平。
2.7 ROS水平检测按照1:1 000比例采用无血清培养基稀释DCFH-DA,配制10 μmol/L DCFH-DA。收集小鼠SV40细胞,离心弃上清,加入配制好的DCFH-DA,采用移液枪反复吹打确保细胞悬浮。细胞培养箱内37℃条件下孵育20 min,每3 min混匀一次,确保细胞与DCFH-DA完全接触。细胞采用无血清培养基漂洗3次,采用PBS溶液制备细胞悬浮液,使用流式细胞仪检测样品525 nm波长荧光强度。
2.8 细胞自噬形态观察透射电镜下观察小鼠SV40细胞自噬形态,并计算同等放大倍数下各组细胞自噬体数量。
2.9 蛋白免疫印迹(Western blotting)法检测LC3、Beclin-1、NLRP3、Caspase-1蛋白表达量收集小鼠SV40细胞,采用预冷PBS溶液漂洗3次后弃废液,加入适量RIPA裂解液充分研磨后转入EP管内冰上静置5 min。超声破碎仪破碎后离心,移液枪回收上清液。样本液中加入上样缓冲液,采用高速震荡器混匀,之后100℃水浴变性10 min,标记好保存于-20℃冰箱内备用。之后经SDS-PAGE电泳与湿转法转膜,封闭后经一抗、二抗孵育,化学发光显影后采用图像处理软件进行分析。
2.10 统计学方法采用SPSS 21.0统计软件进行数据分析,计量资料以(±s)表示,数据进行方差齐性检验,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
3 结 果
3.1 不同浓度黄芪甲苷培养小鼠SV40细胞活力检测CCK-8检测结果表明,10~40 μmol/L黄芪甲苷培养小鼠SV40细胞未表现出明显细胞毒性,对小鼠SV40细胞活力无明显影响。采用80 μmol/L黄芪甲苷培养小鼠SV40细胞其细胞活力较0 μmol/L黄芪甲苷培养时明显下降(P<0.05),提示80 μmol/L黄芪甲苷培养对小鼠SV40细胞具有明显的毒性作用。故本次研究选取10、20、40 μmol/L分别作为黄芪甲苷低、中、高剂量。(见图1)

图1 各组小鼠SV40细胞活力比较(±s,n=6)
3.2 各组小鼠SV40细胞凋亡及细胞活力比较与正常对照组比较,高糖刺激下小鼠SV40细胞凋亡率明显升高(P<0.01),细胞活力明显下降(P<0.01),提示高糖刺激可抑制细胞活力并诱导细胞凋亡。与高糖组比较,黄芪甲苷低、中、高剂量组小鼠SV40细胞凋亡率均下降,细胞活力均提升,且黄芪甲苷中、高剂量组小鼠SV40细胞凋亡率和细胞活力与高糖组比较,差异均有统计学意义(P<0.05或P<0.01)。(见图2~4)

图2 各组小鼠SV40细胞凋亡情况(TUNEL法,×200)
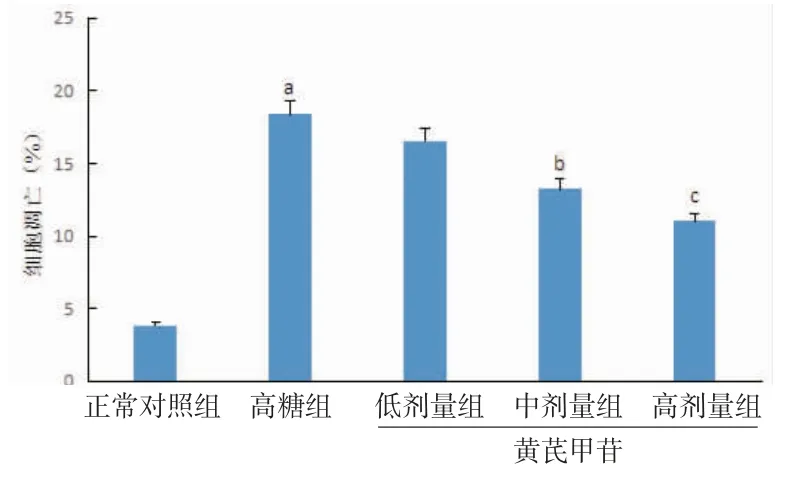
图3 各组小鼠SV40细胞凋亡率比较(±s,n=6)

图4 各组小鼠SV40细胞活力比较(±s,n=6)
3.3 各组小鼠SV40细胞炎症因子水平比较与正常对照组比较,高糖组小鼠SV40细胞IL-1β、IL-18、TNF-α、TGF-β1水平均明显升高(P<0.01),提示高糖刺激下可诱导多种炎症因子成熟、分泌,加重细胞的微炎症状态。与高糖组比较,黄芪甲苷低、中、高剂量组小鼠SV40细胞炎症因子水平均降低,且黄芪甲苷中、高剂量组小鼠SV40细胞IL-1β、IL-18、TNF-α、TGF-β1水平均低于高糖组(P<0.05或P<0.01)。(见图5)
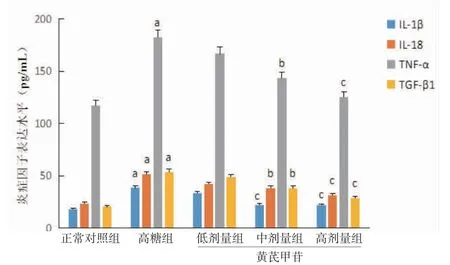
图5 各组小鼠SV40细胞炎症因子水平比较(±s,n=6)
3.4 各组小鼠SV40细胞ROS水平比较与正常对照组比较,高糖组小鼠SV40细胞ROS水平明显升高(P<0.05),提示高糖刺激可诱导细胞产生ROS。与高糖组比较,黄芪甲苷低、中、高剂量组小鼠SV40细胞ROS水平均降低,且黄芪甲苷中、高剂量组小鼠SV40细胞ROS水平均低于高糖组(P<0.05)。(见图6)
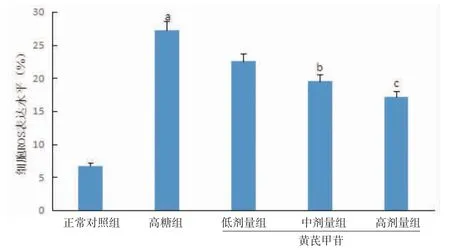
图6 各组小鼠SV40细胞ROS水平比较(±s,n=6)
3.5 系膜细胞自噬形态与正常对照组比较,高糖组系膜细胞自噬体明显减少,肾间质出现纤维化。与高糖组比较,黄芪甲苷低、中、高剂量组系膜细胞自噬体均增多,说明黄芪甲苷上调了线粒体自噬,对小鼠SV40细胞起到保护作用,随着黄芪甲苷剂量的增加,自噬体的数目随之增多。(见图7)
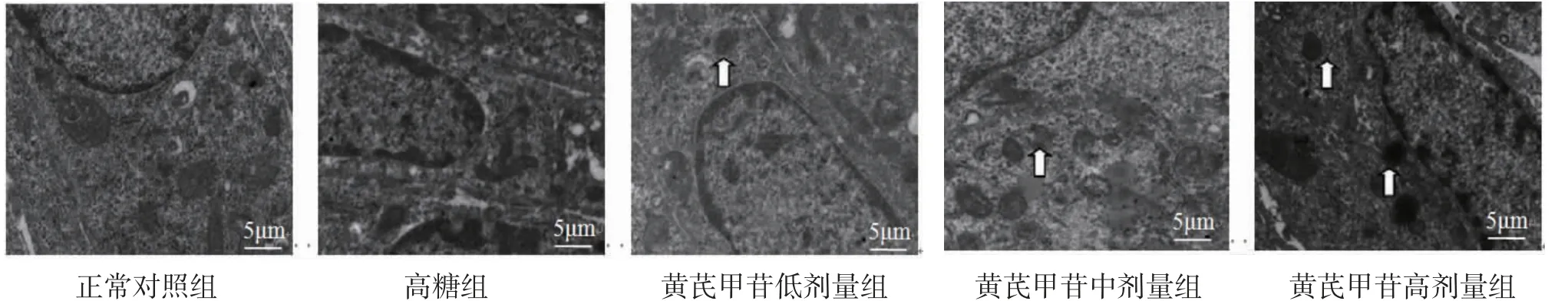
图7 透射电镜观察系膜细胞自噬形态
3.6 各组小鼠SV40细胞自噬相关蛋白LC3、Beclin1水平比较与正常对照组比较,高糖组小鼠SV40细胞自噬相关蛋白LC3、Beclin-1表达水平均明显下调(P<0.01),提示高糖刺激下细胞自噬受到明显抑制。与高糖组比较,黄芪甲苷低、中、高剂量组小鼠SV40细胞自噬相关蛋白LC3、Beclin-1表达水平均上调,且黄芪甲苷中、高剂量组小鼠SV40细胞自噬相关蛋白LC3、Beclin1表达水平高于高糖组(P<0.05或P<0.01),提示黄芪甲苷可在一定程度上提升线粒体自噬水平。(见图8)
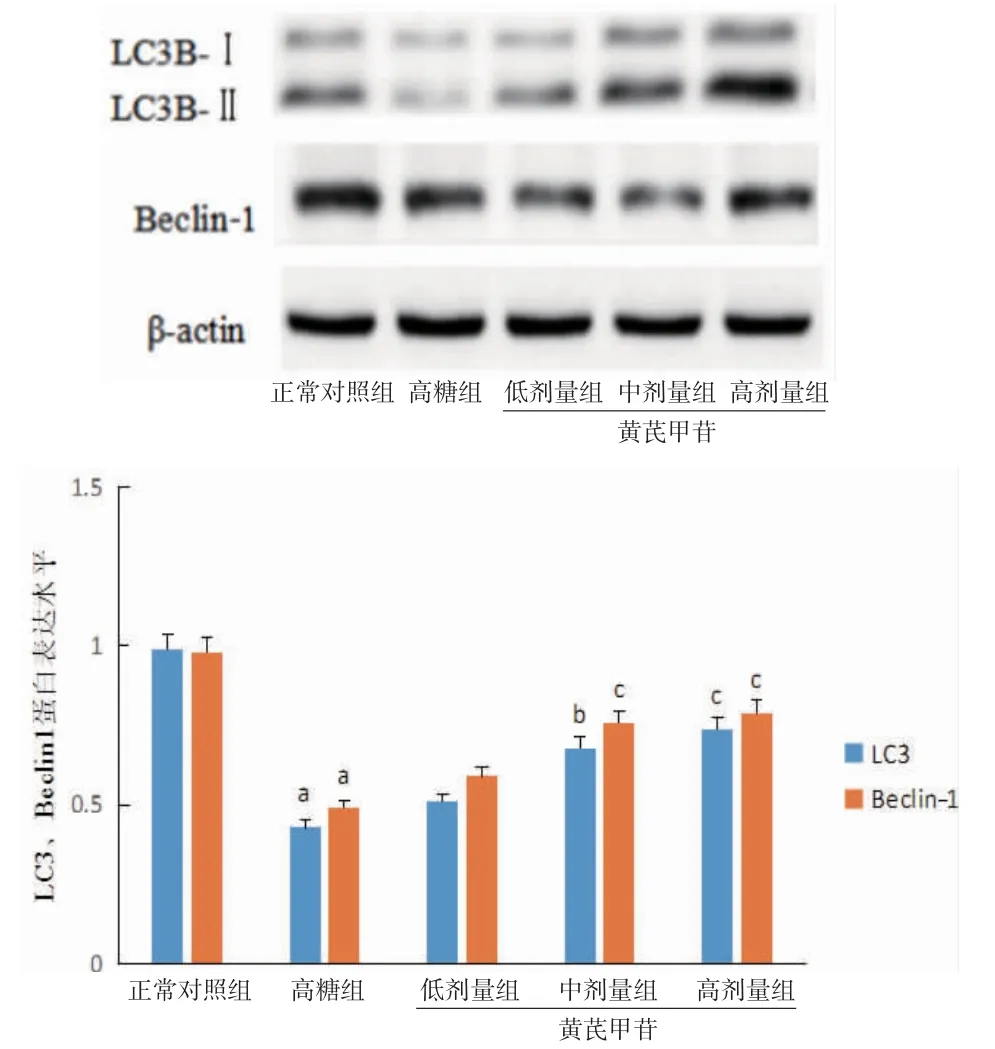
图8 各组小鼠SV40细胞自噬相关蛋白LC3、Beclin-1水平比较(±s,n=6)
3.7 各组小鼠SV40细胞NLRP3、Caspase-1水平比较与正常对照组比较,高糖组小鼠SV40细胞NLRP3、Caspase-1水平明显上调(P<0.01),提示高糖可激活NLRP3炎症小体信号通路,加重炎症反应。与高糖组比较,黄芪甲苷低、中、高剂量组小鼠SV40细胞NLRP3、Caspase-1水平均下调,且黄芪甲苷中、高剂量组小鼠SV40细胞NLRP3、Caspase-1水平均低于高糖组(P<0.05或P<0.01),提示黄芪甲苷可抑制NLRP3炎症小体信号通路活化,减轻细胞微炎症。(见图9)结合细胞LC3、Beclin-1表达水平变化,我们猜测黄芪甲苷可以通过上调线粒体自噬水平抑制NLRP3炎症小体信号通路活化。

图9 各组小鼠SV40细胞NLRP3、Caspase-1水平比较(±s,n=6)
4 讨 论
中医学中并无DN病名,但其特征与“关格”“水肿”“尿浊”“消瘅”记载相似[9]。血流阻滞,气机不畅,痰湿无法外排导致阴气瘀积,络息成积最终会引起脉络病变,并推动DN进展。现代医学研究表明,DN的发生与进展与血流动力学变化、糖基化终末产物积累、蛋白酶激活等多种途径相关,但以上途径都与炎症有密切关联[10]。近年来的研究则指出炎性小体在DN中具有重要作用。MARTINON F等[11]指出NLRP3炎症小体联通下游信号级联IL-1β、IL-18等致炎因子可诱发多种炎症疾病。炎症小体是固有免疫的受体及传感器,可以活化Caspase-1并诱导炎症反应,其具体过程为炎症小体募集并激活Caspase-1,活化的Caspase-1切割前体pro-IL-1β与pro-IL-18,促使其形成成熟的IL-1β、IL-18[12]。当前研究指出,NLRP3可被多种病原体激活,其驱动模式之一为高糖、ATP等物质刺激,包括线粒体产生的ROS、K+内流,以及线粒体转位等[13]。以上因素可以促进NLRP3形成多聚体复合物并诱导下游炎症通路活化。研究发现NLRP3炎症小体在DN大鼠肾脏中表达增强,炎症因子IL-1β、IL-18表达水平明显上调。DN疾病初期肾小球内NLRP3活化,通过抑制Caspase-1与ASC分泌能够有效改善肾小球硬化进程,延缓DN疾病进展[14],可见NLRP3炎症小体活化与DN有密切关联。
ROS作为炎症介质可以通过高糖刺激诱导NLRP3炎症小体活化,TSCHOPP J等[15]发现MitoTempo干预可下调NLRP3炎症小体表达水平,MitoTempo是拟过氧化物歧化酶,可以降低ROS含量。该研究证实了DN中NLRP3炎症小体激活与ROS密切相关。TAGAWA A等[16]发现DN的发生与进展和自噬抑制有密切关联。自噬可以及时清除肾脏内的代谢废物、受损及衰老细胞,一旦自噬受到抑制,以上物质便会在细胞外基质不断堆积,继而诱发肾小球病变。LC3、Beclin-1均为自噬调节因子,前者可以调节Ⅲ型磷脂酰肌醇3激酶活性,促进自噬体膜形成,后者可由LC3-Ⅰ与LC3-Ⅱ蛋白构成,LC3-Ⅰ在自噬体成熟过程中起到关键作用,且其表达水平亦会对LC3-Ⅱ表达水平产生影响。KITADA M等[17]研究指出,DN患者病情与细胞自噬水平相关,自噬水平受到抑制则疾病进展,反之自噬水平上调可以缓解DN病情,降低微量尿蛋白水平。
近年来,许多学者着手中医药治疗DN的研究并取得了一定成效。叶太生等[18]采用当归补血汤对DN大鼠进行灌胃,结果表明DN大鼠的肾功能得到有效改善,认为当归补血汤中的君药黄芪的主要有效成分黄芪甲苷可以抗炎降压,在治疗肾损害中发挥了重要作用。张筠等[19]研究了雷公藤多苷对DN大鼠肾细胞自噬的影响,发现雷公藤多苷可以抑制核因子-κB活化,从而有效抑制IL-6、IL-8等细胞因子活化,并抑制免疫细胞趋化、浸润,推断雷公藤多苷对大鼠肾功能的保护作用可能与抑制细胞氧化应激反应、激活自噬功能有关。李瑞杰等[20]观察了银杏叶提取物对早期DN大鼠炎症反应的影响,发现银杏叶提取物可以抑制NLRP3炎症小体激活发挥肾脏保护作用。以上中药或中药有效成分均从抑制炎症反应出发,通过调节氧化应激反应,抑制NLRP3炎症小体激活等方面起到治疗DN的效果。
本研究表明,高糖刺激会诱导小鼠SV40细胞发生一系列病理变化,包括自噬体减少、肾间质纤维化等,同时NLRP3炎症小体通路激活,导致ROS、炎症因子水平升高,并诱导细胞发生凋亡,降低细胞活力。高糖诱导的细胞加入黄芪甲苷干预后可见细胞内自噬体增多,黄芪甲苷干预后LC3、Beclin-1表达水平均上调。结果提示自噬抑制现象有效缓解。黄芪甲苷低、中、高剂量组小鼠SV40细胞NLRP3、Caspase-1水平均下调,提示黄芪甲苷干预可以抑制NLRP3炎症小体通路活性,并降低凋亡相关蛋白Caspase-1表达水平,从而抑制细胞凋亡,提高细胞活力。黄芪甲苷干预后各组小鼠SV40细胞ROS、炎症因子表达水平均显著下降。结合研究结果,我们推测细胞自噬水平上调清除了堆积的有害物质,减少了ROS产生,NLRP3炎症小体通路刺激物ROS减少,其激活途径受到抑制,降低了IL-1β、IL-18等炎症因子的表达水平,从而起到改善DN病情进展,保护SV40细胞的效果。
综上所述,高糖可诱导NLRP3炎症小体通路激活,并促使多种炎症因子分泌加重DN病情。黄芪甲苷可以有效降低细胞炎症因子水平,保护细胞功能,其机制可能在于上调细胞自噬水平并抑制NLRP3炎症小体通路激活,从而改善机体氧化应激与过度炎症反应。

