西黄丸对乳腺癌荷瘤小鼠肿瘤组织凋亡及相关因子表达的影响
张晓笛,何丽娟,陈会丛,张瀚涛,靳 冉,夏明钰
(1.沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016;2.北京同仁堂科技发展股份有限公司制药厂,北京 100079;3.北京中研同仁堂医药研发有限公司,北京 100079)
三阴性乳腺癌(triple negative breast cancer,TNBC)在转移性乳腺癌中所占比例超过50%,其对内分泌治疗和常规靶向药物治疗均不敏感[1],具有极强的侵袭性,复发率高,致死率高,预后不佳。西黄丸具有软坚散结、清热解毒、消肿止痛的功效,是治疗乳岩、肺痈、痰核、瘰疠之名方。多项临床和实验研究表明,西黄丸可抑制肿瘤细胞和肿瘤干细胞的生长、侵袭和肿瘤组织内血管生成,还可通过提高机体免疫力,逆转免疫抑制微环境,抑制肿瘤的发生发展和侵袭转移[2-5]。目前关于西黄丸治疗三阴性乳腺癌的研究报道很少,因此,本实验采用人乳腺癌细胞株MDA-MB-435建立三阴性乳腺癌移植瘤模型,观察西黄丸对肿瘤生长、肿瘤病理形态学、肿瘤组织凋亡及相关蛋白和mRNA表达的影响,探讨西黄丸对MDA-MB-435乳腺癌移植瘤小鼠肿瘤生长及肿瘤组织凋亡的影响。
1 材 料
1.1 实验动物6~8周龄SPF级雌性BALB/c-nu裸鼠40只,购于北京维通利华实验动物有限公司,动物合格证号:1140070 0187530,体质量16~22 g。小鼠饲养于SPF级动物室内,日光灯照明,12 h明暗周期,自由饮水、饮食,温度20~26℃,送风6~10次/h,湿度40%~70%。本实验经北京同仁堂研究院医学实验动物伦理委员会批准。
1.3 药物与试剂 西黄丸(北京同仁堂科技发展股份有限公司制药厂,批号:15042143);RNA提取试剂盒(TaKaRa公司,批号:AA2403-1);RNA PCR扩增试剂盒(TaKaRa公司,批号:AK5701);Gene Finder TM(至善生物,批号:151217);TUNEL染色试剂盒(美国罗氏制药公司,批号:11684817910)。
1.4 主要仪器ST5010型全自动组织切片染色机(德国Leica公司);RM2235型石蜡切片机(德国leica公司);BX61型光学显微镜(日本Olympus公司);UV2300型紫外分光光度计(上海天美);PCR基因扩增仪(北京东胜创新生物科技有限公司);MiniBis ProUV凝胶成像仪(以色列DNR);水平电泳槽(北京六一生物科技有限公司)。
2 方 法
2.1 细胞传代及培养 将人乳腺癌细胞MDA-MB-435置于恒温培养箱中(37℃,5%CO2)采用L15完全培养液培养,2~3 d传代一次(细胞贴壁长至培养瓶的80%~90%)。传代方法:吸去培养瓶中培养液,用PBS液冲洗后加入0.25%胰蛋白酵消化,待消化完全后,加入L15完全培养液终止消化,轻柔吹打贴壁细胞后分装,每天观察细胞生长情况。
2.2 人乳腺癌移植瘤造模方法 吸去培养瓶中培养液,用PBS液冲洗后加入0.25%胰蛋白酶消化,轻柔吹贴壁细胞,收集所有培养瓶中的单细胞悬液,置入离心机中离心(1 200 r/min,5 min),弃上层清液,在细胞计数板下调整细胞密度。在无菌操作台下用75%酒精消毒接种处皮层,抽取人乳腺癌细胞悬液0.2 mL,于裸鼠腋部皮下缓慢注射,注射后用消毒棉签轻压片刻,待接种处皮肤稍隆起后将裸鼠放回。
2.3 分组及给药 接种10 d后,剔除5只造模未成功者,将35只乳腺癌荷瘤小鼠按体质量随机方法分为模型组,环磷酰胺组和西黄丸高、中、低剂量组,每组7只。西黄丸高、中、低剂量组荷瘤小鼠灌胃西黄丸,给药剂量分别为1.8、0.9、0.45 g/kg;环磷酰胺组荷瘤小鼠灌胃环磷酰胺,给药剂量为36 mg/kg,模型组荷瘤小鼠以等体积的纯水灌胃,1次/d,给药体积均为20mL/kg。连续给药3周后,将荷瘤小鼠脱颈椎处死,其中西黄丸低剂量组2只和西黄丸中剂量组1只因灌胃呛死。处死荷瘤小鼠后小心分离肿瘤组织,用游标卡尺量取肿瘤长、短直径,称质量,一半用多聚甲醛固定,一半冻存液氮中备用。
2.4 观察指标
2.4.1 脾脏指数检测 荷瘤小鼠脱颈椎处死后,小心分离肿瘤组织,打开腹腔,剥离脾脏,去除多余脂肪,称质量,计算脾脏指数。脾脏指数=脾脏湿质量/体质量×100%。
2.4.2 肿瘤病理组织形态学检测 将腋下肿瘤组织,放置于多聚甲醛中固定,组织固定2周,将肿瘤组织置于包埋盒中进行组织脱水、包埋,制作腊块。组织腊块切为3μm厚度贴于病理级玻片上,45℃烤片数分钟后进行HE染色。中性树胶封片,镜下进行形态学观察。
山洪灾害防御预案的编制坚持以人为本的原则,以保障人民群众生命安全为首要目标;坚持安全第一,常备不懈,以防为主,防、避、抢、救相结合;坚持因地制宜,突出重点,具有可操作性;坚持落实行政首长防汛责任制、分级管理责任制、分部门责任制和岗位责任制。
2.4.3 肿瘤病理组织免疫组化检测 免疫组化检测方法:石蜡切片常规脱水,加3%H2O2灭活源性过氧化物活性,加山羊血清封闭,滴加一抗,4℃过夜,PBS液冲洗后滴加二抗,DAB显色,苏木素复染,盐酸酒精分色,梯度酒精脱水,二甲苯透明,中性树胶封片。显微镜下观察,拍片,光学显微镜下取图,采用Image-ProPlus 6.0软件统计分析。
2.4.4 TUNEL法检测肿瘤组织细胞凋亡程度 组织蜡块制备3μm切片,常规二甲苯脱蜡,按照试剂盒说明书进行操作,DAB显色,苏木素轻度复染,脱水透明、封片,光学显微镜下取图,采用Image-Pro Plus 6.0软件统计分析,计算各组荷瘤小鼠肿瘤组织细胞凋亡情况。
2.4.5 RT-PCR方法检测凋亡基因Bax、Caspase-3和原癌基因Bcl-2的mRNA表达 采用Trizol法提取细胞总RNA,经RT反应和PCR反应之后,扩增产物琼脂糖电泳,采用MiniBis Pro凝胶成像分析仪进行图像分析,并用Gelpro32凝胶图像分析软件对PCR产物进行半定量分析,分别用目的基因/内参基因的积分吸光度来表示目的基因的mRNA表达水平。
2.5 统计学方法 采用SPSS 25.0软件进行分析,计量资料以“均数±标准差”(±s)表示,数据先进行方差齐性检验,方差齐选用One-Way ANOVA法进行各组间比较,方差不齐选用t’检验进行组间比较。以P〈0.05为有统计学意义
3 结 果
3.1 各组荷瘤小鼠肿瘤生长情况 环磷酰胺组和西黄丸高、中、低剂量组荷瘤小鼠肿瘤体积均低于模型组,但差异无统计学意义(P〉0.05);环磷酰胺组和西黄丸高剂量组荷瘤小鼠肿瘤质量均低于模型组(P〈0.05),西黄丸中剂量组荷瘤小鼠肿瘤质量低于模型组,但差异无统计学意义(P〉0.05)。(见表1)
表1 各组荷瘤小鼠肿瘤生长情况比较(±s)

表1 各组荷瘤小鼠肿瘤生长情况比较(±s)
注:与模型组比较,aP〈0.05
组别 动物数(只)给药剂量(g/kg)体积(mm3)肿瘤质量(g)模型组 7 - 433.4±179.9 0.371±0.136环磷酰胺组 7 0.036 286.4±176.5 0.202±0.124a西黄丸高剂量组7 1.800 343.8±182.1 0.216±0.107a西黄丸中剂量组6 0.900 350.2±204.3 0.283±0.093西黄丸低剂量组5 0.450 358.8±135.8 0.275±0.100
3.2 各组荷瘤小鼠体质量、脾脏湿质量、脾脏指数比较5组荷瘤小鼠体质量比较,差异无统计学意义(P〉0.05);环磷酰胺组荷瘤小鼠脾脏湿质量和脾脏指数均低于模型组(P〈0.05),西黄丸中剂量组荷瘤小鼠脾脏湿质量和脾脏指数均高于模型组(P〈0.05);西黄丸中、高剂量组荷瘤小鼠脾脏湿质量和脾脏指数均高于环磷酰胺组(P〈0.01),西黄丸低剂量组荷瘤小鼠脾脏湿质量和脾脏指数与模型组和环磷酰胺组比较,差异无统计学意义(P〉0.05)。(见表2)
表2 各组荷瘤小鼠体质量、脾脏湿质量、脾脏指数比较(±s)
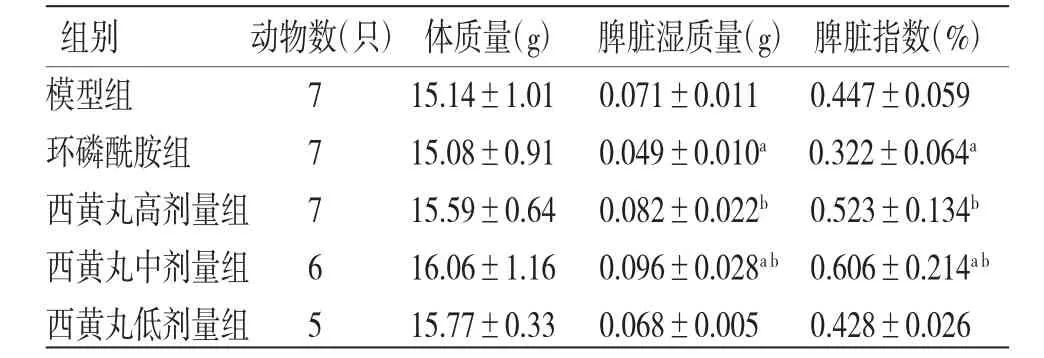
表2 各组荷瘤小鼠体质量、脾脏湿质量、脾脏指数比较(±s)
注:与模型组比较,aP〈0.05;与环磷酰胺组比较,bP〈0.01
组别 动物数(只)体质量(g) 脾脏湿质量(g)脾脏指数(%)模型组 7 15.14±1.01 0.071±0.011 0.447±0.059环磷酰胺组 7 15.08±0.91 0.049±0.010a 0.322±0.064a西黄丸高剂量组 7 15.59±0.64 0.082±0.022b 0.523±0.134b西黄丸中剂量组 6 16.06±1.16 0.096±0.028a b 0.606±0.214a b西黄丸低剂量组 5 15.77±0.33 0.068±0.005 0.428±0.026
3.3 各组荷瘤小鼠肿瘤组织病理形态比较 各组荷瘤小鼠肿瘤组织中肿瘤细胞呈弥漫性生长,紧密排列在一起。模型组荷瘤小鼠肿瘤细胞异型性明显,肿瘤细胞体积较大者居多,细胞核大而深染,核浆比例明显增大,细胞核可见病理性核分裂像。环磷酰胺组和西黄丸高、中、低剂量组荷瘤小鼠肿瘤细胞异型性较模型组低,肿瘤组织出现坏死区域,坏死区伊红染色呈现无结构颗粒状。其中环磷酰胺组荷瘤小鼠肿瘤组织见大量泡沫细胞形成,瘤周可见淋巴细胞反应。西黄丸高剂量组荷瘤小鼠肿瘤细胞有所退变,残存的肿瘤细胞较少,肿瘤细胞核深染、固缩。(见图1)

图1 各组荷瘤小鼠肿瘤组织的形态学比较(HE,×400)
3.4 各组荷瘤小鼠肿瘤组织细胞凋亡的表达比较TUNEL染色阳性产物表现为棕黄色,多集中于胞浆、胞膜及核膜上。模型组荷瘤小鼠肿瘤组织细胞凋亡表达不明显,着色较浅,局部区域表现为浅黄色,西黄丸低剂量组荷瘤小鼠肿瘤组织细胞凋亡局部表达明显,呈弱阳性,西黄丸中、高剂量组荷瘤小鼠肿瘤组织凋亡组织表现出棕黄色,范围广,呈强阳性表达。与模型组比较,环磷酰胺组和西黄丸高、中剂量组荷瘤小鼠肿瘤组织凋亡区域明显增加(P〈0.05或P〈0.01)。(见图2~3)
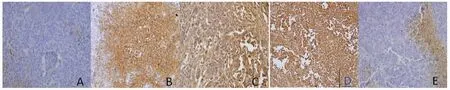
图2 各组荷瘤小鼠肿瘤组织细胞凋亡情况比较(TUNEL染色,×400)
Bax免疫组化法阳性表达为棕黄色,模型组荷瘤小鼠肿瘤组织细胞凋亡表达不明显,环磷酰胺组和西黄丸高剂量组荷瘤小鼠肿瘤组织凋亡组织表达明显,范围广,呈强阳性表达,与模型组比较,阳性表达显著增加(P〈0.01)。(见图4~5)

图4 各组荷瘤小鼠肿瘤组织Bax蛋白表达的形态学比较(免疫组化,×400)
图3 各组小鼠肿瘤细胞凋亡情况比较(±s)

图5 各组荷瘤小鼠肿瘤组织Bax蛋白表达情况比较(±s)
3.5 各组荷瘤小鼠肿瘤组织凋亡基因Bax mRNA、Caspase-3 mRNA和原癌基因Bcl-2 mRNA比较 与模型组比较,环磷酰胺组和西黄丸高剂量组荷瘤小鼠肿瘤组织Caspase-3 mRNA的表达明显升高(P〈0.05),表明环磷酰胺和高剂量西黄丸对Caspase-3 mRNA的表达也有一定的促进作用;与模型组比较,环磷酰胺组及西黄丸各剂量组Bax mRNA均明显降低(P〈0.05),表明环磷酰胺及高、中、低剂量西黄丸可显著下调Bax基因的比率;与模型组比较,西黄丸高剂量组荷瘤小鼠肿瘤组织Bcl-2 mRNA的表达明显降低(P〈0.05)。(见图6~7)
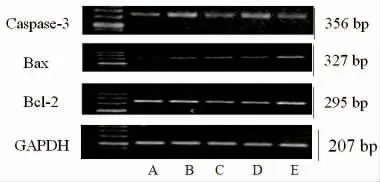
图6 各组裸鼠瘤体组织Bax、Bcl-2、Caspase-3 mRNA的表达情况(RT-PCR)

图7 各组荷瘤小鼠瘤体组织Bax mRNA、Caspase-3 mRNA、Bcl-2 mRNA表达比较(±s)
4 讨 论
细胞凋亡是细胞在一定条件下接受刺激信号并受基因调控的一种自主性、程序性死亡过程[6],对于细胞凋亡方面的研究,近些年取得了关键性进展。细胞凋亡涉及到一系列蛋白及转录因子的激活、表达及调控等作用,其中Bcl-2家族蛋白、Caspase家族蛋白和p53蛋白等在调控的信号转导中扮演着重要角色[7]。Bcl-2家族是一组原癌基因蛋白,包含抑制和促进细胞凋亡两类功能相反的一组蛋白质,Bcl-2和Bax是Bcl-2家族一对相反的调控因子[8],Bcl-2存在人体多种形态的肿瘤组织中,Bax可与Bcl-2蛋白形成异二聚体,中和Bcl-2抗凋亡信号,激活下游凋亡因子,从而促进凋亡,二者的比例决定细胞接受凋亡信号的多少[9]。抑癌基因TP53可由辐射、化学物质、氧化应激等诱导的DNA损伤等应激反应激活,从而转录诱导多种凋亡蛋白(PUMA、NOXA、Bax等)表达启动凋亡,维持机体基因组的稳定性[10]。COX-2可能通过蛋白激酶C(PKC)依赖途径抑制肿瘤细胞的凋亡发生,有研究显示COX-2抑制剂可使PG合成减少,从而下调Bcl-2的表达,导致细胞凋亡[11]。
恶性肿瘤与中医所述之“积聚”“癥瘕”较为类似,中医理论认为本虚标实是癌症的主要病机,当代医家指出癌症以虚致实的理论,认为气血虚损及脏腑虚损,导致人体三焦道路、人体经络失于通畅,进而产生诸如痰、瘀、内毒及内火等病理产物,因此多虚中夹实[12]。西黄丸作为抗肿瘤的中成药在临床上被广泛使用,有“抗癌第一中成药”的美誉。西黄丸中牛黄清热解毒化痰,为君药;麝香辛窜通络,活血散结,并助牛黄化痰之力,为臣药;乳香、没药活血祛瘀,消肿止痛,为佐药;黄米饭养胃,陈酒活血行气以助药力,共为使药,全方合用以达清热解毒、和营消肿之功效。西黄丸常用来治疗淋巴结核、乳腺增生、丹毒、疱疹口疮、多发性脓肿等疾病。现代医学研究也表明西黄丸具有抗肿瘤作用[13-15]。
前期结果提示西黄丸大鼠含药血清对乳腺癌细胞株MCF-7、MDA-MB-231、MDA-MB-435细胞增殖均有不同程度的抑制作用,西黄丸含药血清对乳腺癌细胞株MDA-MB-435、MDA-MB-231和MCF-7细胞凋亡有一定的促进作用,并且对三阴性乳腺癌细胞株的抑制作用更强[16]。本实验研究在前期研究结果的基础上,采用人乳腺癌细胞株MDA-MB-435在裸鼠腋下注射建立三阴性乳腺癌细胞株移植肿瘤模型(CDX),西黄丸经口灌胃给药3周后检测肿瘤质量、体积、脾脏指数、病理学改变、肿瘤组织凋亡情况及和凋亡相关mRNA的表达,以评价西黄丸治疗乳腺癌的作用。
本研究显示,西黄丸干预乳腺癌CDX后,西黄丸在一定程度上可以降低乳腺癌CDX肿瘤组织瘤质量,对乳腺癌CDX所致的肿瘤生长、演进有一定抑制作用。西黄丸灌胃给药乳腺癌CDX后,肿瘤组织中Bax mRNA和Casepase-3 mRNA的表达均有所降低,同时可以下调肿瘤组织中Bcl-2 mRNA的表达,经TUNEL染色结果表明西黄丸可以增加肿瘤组织中凋亡区域的面积,可以诱导肿瘤组织中肿瘤细胞凋亡,凋亡程度与西黄丸给药剂量呈正相关。免疫组化结果显示,西黄丸低、中、高剂量组Bax蛋白表达含量依次增加,而PCR结果显示,西黄丸高、中、低剂量组Bax mRNA表达依次增加,这可能是西黄丸可促进Bax mRNA加速翻译成蛋白,也可能是其他的原因尚需进一步研究探索。综上所述,对肿瘤组织中肿瘤细胞凋亡相关环节的诱导和调控可能是西黄丸发挥抗乳腺癌的重要效应机制。

