灰树花粗多糖提取物体外抑菌及抗氧化活性初步探究
薛小兰 范瑜珊

摘 要:为明确灰树花粗多糖的抑菌和抗氧活性,以灰树花为原料,采用热水浸提、醇沉得到灰树花多糖,同时采用牛津杯法研究灰树花粗多糖对大肠杆菌和金黄色葡萄球菌的抑菌效果,通过DPPH自由基清除能力、羟自由基清除能力、总还原力测定研究灰树花粗多糖的抗氧化活性。结果表明:灰树花粗多糖对大肠杆菌和金黄色葡萄球菌均有抑菌效果,抑菌圈直径分别为12 mm和14 mm;灰树花粗多糖对DPPH自由基的清除作用较强,在浓度为0.2~1.6 mg·mL-1 范围内,清除率随着浓度的增加而明显上升,浓度为1.6 mg·mL-1 时清除率达到78.13%,当浓度增加到2.0 mg·mL-1 时清除率降低(72.32%)。灰树花粗多糖对羟基自由基的清除能力较弱,浓度0.2 mg·mL-1 时的清除率为5.96%,浓度为2.0 mg·mL-1 时清除率为23.57%。灰树花粗多糖的总还原力也比较弱,在浓度0.2~2.0 mg·mL-1 ,总还原力(OD)值为0.2~0.4。
关键词:灰树花;粗多糖;抑菌;抗氧化
中图分类号:S 646 文献标志码:A 文章编号:0253-2301(2021)09-0015-05
DOI: 10.13651/j.cnki.fjnykj.2021.09.003
Preliminary Study on Antibacterial and Antioxidant Activities ofCrude Polysaccharide Extract from Grifola Frondosa
XUE Xiao lan, FAN Yu shan
(Fujian Vocational College of Bioengineering, Fuzhou, Fujian 350007, China)
Abstract: In order to determine the antibacterial and antioxidant activities of crude polysaccharides in Grifola frondosa, by using Grifola frondosa as the raw material, the polysaccharides were prepared from Grifola frondosa by hot water extraction and alcohol precipitation. Meanwhile, the oxford cup method was used to study the antibacterial effect of crude polysaccharides in Grifola frondosa on Escherichia coli and Staphylococcus aureus, and the antioxidant activity of crude polysaccharides in Grifola frondosa was determined by DPPH free radical scavenging capacity, hydroxyl radical scavenging ability and total reducing power. The results showed that crude polysaccharides in Grifola frondosa had antibacterial effects on Escherichia coli and Staphylococcus aureus, and the diameters of inhibition zone were respectively 12 mm and 14 mm. The crude polysaccharides in Grifola frondosa had strong scavenging effect on DPPH free radical, and the scavenging rate increased with the increase of concentration in the range of 0.2-1.6 mg·mL-1 . The scavenging rate reached 78.13 % when the concentration was 1.6 mg·mL-1 , while decreased to 72.32 % when the concentration was 2.0 mg·mL-1 . The total reducing power (OD) of crude polysaccharides in Grifola frondosa was also weak. The total reducing power (OD) value was 0.2-0.4 at the concentration of 0.2-2.0 mg·mL-1 .
Key words: Grifola frondosa; Crude polysaccharide; Bacteriostatic; Antioxidant
灰樹花俗称舞菇,是最近几年开发起来的一种食药两用菌,属于真菌类。灰树花营养丰富,居各种食用菌之首。子实体中含有大量的氨基酸、蛋白质及多种有益的矿物质,所以当灰树花与其他食物一起食用时,可以平衡营养成分及提高机体对蛋白的吸收,促进人体健康。此外灰树花也是一种非常宝贵的中药,中医认为灰树花性甘、平、无毒,具有清热解暑、益气健脾、利水消肿的功效,是上品中药,对健康者具有保健作用,对病人有辅助治疗作用。随着灰树花人工栽培技术的成熟和产量的大幅度提高,灰树花已形成良好的产业链,其作为药食兼用的食用菌已经备受世人的瞩目。
近几年,大量研究发现灰树花含有多种生物活性物质,其中最主要的一类活性成分是灰树花多糖,它具有显著的抗肿瘤、抗HIV、抗病毒、调节血糖、降血压及能抗氧化等作用。张媛媛等[1] 从灰树花子实体多糖分离得到分子量为29.574 kDa的多糖组分GFD1 ,该多糖组分对于人体肝癌细胞HepG2的增殖抑制效果显著。Kubo等[2] 从灰树花子实体中提取出粗多糖,分离、纯化后,显示含有a(14)
8(16)葡聚糖,可以明显地降低血糖值。葛健康等[3] 采用水提醇沉的方法得到灰树花提取物粗品对Ⅱ型糖尿病小鼠和链脲佐茵素导致的糖尿病小鼠有医治和调节免疫功效。张立霞等[4] 用大鼠设计试验,表明灰树花多糖有降低血压的功效且可以保护心脏、肾脏的破损。付佳乐等[5] 用灰树花提取物进行体外抑菌和抗氧化活性研究。前人关于灰树花多糖的研究主要集中于基于动物试验法的抗肿瘤、调节血糖、降血压等药理作用和药理机制方面,而对多糖的抑菌和抗氧化活性研究甚少。本研究采用热水浸提,然后醇沉得到灰树花粗多糖,同时对提取的灰树花粗多糖进行体外抑菌和抗氧化活性研究,旨在为进一步分离纯化得到小分子物质并研究其抑菌和抗氧化机制提供理论基础,也为灰树花多糖类制剂或保健品的开发提供理论依据。
1 材料与方法
1.1 供试材料及试验药剂
供试材料为灰树花(购自浙江省庆元县)。试验药剂主要有:大肠杆菌、金黄色葡萄球菌、无水乙醇、苯酚、浓硫酸、葡萄糖、1,1二 苯基苦基苯肼(DPPH)、硫酸亚铁、30%过氧化氢、水杨酸、抗坏血酸、磷酸缓冲液、铁氰化钾、三氯乙酸、三氯化铁(均购自国药集团化学试剂有限公司)。
1.2 试验主要仪器
恒温培养箱、超净工作台、数显三用水浴锅 HH3A (金坛市精达仪器制造有限公司);电子分析天平 FA2004N(上海精天电子仪器厂);循环水式多用真空泵 SHZDIII(巩义市予华仪器有限公司);旋转蒸发仪R系列(上海申生科技有限公司);电热恒温鼓风干燥箱 DHG9240A(上海一恒科技有限公司);低速离心机 SC3612(科大创新股份有限公司);紫外可见分光光度计TU1810(普析通用有限公司)。
1.3 试验方法
1.3.1 热水浸提法提取灰树花粗多糖 灰树花经除杂、干燥、粉碎等预处理后,得到灰树花干粉。准确称取10 g灰树花干粉放入装有200 mL蒸馏水烧杯中,调节pH值7.5、90℃水浴加热2 h。然后抽滤得到滤液,将滤液倒入圆底烧瓶中,用旋转蒸发仪进行浓缩,得到膏状的提取物,加入无水乙醇(与提取物的体积比3∶1),冷藏过夜,收集沉淀物,去除乙醇得到灰树花粗多糖。把得到的粗多糖置于真空干燥箱中干燥(80℃、6 h),然后计算其产率。
1.3.2 灰树花粗多糖含量的测定 试验方法参考文献[6] :称取葡萄糖10 mg加蒸馏水溶解于烧杯,于100 mL容量瓶定容,分别取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL,依次加入蒸馏水至2 mL。分别加入1 mL的5%苯酚溶液混匀,然后立即加入5 mL浓硫酸,充分混匀,90℃水浴中显色15 min,冷却,在波长490 nm下测吸光度A,得标准曲线方程y=-0.0126+0.0139x,R 2=0.9958。配制浓度为0.1 mg·mL-1 灰树花粗多糖溶液,按照上述操作测得吸光值,根据标准曲线,可以计算多糖纯度。
1.3.3 灰树花粗多糖抑菌活性试验
(1)菌悬液的制备:在超净工作台下用无菌接种环将大肠杆菌和金黄色葡萄球菌用适量的无菌生理盐水清洗下来,稀释并充分摇匀,使各个菌种悬液中的菌细胞浓度为10-6 ~ 10-5 CFU·mL-1 。
(2)抑菌试验:采用牛津杯法[7] 对抑菌效果进行测定。吸取1 mL的菌液到含有营养琼脂培养基的平板上,用涂布棒将菌液涂布均匀,在培养基表面等距放置3个牛津杯,轻轻加压,使其与培养基接触无缝隙。然后在杯子加已配置好的浓度为1 g·mL-1 的灰树花粗多糖溶液,放入培养箱培养,设置温度37℃,16~18 h后取出,用游标卡尺测量抑菌圈直径,计算平均值。用无菌水作空白对照。
1.3.4 灰樹花粗多糖抗氧化试验
1.3.4.1 DPPH清除能力测定 试验方法参照文献[8]进行。配制浓度梯度0.2、0.4、0.8、1.2、1.6、2.0 mg·mL-1 的粗多糖溶液,分别取2 mL,依次加入0.04 mg·mL-1 的DPPH乙醇溶液2 mL轻轻震荡,混合均匀,并置于暗室内反应30 min,于4500 r·min-1 离心15 min,在517 nm处测量样品的吸光值A样品 。其中对照组样液用等体积的去离子水代替,测定吸光值A对照 ,空白组中用无水乙醇代替样品组中的DPPH乙醇溶液,测定吸光值A空白 ,使用Vc为阳性对照。 DPPH清除率的计算公式为: DPPH清除率(%)=[1-(A样品 -A空白 )/A对照 ]×100%
1.3.4.2 羟自由基清除能力测定 试验方法参照文献[9]进行。称取适量的灰树花粗多糖提取物,分别用水稀释成0.2、0.4、0.8、1.2、1.6、2.0 mg·mL-1 的浓度梯度溶液2 mL。依次加入9 mmol·L-1 硫酸亚铁溶液2 mL,9 mmol·L 乙醇水杨酸2 mL,8.8 mmol·L-1 双氧水2 mL,37℃水浴15 min,在波长510 nm处测定吸光值A样品 。其中对照组样液用等体积的去离子水代替,测定吸光值A(对照) ,空白组中用蒸馏水代替双氧水溶液,测定吸光值A(空白) 。 Vc作为阳性对照。OH清除率的计算公式:
OH清除率(%)= [1-(A样品 -A空白 )/A对照 ]×100%。
1.3.4.3 总还原力的测定 试验方法参照文献[10]进行。称取适量的灰树花粗多糖提取物,分别用水稀释成0.2、0.4、0.8、1.2、1.6、2.0 mg·mL-1 的浓度梯度溶液,依次加入0.2 moL·L-1 、pH为6.6的磷酸缓冲液2 mL、1%铁氰化钾溶液2 mL,混匀后在50℃水浴中反应20 min。取出后迅速加入2 mL10%三氯乙酸,并放于于离心机中3000 r·min-1 离心10 min。取上清液2 mL加入2 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,混匀后静置10 min,在700 nm处测其吸光值。Vc作为阳性对照。还原力的计算公式:还原力=A样品 - A空白 。
2 结果与分析
2.1 灰树花粗多糖抑菌活性测定
如图1所示,灰树花粗多糖对大肠杆菌和金黄色葡萄球菌均有抑菌效果,且对金黄色葡萄球菌的抑菌效果更明显。经测量,大肠杆菌的抑菌直径为12 mm,金黄色葡萄球菌的抑菌直径为14 mm。
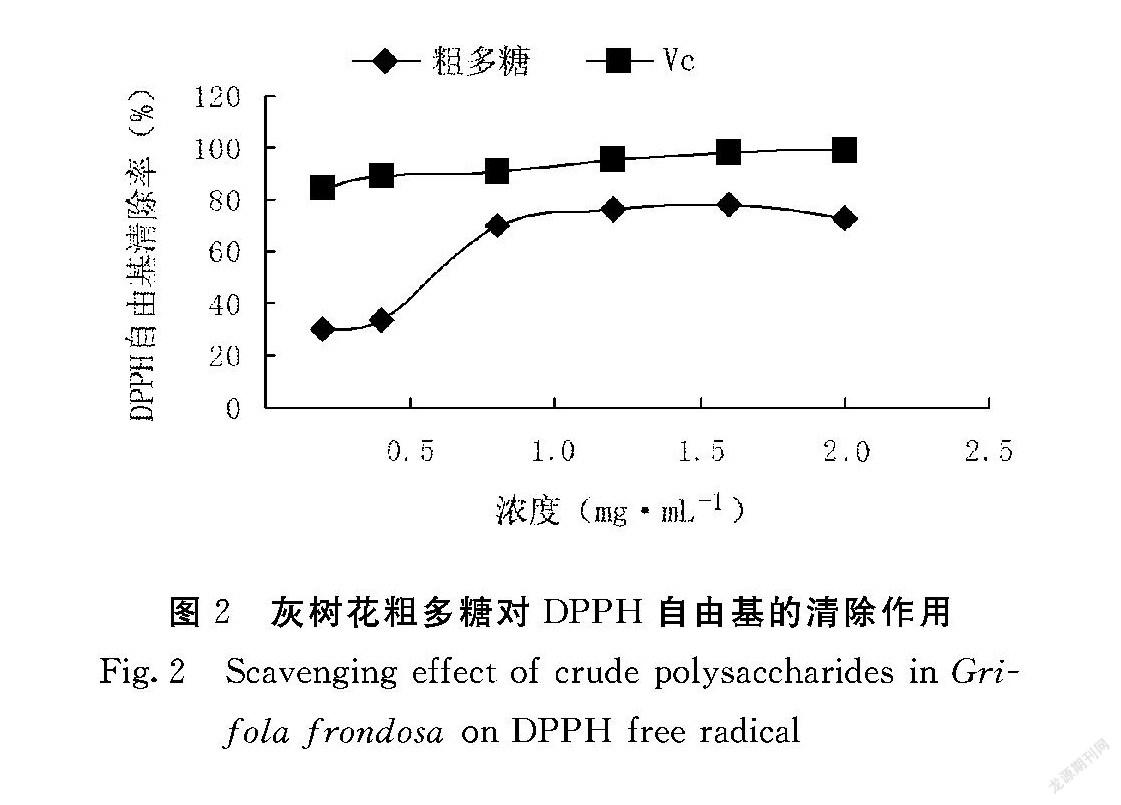
2.2 灰树花粗多糖DPPH自由基清除能力测定
如图2所示,灰树花粗多糖对DPPH自由基具较强的清除作用。在0.2~1.6 mg·mL-1 的浓度范围内,灰树花粗多糖对DPPH自由基清除率随浓度的增大而升高,呈现一定的量效关系,灰树花多糖含量在1.6 mg·mL-1 时,清除率达到78.13%,当超过1.6 mg·mL-1 浓度范围后,清除率略有下降。Vc对DPPH自由基清除率基本在90%左右,说明Vc对DPPH自由基清除率强于灰树花粗多糖,但随着浓度的增大,两者对DPPH自由基的清除率接近。
2.3 灰树花粗多糖羟基自由基清除能力测定
如图3所示,灰树花粗多糖对羟基自由基的清除作用较弱。在浓度0.2~2.0 mg·mL-1 范围内,灰树花粗多糖对羟基自由基的清除作用随着浓度的增大而升高,灰树花粗多糖浓度为0.2
mg·mL-1 时,羟基自由基的清除率仅为5.96%,浓度为2.0 mg·mL-1 时羟基自由基的清除率达到23.57%。Vc对羟基自由基的清除率随着浓度急剧增大,在浓度2.0 mg·mL-1 时清除率达到96%。由此可见在高浓度时,Vc对羟基自由基的清除效果强于灰树花粗多糖。
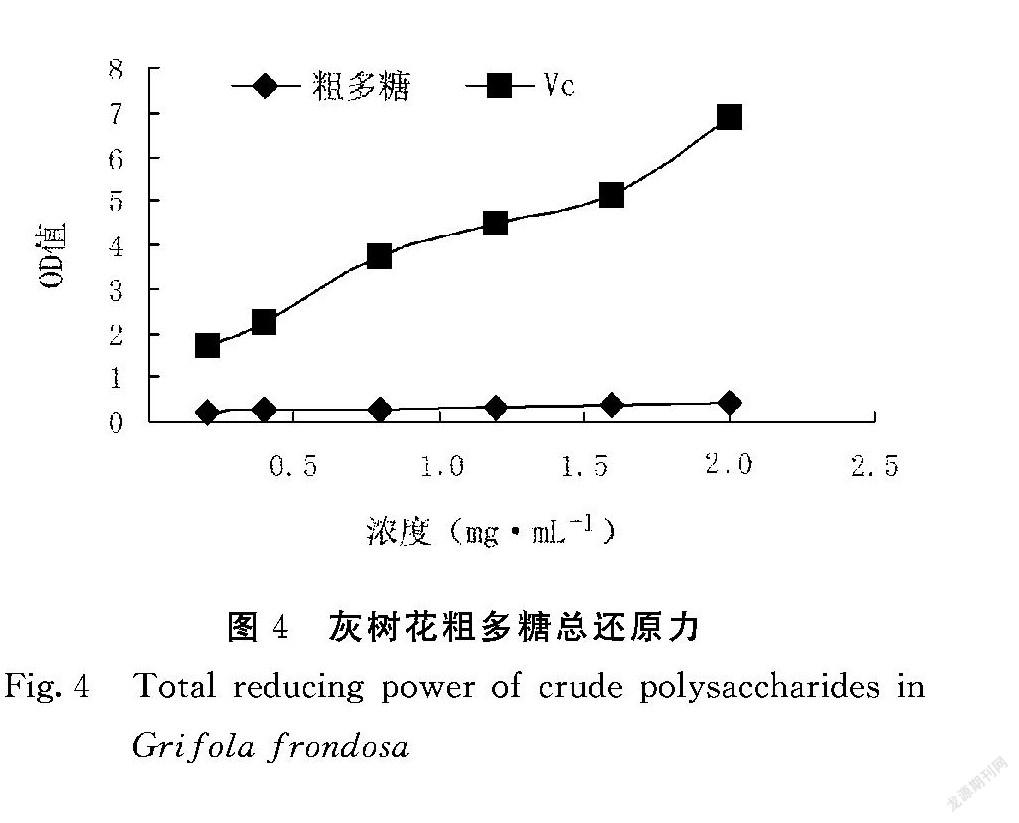
2.4 灰树花粗多糖总还原力的测定
如图4所示,在浓度0.2~2.0 mg·mL-1 范围内,灰树花粗多糖的总还原力值在0.2~0.4,而在同浓度范围内,Vc的OD值为1.7~6.9,可见灰树花粗多糖的OD值远低于Vc,但还是具有一定的还原力,且和浓度呈量效关系。
3 讨论与结论
本研究结果表明灰树花粗多糖提取物具有体外抑菌和抗氧化活性。抑菌研究过程中,灰树花粗多糖对大肠杆菌和金黄色葡萄球菌均有抑菌效果。抗氧化活性研究中,粗多糖对DPPH自由基的清除作用较强,在浓度低至0.2 mg·mL-1 时DPPH自由基的清除率达到33.93%,随着浓度的增加,清除率明显上升,当浓度为1.6 mg·mL-1 时灰树花粗多糖对DPPH自由基的清除率达到78.13%,然后随着浓度的增大清除率略有降低,浓度增大到2.0 mg·mL-1 清除率降低到72.32%。灰树花粗多糖对羟基自由基的清除作用随着浓度的增加变化也比较明显,浓度为0.2 mg·mL-1 时羟基自由基清除率5.96%,浓度为2.0 mg·mL-1 时羟基自由基清除率达到23.57%,但是均低于同浓度的Vc,清除率是Vc的25%。灰树花粗多糖的OD值比Vc小,在浓度0.2~2.0 mg·mL-1 范围内,灰树花粗多糖的OD值为0.2~0.4,可能是灰树花粗多糖中含有的还原性物质比较少,导致还原能力不强。
本研究未对灰树花粗多糖的抑菌活性进行定量试验,其最低抑菌浓度和最低杀菌浓度还有待研究。此外,本研究中从灰树花提取的粗多糖成分比较复杂,其粗多糖不仅含有多糖,还含有多酚、蛋白、矿物离子等物质,其中多酚具有抑菌和抗氧化功效[11-13] 。因此,灰树花粗多糖的抑菌和抗氧化活性成分和作用机制还有待进一步研究,今后的研究重点和难点是对粗多糖进一步分离纯化得到小分子物质,并对小分子物质的结构和抑菌及抗氧化活性机制进行研究,为营养保健品的开发和医药方面研制开发提供详细的资料。
参考文献:
[1]张媛媛,孟梦,王明飞,等.灰树花多糖的分离纯化及体外抗肝癌作用研究[J].食品研究与开发,2016,8(15):1-5.
[2]KUBO K,AOKI H,NANBA H.Anti diabetic activity present in the fruit body of Grifola frondosa(Maitake)[J]. Bio Pharm Bull,1994,17(8):101-106.
[3]葛健康,张佰鹏,吴梧桐,等.灰树花子实体多糖提取物对2型糖尿病小鼠的治疗作用[J].西北药学杂志,2008,23(6):372-374.
[4]张立霞,杨静,倪艳波,等.灰树花多糖对高血压大鼠的血压及心脏、肾脏超微结构的影响[J].中国老年杂志,2013,10(33):4764-4766.
[5]付佳乐,耿直.灰树花多糖体外抑菌及抗氧化活性研究[J]. 中国现代应用药学,2020,37(8):945-948.
[6]樊懿娜,赵婷,周叶,等.苯酚硫酸法测定灰树花中多糖含量的研究[J].安徽农业科学,2011,39(25):15256-15257.
[7]赵丛丛,管庆林,王涛,等.桂花子提取物体外抗氧化和抑菌活性研究[J].食品研究与开发,2021,42(10):31-36.
[8]赵学思,师仁丽,李岩,等.碱蓬黄酮提取物的体外抗氧化及抑菌性研究[J].食品工業科技,2016,37(13):63-66,71.
[9]程敏,吴春合,刘文驹,等.菊三七多糖的提取工艺优选及体外抗氧化活性考察[J].中国药师,2020,23(10):1915-1919.
[10]张志军,李淑芳,魏雪生,等. 灵芝多糖体外抗氧化活性的研究[J]. 化学与生物工程,2011(3):63-65.
[11]柴丽,张公亮,侯红漫.灰树花多酚类物质抑菌作用的研究[J].中国酿造,2012,3(3):91-93.
[12] 陈向东,刘晓雯,吴梧桐.灰树花多酚的提取和活性研究[J]. 食品与生物技术学报,2005,24(4):26-30.
[13]黄梓芮,潘雨阳,李田田.灰树花不同极性多酚组分的抗氧化活性研究[J].农产品加工,2017,7(7):1-4.
(责任编辑:林玲娜)

