阿托伐他汀对多发性硬化的作用及体液免疫机制的体内实验研究
张欣
天津市环湖医院高压氧科 300350
多发性硬化(multiple sclerosis,MS)是发生在中枢神经系统(CNS)的自身免疫反应异常引起的炎症性脱髓鞘性疾病[1]。其具体发病原因尚未阐明,从自身免疫调节来看,CD4+Thl 细胞免疫调节异常被认为是导致MS 发病的原因,这是因为在MS 患者CNS 脱髓鞘斑块中检测到的淋巴细胞以T细胞为主,将髓鞘相关致敏T细胞过继转移给小鼠可诱导实验性自身免疫性脑脊髓炎(EAE)模型的建立[2]。有研究表明,在MS 患者CNS 内免疫球蛋白合(Ig)合成与血浆Ig合成率不一致,表明CNS 局部有Ig 合成[3]。髓内合成的Ig以IgG 寡克隆带(OCB)的形式出现在患者脑脊液(CSF)中,这成为MS 疾病的特点,特异性OCB 已收录在最新的McDonald诊断标准中[4]。2017年美国食品药品监督管理局(FDA)已批准使用消耗B 细胞单克隆抗体药物ocrelizumab治疗多发性硬化,不仅对复发型MS 有效,而且对一些原发进展型 MS 患者也有效[5]。这表明 B 细胞在 MS 的发病中扮演着比以前更重要的角色。他汀类药物主要通过抑制3-羟基-3-甲基戊二酰辅酶A(HMG-coA)还原酶,阻碍L-甲羟戊酸生成,从而起到降低血胆固醇和低密度脂蛋白(LDL)的作用,是临床上常用的降脂药物。1995 年首次发现该类药物还具有免疫调节作用,可以降低心脏移植患者的免疫排斥反应,降低病死率。他汀类药物免疫调节机制可能是通过抑制甲羟戊酸合成,减少下游产物合成,进一步抑制小GTP 结合蛋白的激活达到调节免疫反应[6]。该药物还可以影响免疫系统中细胞免疫及体液免疫的多个环节,包括T、B 细胞的增殖分化、抗原的呈递、Thl/Th2 细胞因子的分泌、淋巴细胞归巢等环节[7-8]。目前许多研究证实,他汀类药物可减轻EAE,延长潜伏期,影响其病程转归。他汀类药物对EAE 的治疗作用是否与对B 细胞的调节相关,本实验在研究阿托伐他汀治疗EAE 的同时,探讨阿托伐他汀对EAE 模型中自身反应性B细胞的影响。
1 资料与方法
1.1 实验动物 2021 年1 月至4 月,选取雌性C57BL/6小鼠45 只,体质量 18~22 g,8~10 周龄,由哈尔滨医科大学附属第二医院动物实验中心提供[生产许可证号 SCXK(京)2016-0002,使用许可证号 SYXK(黑)2006-033]。均为清洁饲养,实验过程符合《实验动物饲养和使用条例》及3R原则。
1.2 主要试剂 MOG35-55,纯度>95%(美国sigma公司),百日咳毒素(PTX)(美国sigma 公司),完全福氏佐剂(CFA)(美国sigma 公司),卡介苗冻干粉(石家庄结核病防治研究所),FITC 标记抗-鼠CD19抗体(美国BD 公司),B细胞活化因子(BAFF)和增殖诱导配体(APRLI)酶联免疫吸附法(ELISA)试剂盒(武汉博士德生物工程公司),山羊抗小鼠IgG免疫组化试剂盒(北京博奥森生物制品公司),阿托伐他汀片(大连辉瑞制药有限公司)。
1.3 EAE 模型的建立 参考 Sundaram G 等[9]方法:将MOG35-55用0.01 mol/L PBS 缓冲液稀释成5 mg/ml,然后按等比加入CFA,CFA 中加入卡介苗浓度为4 mg/ml,将二者装在玻璃注射器内在冰上不断来回抽打使混合液充分乳化,滴1 滴在水中不溶解为止,用10%水合氯醛(3 ml/kg)将小鼠麻醉后,将乳化好的抗原乳剂按每只0.2 ml 在小鼠脊柱两侧分4 点皮下注射,免疫开始为第0 天,免疫第0 天及第2 天分别腹腔注射PTX 400 ng/只。
1.4 实验动物分组 依据体质量随机将小鼠分为对照物、EAE 组、他汀治疗组。对照组(15只):使用0.01 mol/L PBS 缓 冲 液 与 CFA 乳 化 免 疫 C57BL/6 小 鼠 。EAE 组(15只):用MOG35-55肽段、CFA、PTX 免疫C57BL/6小鼠建立EAE 模型。他汀治疗组(15 只):免疫完成第3 天开始灌服阿托伐他汀至处死,1次/d,剂量为10 mg(/kg·d)[10-11]。
1.5 实验动物的评估 免疫开始当天,每日对各组小鼠称重及神经功能评分,评分标准参考国际通用Knoz 标准。0 分:无临床症状;1 分:尾巴肌张力降低;2 分:后肢无力或瘫痪;3 分:后肢瘫痪,靠健侧肢体移动;4 分:后肢瘫痪,可出现四肢瘫痪;5分:濒死状态或死亡[12]。
1.6 小鼠脑组织病理学观察 各组小鼠于发病高峰期(21 d),达最大平均临床评分处死。用4%水合氯醛麻醉小鼠,首先用冷生理盐水灌注心脏,然后再用4%多聚甲醛灌注,直至小鼠内脏变白身体僵硬,固定成功后,在冰板上剥离脑和脊髓,4%多聚甲醛浸泡过夜,石蜡包埋待用。进行各组小鼠脑HE染色和脑免疫组化,均严格按照说明书步骤执行。
1.7 脾脏B 细胞流式检测 颈椎脱臼处死小鼠,取出脾脏,获得脾脏细胞悬液。用吸管将脾细胞悬液吸入10 ml离心管中,1 000 r/min离心5 min(离心半径12 cm),弃上清;沉淀加3倍体积的红细胞裂解液,室温放置5 min,使其充分裂解,1 000 r/min 离心 5 min(离心半径 12 cm),弃上清;加2 ml PBS洗2次,1 000 r/min离心5 min(离心半径12 cm),弃上清;用RPMI1640 培养液重悬细胞,台盼兰染色计数活细胞数;计数板计数,使用含2×106/ml 细胞悬液。将获得的细胞悬液加入PBS 缓冲液分装于EP 管中(根据细胞数量,每个 EP 管约 2×106细胞),4 ℃,1 000 r/min 离心 5 min(离心半径12 cm),小心弃上清;加入100µl 1%BSA、0.1%叠氮钠的PBS 重悬细胞,分别加入异硫氰酸荧光素(FITC)标记抗-鼠CD19 抗体标记,4 ℃避光孵育 30 min;加 1 ml PBS 洗 1 次,4 ℃,1 000 r/min 离心5 min(离心半径12 cm);加入300 µl 1%多聚甲醛固定过夜,使用BD流式细胞仪上机检测。
1.8 各组小鼠外周血BAFF 和APRLI 检测 将小鼠用4%的水合氯醛麻醉后,剪去眼睛周围毛发及胡须,采用摘眼球法取外周血,取出外周血后-20 ℃冰箱保存。ELISA 测定小鼠外周血中BAFF 和APRLI 浓度,按照说明书步骤执行。
1.9 统计学方法 所有数据均采用SPSS 19.0 统计学软件进行分析,符合正态分布的计量数据采用()表示,各组间比较采用独立样本t检验,检验水准a=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠发病情况 EAE 组小鼠最早从第9天开始发病,陆续出现食欲减退、活动减少、反应迟钝等。随后出现CNS 受损症状:尾巴张力下降、瘫痪,严重时出现四肢瘫痪、尿便失禁及死亡,同时伴有体质量下降。症状从发病开始1 周左右达到高峰。与EAE 组相比,他汀治疗组小鼠最早第10 天起病,他汀治疗组平均发病时间较晚,发病率及死亡率减低,临床症状较轻,体质量下降程度改善。对照组未出现任何临床症状,体质量缓慢持续增长。各组雌性C57BL/6小鼠发病情况比较见表1。
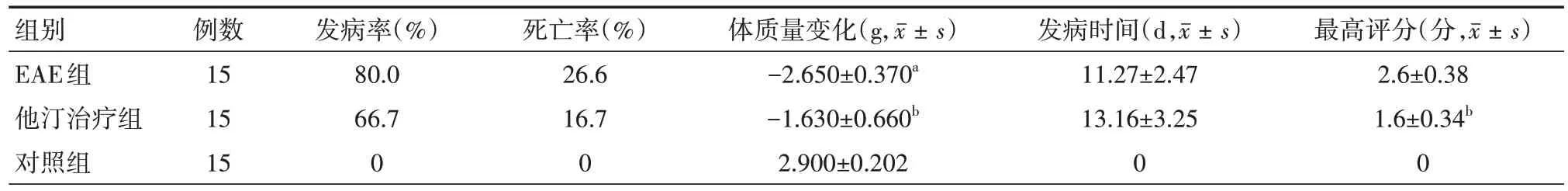
表1 各组雌性C57BL/6小鼠发病率、死亡率、体质量变化、发病时间、最高评分比较
2.2 各组脑组织病理学改变 EAE 组小鼠侧脑室旁、脑干、小脑都出现了不同程度白质脱髓鞘改变,脑实质内小血管扩张充血,周围有大量炎性细胞浸润,聚集成团,以淋巴、单核细胞为主,主要集中在白质、灰白质交界区。他汀治疗组上述部位也有白质脱髓鞘改变,炎性细胞浸润程度较EAE组有不同程度减轻。光镜下对照组小鼠脑组织无明显改变。见图1。
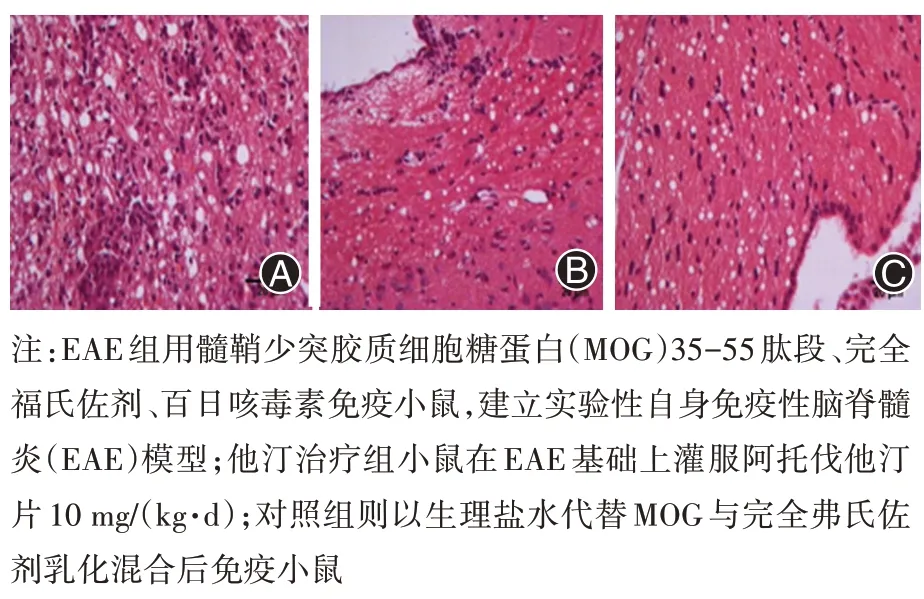
图1 各组雌性C57BL/6小鼠脑组织病理切片(HE ×400)。A:EAE 组雌性C57BL/6 小鼠脑组织病理切片;B:他汀治疗组雌性C57BL/6 小鼠脑组织病理切片;C:对照组雌性C57BL/6 小鼠脑组织病理切片
2.3 脑免疫组化 EAE 组小鼠脑组织内可见较多IgG渗出,表现为神经胶质细胞胞浆、神经纤维网、脑脊膜和小血管内皮呈现棕褐色,而他汀治疗组小鼠脑组织IgG渗出少于EAE组;对照组脑组织内未见IgG表达。见图2。

图2 各组雌性C57BL/6 小鼠脑组织内IgG 水平(免疫组化 ×400)。A:EAE 组雌性 C57BL/6 小鼠脑组织内 IgG 水平;B:他汀治疗组雌性C57BL/6 小鼠脑组织内IgG 水平;C:对照组雌性C57BL/6小鼠脑组织内IgG水平
2.4 各组小鼠脾脏活化B细胞比例比较 EAE组活化B 细胞比例为(50.014±2.631)%,他汀治疗组为(39.864±1.788)%,对照组为(34.514±1.470%)。统计学分析显示,EAE组小鼠脾脏活化B细胞比例明显高于对照组(P=0.000 152),他汀治疗组小鼠脾脏中活化B 细胞比例明显低于EAE 组(P=0.011 140)。见图3、4。

图3 各组雌性C57BL/6 小鼠脾脏活化B 细胞比例比较。A:EAE 组雌性C57BL/6 小鼠脾脏活化B 细胞比例;B:他汀治疗组雌性C57BL/6 小鼠脾脏活化B细胞比例;C:对照组雌性C57BL/6小鼠脾脏活化B细胞比例

图4 各组雌性C57BL/6小鼠脾脏B细胞百分比比较
2.5 小鼠外周血APRLI 和BAFF 浓度测定 EAE 组小鼠外周血 APRLI、BAFF 浓度分别为(1.780±0.194)µg/L、(199.066±20.566)µg/L,他汀治疗组分别为(1.689±0.155)µg/L、(137.600±15.085)µg/L,对照组分别为(1.343±0.205)µg/L和(151.066±15.708)µg/L;统计学分析显示,EAE 组小鼠外周血中APRLI 和BAFF 浓度较对照组无明显升高(P=0.134 7、P=0.127 2),他汀治疗组较EAE 组无明显降低(P=0.719 9、P=0.112 6)。见图5。
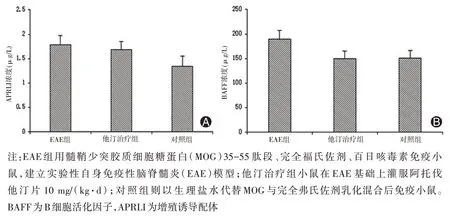
图5 各组雌性C57BL/6 小鼠外周血APRLI 和BAFF 浓度比较。A:各组雌性C57BL/6 小鼠外周血APRLI浓度比较;B:各组雌性C57BL/6小鼠外周血BAFF浓度比较
3 讨 论
B 细胞是人体内的免疫细胞,发挥特异性体液免疫作用,因此B 细胞功能紊乱可导致许多自身免疫性疾病发生。对于B 细胞在MS 发病机制中作用的理解仍在不断发展,脑脊液中存在的寡克隆带、脑膜中存在的B 细胞滤泡样结构及靶向B 细胞消耗治疗的有效性,都是B 细胞参与MS 发病的重要证据[13]。已有研究证明,治疗性抗CD20单克隆抗体的有效性和相对可容忍的不良反应,说明其具有良好的利益 风 险比[14]。James ML 等[15]使用 64 cu-rituximab-pet 技术,在EAE 小鼠CNS检测到B细胞,较对照组差异有统计学意义(P<0.05),将来可以在MS 患者中使用它来评估检测和监测B 细胞在疾病进展和治疗。此外,这些IgG 分泌的B细胞被局限在病变区,证实有胶质细胞活化、脱髓鞘和神经退行性变。本实验使用MOG35-55多肽段成功诱导EAE 模型,与对照组比较,EAE 组小鼠脾脏中B 细胞占单个核细胞的比例明显增加,脑组织免疫组化也可见较多IgG渗出。这表明MOG33-55肽段可以使B细胞活化增殖,活化的B细胞及自身抗体参与了EAE 的发病。B 细胞被抗原激活后可转变为浆细胞,具有产生特异性抗体的能力,这在EAE发病机制中有重要作用。Mannara F 等[16]证明在被动EAE 模型B细胞是明显增多的,这些B细胞与IgG的共同定位及其在脱髓鞘区的主要分布提示IgG 分泌B 细胞参与了被动EAE 的神经退行性过程,提示存在抗体分泌细胞。Al-Ani MR等[17]研究证明,给予20µg/只小鼠的利妥昔单抗治疗,可以降低EAE 临床评分,减少B 细胞在小鼠脑血管周围间隙的浸润,并能抑制炎症和脱髓鞘。本研究和上述实验结论相似,表明B 细胞及其分泌自身抗体在EAE 发病中有一定作用。
BAFF 和APRLI 为肿瘤坏死因子超家族成员,对B 细胞的发育、存活、Ig 的产生和T 细胞共刺激起重要的作用。BAFF 和APRLI 表达异常可使自身反应性B 细胞逃脱自身检测点死亡信号,使异常B 细胞免于凋亡,从而参与许多自身免疫性疾病的发生。Piazza F 等[18]对 30 例初发性 MS 患者和79 例对照组(急性或慢性炎症性或非炎症性神经疾病)进行研究表明,与健康对照组相比,MS 患者CSF 和血清中 BAFF 和 APRIL 水平升高。Huntington ND 等[19]研究证明,BAFF/APRIL 拮抗剂 hBCMA-Fc 在 MS 动物模型治疗中是有效的,观察到B 细胞数量和Ig 滴度显著减少,可以抑制CNS炎症和脱髓鞘,从而抑制EAE临床发病和进展,减轻临床症状。上述研究表明,BAFF/APRIL 调节异常参与了MS或EAE 的发病。BAFF/APRIL 是否可以作为MS 发病的生物标志物,或新的治疗靶点?本实验测定了各组小鼠外周血BAFF和APRLI平均浓度变化,EAE组较对照组没有明确增高,他汀治疗组较EAE组无明显降低(均P<0.05)。这和Sursiakova NV 等[20]发表的 BAFF 浓度在 EAE 中是正常的结论相一致,结果表明EAE 发病与外周血BAFF、APRLI 浓度变化无关,BAFF及APRLI在EAE发病中的作用有待进一步研究。
有临床试验证实,他汀类药物对MS 有一定治疗作用[21]。研究表明,高剂量辛伐他汀能有效减缓继发进展型MS 患者脑萎缩的进展,该研究随机双盲将140 例晚期继发进展型MS 患者分为安慰剂组和辛伐他汀组(80 mg/d),分别于不同时间段进行头MRI 扫描,结果显示高剂量辛伐他汀能将脑萎缩发生率降低43%,残疾进展减少40%[22]。也有动物实验表明,他汀类药可以抑制复发-缓解型 EAE[23]。本研究表明,与EAE 组相比,他汀治疗组发病时间较晚,发病率及死亡率减低,临床症状较轻,体质量下降程度改善,表明阿托伐他汀对EAE 有治疗作用。但这种治疗作用是通过何种机制实现的,目前尚不清楚。Lawman S 等[24]实验表明,狼疮易感NZB/WF1小鼠服用阿托伐他汀可导致血清抗dsDNA IgG 抗体显著减少,疾病改善与MHCII 在单核细胞和B 淋巴细胞上的表达降低减少,CD80 和CD86 在B 淋巴细胞上的表达降低相关,证实阿托伐他汀通过体液免疫途径可以延缓自发性自身免疫疾病的进展。本实验通过B 细胞流式检测证明,他汀治疗组小鼠脾脏中活化B 细胞比例较EAE 组降低;推测阿托伐他汀对EAE 小鼠的治疗作用可能与下调异常B 细胞比例及对体液免疫调节相关。阿托伐他汀对B 细胞的作用可能与以下途径相关。⑴抑制B 细胞增殖。体外实验证明,他汀类药物可以抑制MS 患者外周血B 细胞及T 细胞增殖,也可以显著减少外周血B 细胞表面趋化因子受体CxCR3 和CCR5 表达[25]。洛伐他汀通过降低细胞膜Cho、细胞内活性氧、瞬时受体电位阳离子通道6 蛋白表达和细胞内Ca2+来抑制恶性B 细胞增殖[26]。⑵促进B 细胞凋亡及分布异常。也有研究发现,他汀类药物也可对B 细胞凋亡产生影响,在给大鼠服用辛伐他汀后,检测药物组大鼠脾脏和淋巴结B 细胞比例,结果发现B 细胞数量均有显著下降。免疫荧光标记法证实,辛伐他汀可能是通过抑制淋巴细胞归巢作用导致B 淋巴细胞数量下降,并不是直接促进B 细胞凋亡,外周淋巴器官中淋巴细胞无法获得存活信号也可以间接导致细胞凋亡增加[27]。
综上所述,阿托伐他汀药物可通过多种途径参与EAE发病的调节,而对体液免疫的调节作用是重要的一部分。本实验结果表明,阿托伐他汀对EAE 的治疗作用可能与其下调异常B 细胞比例有关,但并不能确定这种作用通过何种机制实现,这也是后续研究的方向,为寻找靶向B 细胞治疗药物提供实验依据。
利益冲突:作者已申明文章无相关利益冲突。

