Yes相关蛋白1对胃癌顺铂化疗敏感性的影响及作用机制初探
杨振 张红珠 张伟 付婷婷
济南市第七人民医院消化内科 250101
胃癌是常见的消化道恶性肿瘤,其病死率高居肿瘤病死率的第2 位[1-2]。化疗是胃癌术后的主要治疗措施,而耐药性的产生直接关系化疗的成功。以顺铂为代表的化疗药物是胃癌化疗的一线药物,长期用药效果饱受耐药性及毒副作用影响[3]。文献指出,Yes 相关蛋白 1(yes-associated protein 1,YAP1)在多种恶性肿瘤中的差异表达与细胞的增殖关系密切[4-5]。徐岗等[6]研究发现,干扰 YAP1 可增强食管癌对顺铂的化疗敏感性,提示YAP1可能在肿瘤耐药形成中发挥作用。前期研究结果显示,胃癌组织中YAP1蛋白表达明显高于癌旁正常组织。目前关于胃癌中YAP1 与化疗敏感性的研究尚未见报道,我们推测胃癌中YAP1蛋白的表达与顺铂敏感性相关。为验证该观点,2019 年1 月至2020 年12 月,本研究拟通过构建干扰胃癌细胞中YAP1 表达,探究YAP1对胃癌细胞顺铂敏感性的影响及作用机制。
1 资料与方法
1.1 一般资料
1.1.1 细胞 实验用人正常胃上皮黏膜细胞GES1 和人胃癌细胞SGC-7901 购于美国模式培养物保藏所(American Type Culture Collection,ATCC)。
1.1.2 主要试剂 RPMI1640(Roswell Park Memorial Institute 1640)培养基、DMEM(Dulbecco's Modified Eagle Medium)培养基、胎牛血清(美国Gibco 公司);裂解液Trizol(美国Invitrogen 公司);二喹啉甲酸(BCA)蛋白定量试剂盒(美国Sigma公司);实时荧光定量逆转录试剂盒、反转录-聚合酶链反应(RT-PCR)试剂盒(日本TaKaRa 公司);鼠抗人β-actin 抗体、鼠抗人 YAP1 抗体、鼠抗人 IGF 抗体、鼠抗人Akt抗体、鼠抗人TGF-β抗体(美国Abcam公司)。
1.1.3 主要仪器 Ⅸ73 倒置荧光显微镜(日本OLYMPUS 公司);7500 Real-Time 定量PCR 仪(美国Thermo Fisher Scientific-CN 公司);Spectra Max iD5 酶标仪(美国molecular devices 公司);PE2400 电泳仪、GelDOC2000 型凝胶成像分析系统(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 细胞培养与传代 人正常胃上皮黏膜细胞GES1 置于含10%胎牛血清RPMI1640 培养基中,人胃癌细胞SGC-7901 置于含10%胎牛血清DMEM 培养基中,于37 ℃、5%CO2的培养箱中常规培养。待细胞铺满80%镜下视野时采用0.25%含乙二胺四乙酸四钠胰酶消化传代。取对数生长期细胞进行功能实验。
1.2.2 慢病毒感染人胃癌细胞株 YAP1 沉默重组慢病毒颗粒Lv-shRNA-YAP1 及阴性对照慢病毒颗粒Lv-shRNA-NC均委托广州锐博生物技术有限公司构建。
取对数期生长细胞SGC-7901,离心后重悬调整浓度,按3.5×104个/孔接种于六孔板中,待细胞生长状态良好达40%~60% 融合时,弃去培养基,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤2次,向各孔中加入840µl转染增强试剂和100 µl poly,随后将Lv-shRNA-YAP1、Lv-shRNA-NC 各60µl 分别加入相应孔中。每隔24 h 换液1次,72 h后将六孔板置于倒置荧光显微镜下观察慢病毒感染效率,以慢病毒感染效率超过80%视为感染成功。
1.2.3 RT-PCR 实验检测mRNA 相对表达量 细胞总RNA 采用Trizol 法,用紫外分光光度仪测定总RNA 浓度与纯度。按照mRNA 反转录试剂盒操作说明进行反转录,参照 SYBR®Premix Ex Taq TM 试剂盒说明进行 RT-PCR 检测,计算相对定量结果。
1.2.4 免疫印迹试验(Western blot,WB)检测蛋白相对表达量 细胞弃去培养基,PBS 洗涤3 次,加入适量混匀的细胞裂解液及蛋白酶抑制剂,冰上裂解30 min 收集细胞,4 ℃、12 000 r/min 离心15 min(半径10 cm),取上清液。使用BCA蛋白定量试剂盒进行蛋白定量,以相同蛋白上样量,煮沸变性后进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳。电泳后使用半干转仪转移至聚偏氟乙烯膜,5%脱脂牛奶封闭1 h,1%脱脂牛奶稀释一抗,4 ℃孵育过夜。次日TBST 洗脱,37 ℃孵育二抗1 h,PBS洗涤3次,ECL化学发光剂显影。
1.2.5 细胞计数8(Cell Counting Kit-8,CCK8)实验检测细胞增殖能力及对不同浓度顺铂敏感性 收集对数生长期细胞,离心后重悬细胞,调整悬液细胞浓度至5 000个/ml,96孔板每孔加入细胞悬液100µl,每组3 个复孔,常规培养。分别于0 h、24 h、48 h、72 h 时于每孔加入10 µl CCK8 试剂,继续置于培养箱中放置2 h,酶标仪测定其在450 nm处的吸光度(OD)值。以相对应OD 值表示细胞增殖能力大小,绘制细胞生长曲线。
收集对数生长期细胞制成细胞悬液,调整细胞浓度至5 000 个/ml,96 孔板每孔加入细胞悬液 100 µl,每组 3 个复孔,常规培养48 h。每孔加入10 µl CCK8 试剂,继续培养2 h,酶标仪测定其在450 nm处的OD值,测定顺铂抑制胃癌细胞增殖的半数抑制浓度(IC50)及胃癌细胞SGC-7901对不同浓度顺铂敏感性。
1.2.6 划痕实验检测细胞运动能力 各组细胞按2×105个/孔接种于6 孔板中,常规培养,待细胞贴壁为单层细胞状态时,于超净台中,采用无菌10µl枪头垂直于6孔板划线,各做3 条横线与垂直的竖线,采用PBS 缓慢冲洗6 孔板,去除划线处理的细胞。常规培养24 h,于光学显微镜下观察划痕处细胞运动情况。细胞运动率(%)=(初始划痕宽度-24 h后划痕宽度)/初始划痕宽度×100%。
1.2.7 Transwell 实验检测细胞迁移能力 取对数生长期细胞制成5×105个/ml 无血清细胞悬液,每个Transwell 小室中加入200 µl 细胞悬液,并在24 孔板每孔对应加入600µl的完全培养基,将小室放入孔中,培养箱培养24 h,进行固定及染色。计数穿过微孔移到滤膜下层的细胞总数,共计数中央及四周各5个视野并取其平均值。
1.2.8 Transwell 实验检测细胞侵袭能力 50 µl Matrigel 胶包被于Transwell 小室底部,37 ℃静置 2 h,进行Matrigel 胶预处理。取对数生长期细胞制成1×106个/ml 无血清细胞悬液,向每个铺胶的Transwell 小室中加入200 µl细胞悬液,并在24孔板每孔对应加入600µl的完全培养基,然后将小室放入孔中,培养箱培养24 h,进行细胞固定及染色。计数穿过微孔移到滤膜下层的细胞总数。
1.3 统计学处理 应用SPSS 20.0统计软件进行分析。符合正态分布的计量资料以均数±标准差表示,多组数据间比较采用方差分析,两组数据间均数比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 YAP1 在人胃癌细胞SGC-7901 中的表达情况与正常胃上皮黏膜细胞 GES1[mRNA(1.00±0.03),蛋白(1.00±0.02)]比较,YAP1 在胃癌细胞SGC-7901 中呈高表达[mRNA(6.43±0.43),蛋白(2.54±0.13)],差异均有统计学意义(t=11.821、8.371,均P<0.05)。见图1。

图1 YAP1 在人胃癌细胞SGC-7901 中的表达情况(A 为YAP1 mRNA 在人胃癌细胞SGC-7901 中的表达情况,B 为YAP1 蛋白在人胃癌细胞SGC-7901中的表达情况)
2.2 慢病毒转染效率评价 荧光显微镜下观察可见,胃癌细胞SGC-7901 感染慢病毒颗粒Lv-shRNA-YAP1、Lv-shRNA-NC 培养72 h 后,可见80%以上细胞有明显绿色荧光标志,提示慢病毒感染效率良好。见图2。

图2 慢病毒转染效率评价(左侧列为光学显微镜下慢病毒转染情况;右侧列为荧光显微镜下慢病毒转染情况,绿色荧光蛋白 ×40)
2.3 YAP1 对人胃癌细胞SGC-7901 增殖能力的影响空白对照组胃癌细胞在24 h、48 h、72 h 的增殖能力分别为(0.44±0.05)、(0.72±0.05)、(0.97±0.04),Lv-shRNA-NC 组分别 为 (0.40±0.05) 、(0.68±0.04) 、(0.92±0.05) ,Lv-shRNA-YAP1 组 分 别 为(0.34±0.04),(0.52±0.04),(0.73±0.05),与 空 白 对 照 组 和 Lv-shRNA-NC 组 比 较 ,Lv-shRNA-YAP1组胃癌细胞在24 h、48 h、72 h的增殖能力均明显较低,差异均有统计学意义(均P<0.05)。见图3。

图3 YAP1对人胃癌细胞SGC-7901增殖能力的影响
2.4 YAP1 对人胃癌细胞SGC-7901 运动能力的影响空白对照组的细胞运动距离(82.32±4.53)%,Lv-shRNA-NC组 为(84.42±5.42)% ,Lv-shRNA-YAP1 组 为(51.42±5.31)% ,Lv-shRNA-YAP1 组 与 空 白 对 照 组 和Lv-shRNA-NC 组比较,差异均有统计学意义(均P<0.05)。见图4。

图4 YAP1对人胃癌细胞SGC-7901运动能力的影响(A为划痕实验光学显微镜观察结果 ×40;B为划痕实验细胞运动率计算结果)
2.5 YAP1 对人胃癌细胞SGC-7901 迁移能力的影响空白对照组细胞迁移为(543±43)个,Lv-shRNA-NC 组为(523±51)个、,Lv-shRNA-YAP1组为(432±44)个,与空白对照组和Lv-shRNA-NC 组细胞比较,Lv-shRNA-YAP1 组细胞迁移能力明显较低,组间差异均有统计学意义(均P<0.05)。见图5。

图5 YAP1对人胃癌细胞SGC-7901迁移能力的影响(A为Traswell细胞迁移实验光学显微镜观察结果,龙胆紫染色 ×40;B为Tras⁃well细胞迁移实验计数结果)
2.6 YAP1 对人胃癌细胞SGC-7901 侵袭能力的影响空白对照组细胞侵袭为(586±54)个,Lv-shRNA-NC 组(573±54)个,Lv-shRNA-YAP1组(485±53)个。与空白对照组和Lv-shRNA-NC 组细胞比较,Lv-shRNA-YAP1 组细胞侵袭能力明显较小,组间差异均有统计学意义(均P<0.05)。见图6。

图6 YAP1 对人胃癌细胞SGC-7901 侵袭能力的影响(A 为Traswell 细胞侵袭实验光学显微镜观察结果,龙胆紫染色 ×40;B 为Traswell细胞侵袭实验计数结果)
2.7 顺铂对人胃癌细胞SGC-7901 增殖的抑制作用当顺铂浓度为 0.5 µg/ml、1.0 µg/ml、2.0 µg/ml、4.0 µg/ml、8.0 µg/ml 时,Lv-shRNA-YAP1 组胃癌细胞 SGC-7901 存活率均明显低于空白对照组和Lv-shRNA-NC 组(P<0.05),空 白 对 照 组 顺 铂 对 细 胞 的 IC50为(4.43±0.32)µg/ml,Lv-shRNA-NC 组顺铂对细胞的 IC50为(4.18±0.42)µg/ml,Lv-shRNA-YAP1组顺铂对细胞的IC50为(1.48±0.33)µg/ml,明显低于空白对照组和Lv-shRNA-NC 组,差异有统计学意义(P<0.05)。见表1。
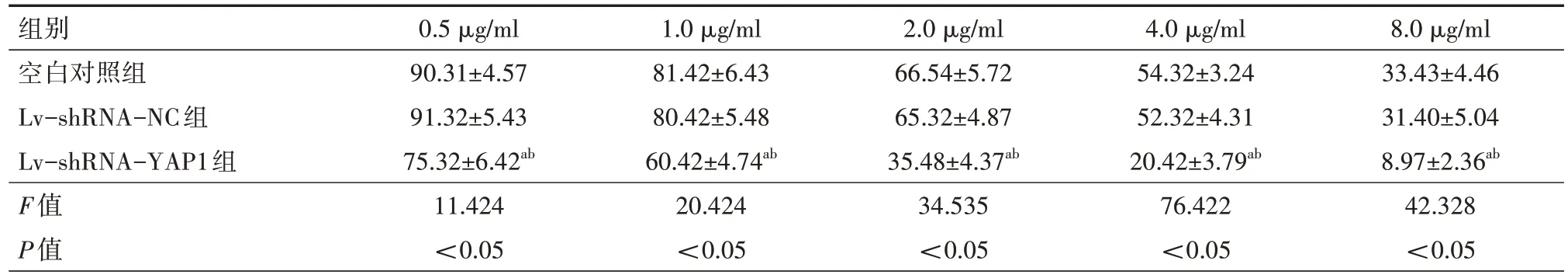
表1 不同顺铂浓度对人胃癌细胞SGC-7901增殖的抑制作用
2.8 YAP1 影响人胃癌细胞SGC-7901 顺铂敏感性的信号通路作用 空白对照组细胞中IGF、Akt、TGF-β 的mRNA 和蛋白相对表达量分别为(1.00±0.03)、(1.00±0.02)、(1.00±0.04),(1.00±0.02)、(1.00±0.04)、(1.00±0.03),Lv-shRNA-YAP1 组 分 别 为(0.58±0.03)、(0.62±0.03)、(0.39±0.03),(0.78±0.03)、(0.73±0.03)、(0.74±0.05),顺铂组 分 别 为(0.67±0.02)、(0.73±0.03)、(0.40±0.02),(0.72±0.04)、(0.74±0.04)、(0.77±0.05),Lv-shRNA-YAP1 组和顺铂组细胞中IGF、Akt、TGF-β的mRNA和蛋白相对表达量明显优于空白对照组细胞(均P<0.05),Lv-shRNA-YAP1+顺铂组细胞中 IGF、Akt、TGF-β 的 mRNA 和蛋白相对表达量[(0.70±0.02)、(0.68±0.03)、(0.34±0.04),(0.51±0.03)、(0.46±0.03)、(0.55±0.05)]则明显低于Lv-shRNA-YAP1 组和顺铂组(均P<0.05)。与空白对照组细胞比较,Lv-shRNA-YAP1 组细胞中 IGF、Akt、TGF-β 的 mRNA 和蛋白相对表达量均明显较低(均P<0.05),顺铂组细胞中IGF、Akt、TGF-β mRNA 和蛋白相对表达量也明显低于空白对照组细胞(均P<0.05),Lv-shRNA-YAP1+顺铂组细胞中IGF、Akt、TGF-β 的 mRNA、蛋白相对表达量则进一步低于Lv-shRNA-YAP1 组和顺铂组,差异均有统计学意义(均P<0.05)。
3 讨 论
胃癌的发生受多基因共同作用影响,与环境、生活习惯、遗传、幽门螺杆菌感染等危险因素密切相关[7]。化疗是胃癌手术治疗及保守治疗的主要治疗措施,在胃癌的临床治疗中一直占据着重要地位。顺铂作为DNA 直接作用铂类药物,是胃癌化疗的一线临床药物,但顺铂耐药的发生仍在一定程度上限制了化疗干预的有效性[8]。寻找有效方法逆转胃癌对顺铂的耐药性,提高患者的临床疗效迫在眉睫。
目前,肿瘤细胞耐药的相关机制并未完全明了,有研究认为,细胞耐药与细胞的增殖、凋亡紊乱有关[9-10]。研究发现,过表达原钙黏蛋白10 可抑制人胃癌细胞BGC823 的增殖,并通过下调磷脂酰肌醇-3激酶、哺乳动物雷帕霉素靶蛋白、p70 核糖体蛋白S6 激酶mRNA 和蛋白表达,增强肿瘤细胞的顺铂化疗敏感性[11]。刘蒙等[12]研究也指出,靶向沉默CDH10 可通过抑制顺铂耐药细胞的增殖能力,提高胃癌细胞对顺铂的敏感性,提示细胞增殖调节在肿瘤细胞的顺铂耐药敏感中发挥着重要作用。YAP1 是一种具有多种功能的细胞内连接蛋白和转录共激活因子,是果蝇蛋白激酶(Hippo)信号转导通路的重要组成因子,在细胞增生和凋亡平衡的维持中扮演着重要角色[13]。研究指出,YAP1表达异常可导致Hippo 信号通路活化,打破细胞增殖与凋亡平衡,调节细胞向恶性转化[14]。近年来研究发现,YAP1表达升高与肿瘤的发生发展密切相关,其在结肠癌、卵巢癌、乳腺癌等多种水体肿瘤中活性增强,提示其具有潜在的致癌潜能[15-17]。有关胃癌与 YAP1 的研究指出,YAP1 在胃癌组织中的阳性表达率明显高于癌旁组织,且其表达水平与患者的 TNM 分期具有明显相关关系[18]。吴卫莉等[19]研究也指出,YAP1 高表达与胃癌临床分期及不良预后密切相关,提示YAP1 可能作为预测胃癌的分子标志物。但关于YAP1 与胃癌化疗敏感性的研究仍鲜有报道。本研究通过构建YAP1靶向沉默慢病毒,并感染胃癌细胞形成稳定沉默YAP1 的细胞株,于体外实验中探索性探究YAP1 对胃癌细胞增殖、迁移、侵袭等生物学行为能力的影响,结果显示,胃癌细胞中YAP1相对表达量明显高于正常胃黏膜上皮细胞,且沉默YAP1 表达,胃癌细胞增殖、运动、迁移、侵袭能力明显降低,提示YAP1 与胃癌细胞的增殖、运动、迁移、侵袭密切相关。体外顺铂敏感性实验结果显示,在不同顺铂浓度下,沉默YAP1 组胃癌细胞存活率及顺铂对细胞的IC50均明显较低,为(1.48±0.33)µg/ml,表明抑制YAP1可改善胃癌细胞对顺铂的敏感性。
有研究发现,髓母细胞中YAP1 可诱导IGF 表达,并通过改善Akt活性强化细胞的放射抵抗力,促进放疗后肿瘤细胞的生长,促进细胞再生[20]。与此同时也有研究指出,TGF-β 是YAP1 调节细胞生长、分化过程中的一个重要的转录共激活因子,在胞内信号分子SMADs 蛋白的协助下,YAP1 可参与TGF-β 的信号转导作用,参与细胞分化过程和分化进程的调节[21]。基于此,本研究对沉默YAP1及顺铂干预后,不同组别胃癌细胞中YAP1及其下游相关基因和蛋白的表达水平进行检测,结果发现,感染Lv-shRNA-YAP1 和顺铂干预的胃癌细胞中IGF、Akt、TGF- β 的 mRNA 和 蛋 白 相 对 表 达 量 较 低 ,Lv-shRNA-YAP1 联合顺铂干预胃癌细胞中IGF、Akt、TGF-β mRNA 和蛋白相对表达量则进一步降低,提示沉默YAP1联合顺铂干预对YAP1及其下游靶基因的调节作用更为显著,表明靶向沉默YAP1表达逆转胃癌细胞顺铂敏感性可能也下调下游IGF、Akt、TGF-β基因及蛋白表达有关。
综上所述,YAP1蛋白在胃癌细胞SGC-7901中高表达,靶向沉默 YAP1 表达可通过下调 IGF、Akt、TGF-β 表达,抑制胃癌细胞SGC-7901的增殖、迁移、侵袭,提高肿瘤细胞的顺铂敏感性。
利益冲突:作者已申明文章无相关利益冲突。

