虎杖苷对脂多糖介导的皮肤成纤维细胞损伤的保护作用
陈白烨 林博 王学明
1福建省妇幼保健院整形外科,福州 350000;2福建医科大学附属第一医院麻醉科,福州 350000
创面的修复包括炎性反应期、肉芽形成期、肉芽改建期等,该过程复杂而有序,是由多种细胞完成的,其中皮肤成纤维细胞是其中的重要组成部分[1-2]。研究证实,成纤维细胞的增值、凋亡、氧化应激等参与创面的修复过程;而抑制成纤维细胞的氧化应激及凋亡,促进其增殖可以显著促进创面的愈合[3-4]。
以往研究中证实,虎杖苷可以显著促进大鼠创伤皮肤愈合[2],但机制尚不清楚;虎杖苷可以改善脓毒症大鼠器官损伤中细胞凋亡、氧化应激及炎性反应[5-6]。因此,2021 年1 月至4 月,本研究探讨虎杖苷对脂多糖(LPS)介导的皮肤成纤维细胞损伤的保护作用。
1 材料与方法
1.1 主要材料及试剂 人皮肤成纤维细胞购于上海赛佰慷生物科技有限公司;丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒及细胞增殖检测试剂盒(CCK-8)购于上海碧云天生物科技有限公司。肿瘤坏死因子(TNF)-α 及白介素(IL)-6 酶联免疫吸附剂测定(ELISA)试剂盒购于Abclonal 生物科技有限公司。末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记测定法[terminal dexynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL]凋亡检测试剂盒购于南京凯基生物有限公司。
1.2 细胞培养及分组 人皮肤成纤维细胞接种于含10%胎牛血清的DMEM 培养基中,在37 ℃及5% CO2下培养,待细胞生长至融合度达80%以上后传代。参照文献[7],以5 mg/L LPS 刺激皮肤成纤维细胞建立实验模型,培养72 h后检测相关指标。
细胞随机分为4 组:正常对照组细胞接受正常培养处理;药物对照组细胞接受 50 µmol/L 虎杖苷处理[8];实验组细胞接受5 mg/L LPS 处理;治疗组细胞接受5µg/ml LPS 及50µmol/L虎杖苷处理。
1.3 MDA 含量测定 收集细胞并裂解,参照说明书配置试剂盒工作液,95 ℃水浴反应60 min,酶标仪检测532 nm吸光值。
1.4 SOD 检测 收集细胞并裂解,参照说明配置试剂盒工作液,37 ℃孵育20 min,酶标仪检测560 nm处吸光值。
1.5 细胞活力检测 按照实验设计收集各组细胞至96 孔板,每孔加入 10 µl CCK-8 工作液,孵育 2 h 后酶标仪检测450 nm处吸光度值。
1.6 凋亡细胞检测 细胞经4%多聚甲醛固定,1%Triton X-100 通透,3% H2O2封闭后,与试剂盒中工作液(按说明配置)避光反应60 min,以hoechst 标记细胞核,FITC 二抗标记TUNEL 阳性细胞,在荧光显微镜下计数细胞凋亡率。
1.7 细胞培养液炎症因子检测 取细胞培养液,离心后取上清,参照说明书方法,ELISA 检测TNF-α 及IL-6水平。
1.8 统计学处理 应用SPSS 20.0软件进行统计分析,符合正态分布的计量资料以均数±标准差()表示,组间比较使用单因素方差分析(one-way ANOVA)和LSD 多重比较法,P<0.05为差异有统计学意义。
2 结 果
2.1 虎杖苷对成纤维细胞活力及凋亡的影响 与正常对照组比较,实验组细胞活力显著下降,凋亡率显著增加(均P<0.05);与实验组比较,治疗组细胞活力显著增加,凋亡率显著下降(均P<0.05)。见表1。
表1 虎杖苷对成纤维细胞活力及凋亡的影响(%,)

表1 虎杖苷对成纤维细胞活力及凋亡的影响(%,)
注:正常对照组细胞不接受任何处理;药物对照组细胞接受50µmol/L虎杖苷处理;实验组细胞接受5 mg/L脂多糖处理;治疗组细胞接受5 mg/L 脂多糖及50 µmol/L 虎杖苷处理;与对照组比较,aP<0.05;与实验组比较,bP<0.05
细胞凋亡0.50±0.02 0.70±0.02 12.70±0.11a 7.50±0.08ab 3 870.51<0.01正常对照组药物对照组实验组治疗组F值P值6 6 6 6 100.00±2.30 101.00±2.50 78.00±5.90a 89.00±7.50ab 33.62<0.01组别n 细胞活力
2.2 虎杖苷对成纤维细胞氧化应激的影响 与正常对照组比较,实验组细胞SOD 含量显著下降,MDA 含量显著增加(均P<0.05);与实验组比较,治疗组细胞SOD 含量显著增加,MDA含量显著下降(均P<0.05)。见表2。
表2 虎杖苷对成纤维细胞氧化应激的影响()
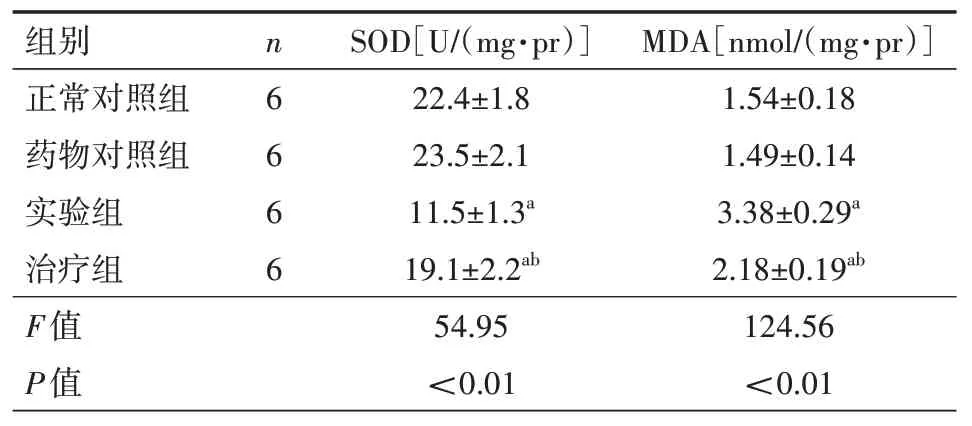
表2 虎杖苷对成纤维细胞氧化应激的影响()
注:正常对照组细胞不接受任何处理;药物对照组细胞接受50 µmol/L 虎杖苷处理;实验组细胞接受5 mg/L 脂多糖处理;治疗组细胞接受5 mg/L脂多糖及50µmol/L 虎杖苷处理;MDA 为丙二醛,SOD 为超氧化物歧化酶;与对照组比较,aP<0.05;与实验组比较,bP<0.05
MDA[nmol/(mg·pr)]1.54±0.18 1.49±0.14 3.38±0.29a 2.18±0.19ab组别正常对照组药物对照组实验组治疗组n 6 6 6 6 SOD[U/(mg·pr)]22.4±1.8 23.5±2.1 11.5±1.3a 19.1±2.2ab 124.56<0.01 F值P值54.95<0.01
2.3 虎杖苷对成纤维细胞炎性反应的影响 与正常对照组比较,实验组细胞培养基中TNF-α 及IL-6 含量显著增加(均P<0.05);与实验组比较,治疗组细胞培养基中TNF-α及IL-6含量显著下降(均P<0.05)。见表3。
表3 虎杖苷对成纤维细胞炎性反应的影响(ng/L,)

表3 虎杖苷对成纤维细胞炎性反应的影响(ng/L,)
注:正常对照组细胞不接受任何处理;药物对照组细胞接受50 µmol/L 虎杖苷处理;实验组细胞接受5 mg/L 脂多糖处理;治疗组细胞接受 5 mg/ml 脂多糖及 50 µmol/L 虎杖苷处理;TNF-α 为肿瘤坏死因子-α,IL-6 为白介素-6;与对照组比较,aP<0.05;与实验组比较,bP<0.05
IL-6 38.4±3.1 35.9±2.8 784.4±49.6a 518.5±42.2ab 905.06<0.01组别正常对照组药物对照组实验组治疗组F值P值n6 6 6 6 TNF-α 53.5±4.6 63.2±6.5 483.5±38.4a 283.6±25.3ab 622.64<0.01
3 讨 论
创面愈合过程主要包括炎症期、增殖期和修复期3 个时期[2]。炎性反应通过影响创面细胞增殖及创面重塑,在创面愈合过程中发挥重要作。大量研究证实,炎性反应通过影响成纤维细胞的活动,介导炎症因子的产生等多方面延缓创面愈合。王永祥和王春燕[9]证实,LPS抑制成纤维细胞增殖,并诱导其释放炎症因子。万立等[10]报道,LPS 通过抑制成纤维细胞增殖,导致烧伤创面瘢痕愈合或不愈合。因此,在许多研究中,主要通过LPS 刺激成纤维细胞,建立创面愈合炎症期细胞模型[7]。本研究通过LPS 刺激皮肤成纤维细胞,发现与上述研究相符的研究结果,证实LPS 可以显著抑制成纤维细胞增殖,并诱导大量炎症因子产生,包括TNF-α 及IL-6。而在创面愈合过程中,炎症因子通过影响细胞分化,活化炎症细胞,抑制内皮细胞及血管生成,从而导致瘢痕愈合或延缓创面愈合[11]。
大量研究证实,细胞凋亡参与了创面的愈合[3,12]。有研究报道,在炎症因子刺激下,内皮祖细胞动员减少,血管生成能力下降,成纤维细胞凋亡增加,迁移和增殖能力下降,进而导致创面愈合延缓,而通过对细胞分型发现,成纤维细胞的凋亡更加明显[13]。研究证实,氧化应激参与皮肤的衰老及创面的愈合,抑制氧化应激可以显著促进创面愈合[4,14]。大量研究还证实,氧化应激是介导炎性反应及细胞凋亡的重要因素[15-16],其可能通过诱导炎症因子释放及细胞凋亡参与创面愈合。本研究证实,LPS 可以诱导成纤维细胞凋亡及氧化应激水平增加。在我们以往的研究中证实,虎杖苷可以显著促进大鼠创面愈合[2],但机制尚未阐述清楚。在本研究中,我们证实虎杖苷可以显著减轻成纤维细胞氧化应激、炎性反应及细胞凋亡,促进细胞增殖。
综上,本研究推测虎杖苷可能通过抑制成纤维细胞氧化应激、炎性反应及凋亡,促进细胞增殖,从而促进创面愈合,但其作用靶点及机制仍需进一步的探讨。
利益冲突:作者已申明文章无相关利益冲突。

