沉默circPVT1对5-氟尿嘧啶耐药胃癌细胞化疗增敏作用及机制研究
左兴盛,宋志玉,贾海盼,付中华,王振基,马培志
(1.河南省人民医院药学部,郑州大学人民医院药学部,郑州450003;2.郑州大学药学院,郑州450000)
胃癌作为最常见的恶性肿瘤之一,是全球癌症死亡的第二大主要原因[1]。尽管目前在胃癌化疗和靶向治疗方面卓有成效,但胃癌的预后仍不容乐观,原发或继发性耐药是胃癌化疗失败的主要原因[2]。5-氟尿嘧啶(5-fluorouracil,5-FU)作为临床常用的化疗药物,因其对多种癌症的抗肿瘤作用而闻名,包括胃癌。然而,临床上胃癌患者对5-FU也产生了不同程度的耐药,导致临床疗效不佳[3]。5-FU耐药性产生的机制目前尚未明确。环状RNA(circular RNA,circRNA)是一类缺少5′和3′末端,由共价键形成闭合环状的非编码RNA。circRNAs在真核生物内的含量丰富,已被证明能够参与调控肿瘤的发生、转移及耐药性[4-5]。环状RNA PVT1(circPVT1)来源于致癌基因PVT1基因的外显子2,位于染色体8q24。研究表明,circPVT1与多种癌症的发生、发展密切相关[6-7]。Chen等[8]发现,circPVT1在胃癌患者肿瘤组织中的表达上调,可作为胃癌的一种新型增殖因子和预后标志物。近来研究显示,circPVT1参与肿瘤细胞对化疗药物的敏感性[9]。然而,circPVT1是否参与调节胃癌细胞对5-FU的化学敏感性尚不清楚。因此,本研究通过构建5-FU耐药的胃癌细胞,探讨circPVT1对胃癌5-FU耐药细胞株的增殖和凋亡的影响及其可能的分子机制,为寻找耐药逆转剂的研究提供一定参考意义。
1 材料与方法
1.1 一般资料 收集2017—2018年在河南省人民医院进行外科手术切除且经病理确认为胃癌患者29例,年龄28~64岁(中位年龄为51岁;平均年龄为48.6岁)。所有患者术前接受以5-FU为基础的化学治疗,根据患者对化疗药物5-FU的敏感性,将其分为5-FU敏感组(n=22)和5-FU耐药组(n=7)。患者在接受术前化疗前未接受过任何放疗或免疫治疗且均在接受治疗前签署知情同意书。胃癌组织切除后立即使用液氮处理,后置于-80℃冰箱中保存。本研究已取得医院伦理委员会批准。
1.2 主要材料 胃癌细胞BGC823购自上海中科院细胞库,si-NC、si-circPVT1-1和si-circPVT1-2购自上海吉玛制药技术有限公司,Bcl-2、Bax、caspase-3抗体购自美国Novus公司,TUNEL细胞凋亡检测试剂盒-POD(20T)购自武汉博士德生物工程有限公司,CCK-8试剂盒购自日本Dojindo公司,Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。
1.3 BGC823细胞的培养与BGC823/5的构建BGC823细胞置于含10%胎牛血清的RPMI-1640培养基中在37°C、5%CO2培养箱中培养。采用浓度梯度法建立5-FU耐药胃癌细胞株BGC823/5-FU。取对数生长期的BGC823细胞置于含有0.1μmol/L 5-FU的RPMI-1640培养基中培养3 d,随后转移至不含5-FU的培养基中培养至70%融合。取对数生长期的细胞分瓶传代,并给予2倍浓度的5-FU继续培养。以这种方式逐渐增加5-FU的剂量,直至BGC823细胞可以在含有1.0μmol/L 5-FU的RPMI-1640培养基中稳定生长。经过长达12个月的培养,获得可以在含有1.0μmol/L 5-FU的RPMI-1640培养基中良好生长的BGC823/5-FU细胞。
1.4 细胞转染 按照Lipofectmine2000使用说明书,分别将si-NC、si-circPVT1-1和si-circPVT1-2转染至BGC823/5-FU细胞中,将BGC823/5-FU细胞置于含有16μmol/L 5-FU的培养基中培养24、48、72 h。将细胞分为4组,分别为Control组、5-FU组、5-FU+si-NC组、5-FU+si-circPVT1组。收集细胞用于后续实验。
1.5 RT-PCR检测目的基因的表达 使用TRIzon提取试剂提取总RNA,使用One Step TB GreenTMPrimeScriptTMRT-PCR Kit(Perfect Real Tim)试剂盒进行RT-PCR检测。以GAPDH为内参,采用2-ΔΔCt法计算mRNA的表达量,引物序列:circPVT1上游5′-GGTTCCACCAGCGTTATTC-3′,下游5′-CAACTTCCTTTGGGTCTCC-3′;Bcl-2上游5′-CTACAGTGATGTCTCCATCC-3′,下游5′-AAAGCCTCAATGCCTGTCTC-3′;Bax上游5′-TGAACCCTAAGGCCAACCGTG-3′,下游5′-GCTCATAGCTCTTCTCCAGGG-3′;caspase-3上游5′-GAACTGGACTGTGGCATTGA-3′,下游5′-TGTCGGCATACTGTTTCAGC-3′;GAPDH上游5′-AATGGGCAGCCGTTAGGAAA-3′,下游5′-TGAAGGGGTCATTGATGGCA-3′。反应体系10μL,反应条件:95℃变性5 s,60℃退火30 s,扩增40个循环。
1.6 CCK-8检测细胞增殖 稀释BGC823/5-FU细胞设置6个细胞浓度梯度(0.625×103/孔、1.25×103/孔、2.5×103/孔、5.0×103/孔、1.0×104/孔、2.0×104/孔),每组4个复孔;接种于96孔板中,并加入CCK-8试剂10μL,继续培养3 h后,在450 nm处测OD值并制作标准曲线。根据标准曲线确定BGC823/5-FU细胞的接种数量以及加入CCK-8试剂后所需的孵育时间。将BGC823/5-FU细胞置于含有不同浓度(0、1、2、4、8、16和32μmol/L)5-FU的培养基中培养48 h,按照CCK-8试剂盒操作说明检测各组的细胞活性。
1.7 克隆形成实验测定细胞增殖能力 取对数生长期的细胞0.25%胰蛋白酶消化,制作混悬液后梯度倍数稀释,并分别接种于含有10 mL培养液的培养皿中,37℃下培养。多聚甲醛固定后结晶紫染色,计算克隆形成率=(克隆数/接种细胞数)×100%。
1.8 TUNEL检测细胞凋亡 收集BGC823/5-FU细胞,PBS溶液漂洗1次,使用多聚赖氨酸处理玻片,多聚甲醛固定细胞后,向玻片上加入准备好的标记缓冲液,37℃条件下标记2 h,封闭液及地高辛抗体稀释以后DAB染色,显色20 min后,苏木素复染后脱水,透明,封片,在荧光显微镜下观察染色的细胞,拍照并计数。
1.9 Western印迹检测目的蛋白的表达 使用哺乳动物蛋白抽提试剂盒(CW0889M)提取BGC823/5-FU细胞的总蛋白质,使用BCA蛋白定量试剂盒(CW0014)检测从BGC823/5-FU细胞中提取的总蛋白质的浓度。SDS-PAGE分离总蛋白后,将蛋白转移至硝酸纤维素膜上。将膜用5%脱脂牛奶封闭2.5 h后,加入相应的一抗于4℃下孵育过夜。次日,经TVST洗涤后,将膜与二抗于37℃下孵育60 min。采用增强化学发光试剂ECL显影液于暗室中进行显影。以β-actin作为内参分析目标蛋白的表达水平。
1.10 Annexin V-FITC细胞凋亡检测试剂盒检测细胞凋亡 收集BGC823/5-FU细胞,用0.25%胰蛋白酶消化,制成细胞悬浮液,离心后加入195μL Annexin V-FITC结合液重悬细胞,加入5μLAnnexin V-FITC,再加入10μL碘化丙啶染色液,室温条件下避光孵育20 min,使用流式细胞仪分析凋亡细胞。
1.11 裸鼠移植瘤模型 雌性BALB/c裸鼠12只(5周龄,18~20 g)购自北京维通利华实验动物技术有限公司。实验动物在郑州大学实验动物中心饲养,实验动物的处置符合伦理学标准。将裸鼠适应性喂养1周后,随机分为3组,每组4只:5-FU组、5-FU+si-NC组、5-FU+si-circPVT1组。根据对应的分组,分别将转染si-NC或si-circPVT1的BGC823/5-FU细胞于裸鼠右侧背部皮下移植。每只小鼠通过尾静脉注射5-FU(10 mg/kg)进行治疗,每周注射1次,共进行4次注射[10]。观察注射5-FU后测量裸鼠瘤体的长(a)和短(b)直径,并根据公式:V(mm3)=ab2/2计算移植瘤体积。给药4周后处死裸鼠,剥离移植瘤组织并称重。
1.12 统计学处理 利用SPSS20.0统计分析软件进行统计分析。符合正态分布的计量资料数据以±s表示。采用单因素方差分析比较分析组间差异,P<0.05为差异具有统计学意义。
2 结果
2.1 circPVT1在胃癌组织和细胞系中的表达 RTPCR结果显示,circPVT1在5-FU耐药患者胃癌组织中的表达水平明显高于5-FU敏感患者,差异具有统计学意义(P<0.01,图1A)。此外,circPVT1表达水平在BGC823/5-FU细胞中显著高于BGC823细胞(P<0.001,图1B)。
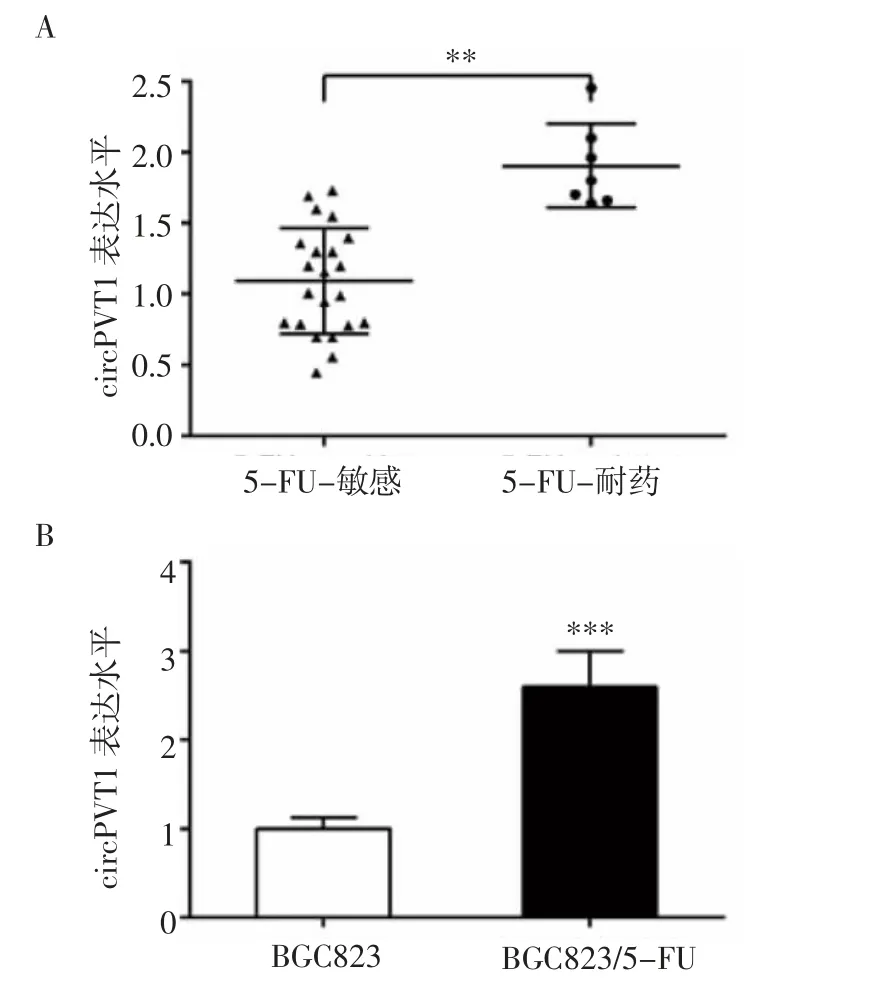
图1 circPVT1在胃癌组织和癌细胞中的表达水平Fig 1 Expression of circPVT1in gastric cancer tissuesand cancer cells
2.2 沉默circPVT1促进5-FU对BGC823/5-FU细胞的增殖抑制作用 si-circPVT1-1和si-circPVT1-2转染BGC823/5-FU细胞48 h后,RT-PCR检测发现,BGC823/5-FU细胞中circPVT1的表达水平显著降低(P<0.001),且si-circPVT1-1组中circPVT1的表达水平低于si-circPVT1-2组(P<0.001),因此,在后续实验中使用si-circPVT1-1沉默circPVT1的表达(图2A)。使用CCK-8试剂盒检测细胞活性,标准曲线如图2B所示。将BGC823/5-FU细胞置于含有不同浓度(0、1、2、4、8、16和32μmol/L)5-FU的培养基中培养48 h,利用CCK-8试剂盒分析各组的细胞活性。结果显示,BGC823/5-FU细胞活性随5-FU浓度的升高而降低(P<0.001,图2C)。而沉默circPVT1后,CCK-8实验结果发现,5-FU+si-circPVT1组BGC823/5-FU细胞的活性明显低于5-FU+si-NC组(P<0.05,图2D)。克隆形成实验结果发现,5-FU处理可以抑制细胞的克隆形成能力。与5-FU+si-NC组相比,5-FU+si-circPVT1组BGC823/5-FU细胞的克隆形成能力明显降低(P<0.05,图2E)。

图2 沉默circPVT1促进5-FU对BGC823/5-FU细胞的增殖抑制作用Fig 2 Silencing circPVT1 promotestheinhibition roleof 5-FUon theproliferation of BGC823/5-FUcells
2.3 沉默circPVT1增强5-FU对BGC823/5-FU细胞的凋亡促进作用 TUNEL实验结果表明,与对照组相比,5-FU组BGC823/5-FU细胞的凋亡数目明显上升(P<0.001)。5-FU+si-circPVT1组BGC823/5-FU细胞的凋亡数目明显高于5-FU+si-NC组(P<0.01,图3A)。5-FU组BGC823/5-FU细胞的凋亡率明显高于对照组(P<0.001)。与5-FU+si-NC组相比,5-FU+si-circPVT1组BGC823/5-FU细胞的凋亡率明显升高(P<0.01,图3B)。

图3 沉默circPVT1增强5-FU对BGC823/5-FU细胞的凋亡促进作用Fig 3 Silencing circPVT1 enhances the promotion effect of 5-FU on theapoptosisof BGC823/5-FU cells
2.4 沉默circPVT1对Bcl-2、Bax和 caspase-3 mRNA表达水平的影响 RT-PCR结果表明5-FU处理可以下调Bcl-2的表达,上调Bax和caspase-3的表达。与5-FU+si-NC组相比,5-FU+si-circPVT1组BGC823/5-FU细胞中Bcl-2的mRNA表达水平明显降低(P<0.01,图4A),Bax和caspase-3的mRNA表达水平明显升高(P<0.01,图4B、4C)。

图4 沉默circPVT1对Bcl-2、Bax和caspase-3 mRNA表达水平的影响Fig 4 Theeffect of silencing circPVT1 on theexpression levelsof Bcl-2,Bax,and caspase-3 mRNAs
2.5 沉默circPVT1对Bcl-2、Bax和caspase-3蛋白表达水平的影响 Western印迹结果表明,5-FU处理可以下调Bcl-2的表达,上调Bax和caspase-3的表达。与5-FU+si-NC组相比,5-FU+si-circPVT1组BGC823/5-FU细胞中Bcl-2的蛋白表达水平明显降低,Bax和caspase-3的蛋白表达水平明显升高(P<0.01,图5)。

图5 沉默circPVT1对Bcl-2、Bax和caspase-3蛋白表达水平的影响Fig 5 Theeffect of silencing circPVT1 on theexpression levelsof Bcl-2,Bax,and caspase-3 proteins
2.6 沉默circPVT1抑制裸鼠BGC823/5-FU移植瘤生长裸鼠移植瘤实验 结果显示,5-FU+sicircPVT1组移植瘤体积(图6A)和质量(图6B)均小于5-FU+si-NC组,差异均具有统计学意义(均P<0.05)。

图6 沉默circPVT1抑制裸鼠BGC823/5-FU移植瘤的生长Fig 6 Silencing circPVT1 inhibitsgrowth of BGC823/5-FU xenograftsin nudemice
3 讨论
胃癌是最常见的消化道恶性肿瘤之一,以5-FU为基础的化疗是胃癌患者手术后辅助化疗以及中晚期胃癌患者的标准治疗方案[11]。然而,由于对5-FU产生原发性或获得性耐药性,部分胃癌患者在化疗后仍会发生肿瘤复发和转移,导致预后不良。探寻与5-FU化疗敏感性相关的分子机制对改善胃癌患者的预后具有重要意义。本研究发现沉默circPVT1可以增强胃癌细胞对5-FU的化疗敏感性,其机制可能是通过调控Bcl-2、Bax和caspase-3的表达以促进细胞凋亡。
circRNA是一类参与转录和转录后基因表达调节的非编码RNA。多项研究表明,circRNA的异常表达在包括胃癌在内的多种肿瘤的发生、发展中起重要作用[12-13]。目前研究认为,circRNA有望成为肿瘤诊断的生物标志物和治疗的新靶点[14-15]。此外,circRNA在肿瘤耐药中的作用也受到广泛关注[16]。Zhou等[7]发现,hsa_circ_0004015可以通过调控miR-1183/PDPD1轴来影响埃克替尼耐药非小细胞肺癌细胞对化疗药物的敏感程度。徐飞等[17]研究也证实,抑制circ_MIHFD2的表达可增强细胞对培美曲塞的敏感性。circPVT1也称之为circ6,是新近被证实与肿瘤发生、发展和耐药性相关的基因[9,18]。Chen等[8]通过分析胃癌组织和癌旁正常组织发现5 500个circRNAs在胃癌组织中差异表达,其中circPVT1在胃癌组织中的表达显著升高,并提出circPVT1可以独立作为预测胃癌患者预后的生物标志物。此外,他们还发现circPVT1序列上包含多个miR-125b的结合位点,可以作为miR-125b的“海绵”,促进MGC-803和AGS细胞的增殖。此外,有研究发现circPVT1在肿瘤细胞化疗耐药性的产生和发展过程中起关键作用[9,19]。沉默circPVT1可以增强骨肉瘤细胞对阿霉素和顺铂的敏感性[9]。Chen等[20]发现,circPVT1敲低能够增强顺铂对非小细胞肺癌耐药细胞A549/DDR活力的抑制作用和凋亡的诱导作用。然而,circPVT1对5-FU耐药胃癌细胞的影响尚不清楚。本研究发现,circPVT1在5-FU耐药患者胃癌组织中的表达水平明显高于circPVT1在5-FU敏感患者胃癌组织中的表达水平。与此一致,在胃癌5-FU耐药细胞株BGC823/5-FU中,circPVT1的表达明显增加。这些结果提示circPVT1表达的上调可能与胃癌患者对5-FU的耐药性有关。为进一步观察circPVT1在胃癌细胞对5-FU耐药中的可能作用,本研究将靶向circPVT1的siRNA转染至胃癌耐药细胞株BGC823/5-FU中,并通过CCK-8和克隆形成实验分析circPVT1沉默对耐药细胞增殖的影响。结果发现,circPVT1沉默可以增强5-FU对BGC823/5-FU细胞增殖的抑制作用。此外,TUNEL和流式细胞术实验显示,circPVT1沉默能够增强5-FU对BGC823/5-FU细胞凋亡的促进作用。提示circPVT1沉默能够增加BGC823/5-FU细胞对5-FU的敏感性,达到更好的抗肿瘤效应。另外,本研究通过构建BGC823/5-FU细胞裸鼠移植瘤模型,在体内也证实沉默circPVT1可以增强BGC823/5-FU细胞对5-FU的敏感性。因此,circPVT1有望成为克服胃癌细胞5-FU耐药的治疗靶点。
鉴于大部分化疗药物主要通过诱导肿瘤细胞凋亡而发挥抗癌效应,细胞凋亡通路被认为是与耐药性相关的重要机制[21]。因此,为进一步分析circPVT1对5-FU耐药性影响的相关机制,本研究分析了凋亡相关因子的表达变化。结果发现,5-FU处理导致胃癌耐药细胞中Bcl-2的表达下调,以及Bax和caspase-3的表达上调,而沉默circPVT1可以在一定程度上增强5-FU对细胞凋亡相关因子Bcl-2、Bax和caspase-3表达的影响。因此推测,沉默circPVT1可能通过调控凋亡信号通路以增强胃癌细胞对5-FU的耐药性。
综上所述,沉默circPVT1能够在体内和体外增强胃癌细胞对5-FU的敏感性,这可能与其对细胞凋亡相关蛋白的调控作用有关。然而,circPVT1在胃癌细胞对5-FU耐药中的调控作用还有待进一步研究。

