CNTF在胃癌组织中的表达及意义
张 丹,黄 晋,赵 倩,冯 云,刘亚萍,任牡丹,卢桂芳,卢新兰,赵 艳,和水祥(西安交通大学第一附属医院消化内科,西安 7006;陕西科技大学电智学院;通讯作者,E-mail:dyyyjxk@xjtu.edu.cn)
胃癌的发病率及死亡率在恶性肿瘤中均居于比较高的位置,是严重影响人民健康的疾病之一[1]。对胃癌发病机制进行探讨,寻找能够与胃癌发生发展相关的因子,对提高胃癌的诊断与治疗有着重大的意义。睫状神经营养因子(ciliary neurotrophic factor,CNTF)因其生理功能被归属于神经营养因子家族成员。近年来发现多种神经营养因子与非神经系统肿瘤的发生发展相关[2]。CNTF也被证实是骨髓瘤、肝癌的相关因子[3,4]。CNTF因蛋白结构特征也属于白介素-6(interleukin-6,IL-6)家族,可以激活多条IL-6家族下游通路,包括JAK/STAT3、Ras/MAKP以及PI3K/AKT等[5]。这些通路是经典的肿瘤相关通路,参与包括胃癌在内多种肿瘤形成过程以及侵袭转移行为[6-8]。IL-6家族其他成员包括IL-6、IL-11、白血病抑制因子也被证实与胃癌等肿瘤的发生发展相关[9-11]。综上,有理由推测CNTF可能与胃癌发生发展相关,本研究使用免疫组化法检测CNTF在胃癌及其形成过程中的表达,并评估表达与预后的关系。
1 资料与方法
1.1 资料来源
胃癌及癌旁组织选自2011年8月至2012年11月于西安交通大学第一附属医院经手术切除病理确诊胃癌患者共140例。其中男性103例,女性37例,中位年龄65岁。收集患者的相关一般信息及临床病理信息,包括性别、发病年龄、病史、肿瘤部位、分级分型、相关治疗、复发转移、死亡情况等。纳入标准:孩首次诊治,未经化疗、放疗或其他肿瘤相关生物学治疗处理;虎标本组织学分类、肿瘤分期明确;虎患者或其委托人知情同意;虎术后依照指南行规范化治疗。排除标准:孩曾行肿瘤相关放化疗、免疫治疗;虎有严重心、肺、肝、肾等重要脏器功能不全者;虎不配合规范化治疗、随访者。
病变胃黏膜组织选自2011年8-12月于西安交通大学第一附属医院行胃镜检查并行内镜下活检患者。中国慢性胃炎共识意见指出:慢性萎缩性胃炎与胃癌发病率呈正相关;上皮内瘤变是胃癌最重要的癌前病变[12]。因此分类收集慢性非萎缩性胃炎10例,慢性萎缩性胃炎20例,上皮内瘤变14例。经患者或其委托人知情同意后收集相关一般信息。所有标本经由两名以上病理医师行病理学诊断。
1.2 方法
对所收集组织采用免疫组化法检测CNTF的表达,表达量采用免疫组化评分进行表示。
1.2.1 免疫组化 所有组织标本使用4%多聚甲醛固定,常规梯度酒精脱水,二甲苯透明,石蜡包埋后行4 μm连续切片。免疫组化实验步骤参照SP免疫组化检测试剂盒(博奥森,中国)说明书。切片60 ℃烘烤过夜后置于二甲苯中脱蜡,常规梯度酒精水化。采用高温高压抗原修复,山羊血清工作液封闭后,滴加1 ∶1 000稀释兔抗人CNTF多克隆抗体(Abcam,英国)37 ℃孵育2 h,洗涤后加入生物素标记山羊抗兔IgG工作液,后滴加辣根酶标记链霉素卵白素工作液。DAB显色,苏木素复染细胞核,常规梯度酒精脱水,中性树胶封片。
1.2.2 组化评分 显微镜下观察切片,统计染色得分,具体方法[13]如下:着色细胞占总细胞比例0%,0%-10%,10%-50%,50%-80%,80%以上分别记0,1,2,3,4分;着色强度记为1分(浅着色),2分(中等着色)以及3分(强着色);将着色细胞数量比例得分与着色强度得分相乘所得即为染色得分。一个标本中任选5个高倍视野进行统计,最终该标本染色得分为5个分数均值。得分<6视为低表达,≥6分视为高表达。
1.3 随访及评价指标
以手术日为起始,采取电话、门诊方式随访,频率为每月1次。观察终点为死亡。评价指标包括无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)。随访时间为1-88个月,中位随访时间35个月。因其他原因死亡及失访视为截尾数据,共12例。
1.4 统计方法
统计采用SPSS19.0软件(SPSS,美国)行统计学分析。经检验资料数据符合正态分布,定量资料采用均数±标准差表示,癌组织与相应癌旁组织组间比较采取配对样本t检验,慢性非萎缩性胃炎、慢性萎缩性胃炎组间比较采用独立样本t检验,慢性胃炎、上皮内瘤变、胃癌组间比较采用方差分析。定性资料以例数表示。生存曲线使用Kaplan-Meier法绘制,并使用log-rank检验比较生存率。多因素分析采用Cox回归模型。检验水准α=0.05。
2 结果
2.1 CNTF在胃癌及不同病变胃黏膜组织中的表达
CNTF表达位置位于胞浆,表现为棕黄色云雾状或颗粒(见图1)。CNTF在胃癌及不同病变胃黏膜组织中的表达量见表1。其中慢性非萎缩性胃炎和萎缩性胃炎组织组化评分组间比较差异未发现统计学意义(t=-0.201,P>0.05)。慢性胃炎、胃黏膜上皮内瘤变、胃癌组织的组化评分经检验发现组间差异有统计学意义(F=21.026,P<0.05)。两两比较发现,胃癌组的组化评分高于胃黏膜上皮内瘤变组及胃炎组(P<0.05),但慢性胃炎及上皮内瘤变组间差异未提示统计学意义(P>0.05)。胃癌组组化评分高于相应癌旁组织(t=11.006,P<0.05)。
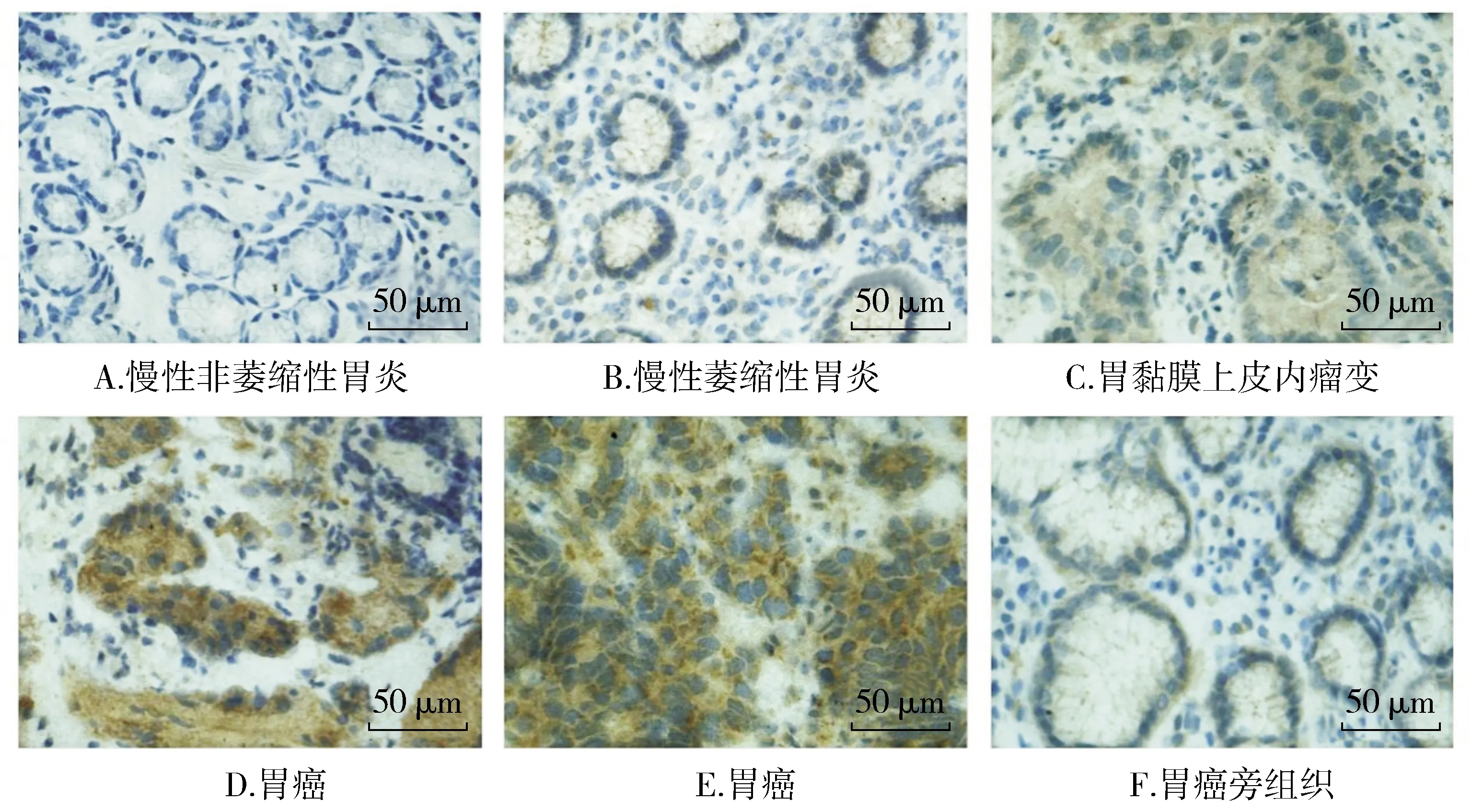
图1 CNTF在慢性非萎缩性胃炎、慢性萎缩性胃炎、胃黏膜上皮内瘤变、胃癌、胃癌旁组织中的表达Figure 1 Expression of CNTF in chronic non-atrophy gastritis, chronic atrophy gastritis, gastric epithelial neoplasia, gastric cancer, corresponding precancerous tissues
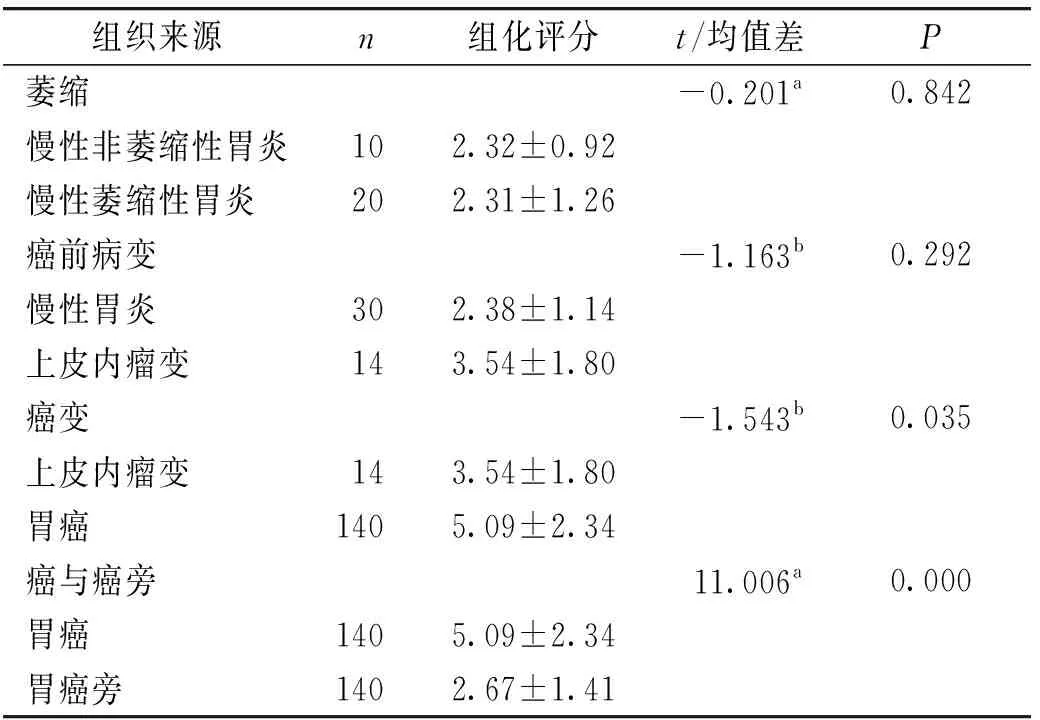
表1 CNTF在胃癌及不同病变胃黏膜组织中的表达分析Table 1 Analysis of CNTF expression in gastric cancer and different gastric mucosa
2.2 CNTF表达与胃癌临床病理特征的关系
CNTF的表达与胃癌病人年龄、性别未见明显统计学关联;与病理分级、浸润深度、淋巴结转移、远处转移、TNM分期有一定关系(见表2)。
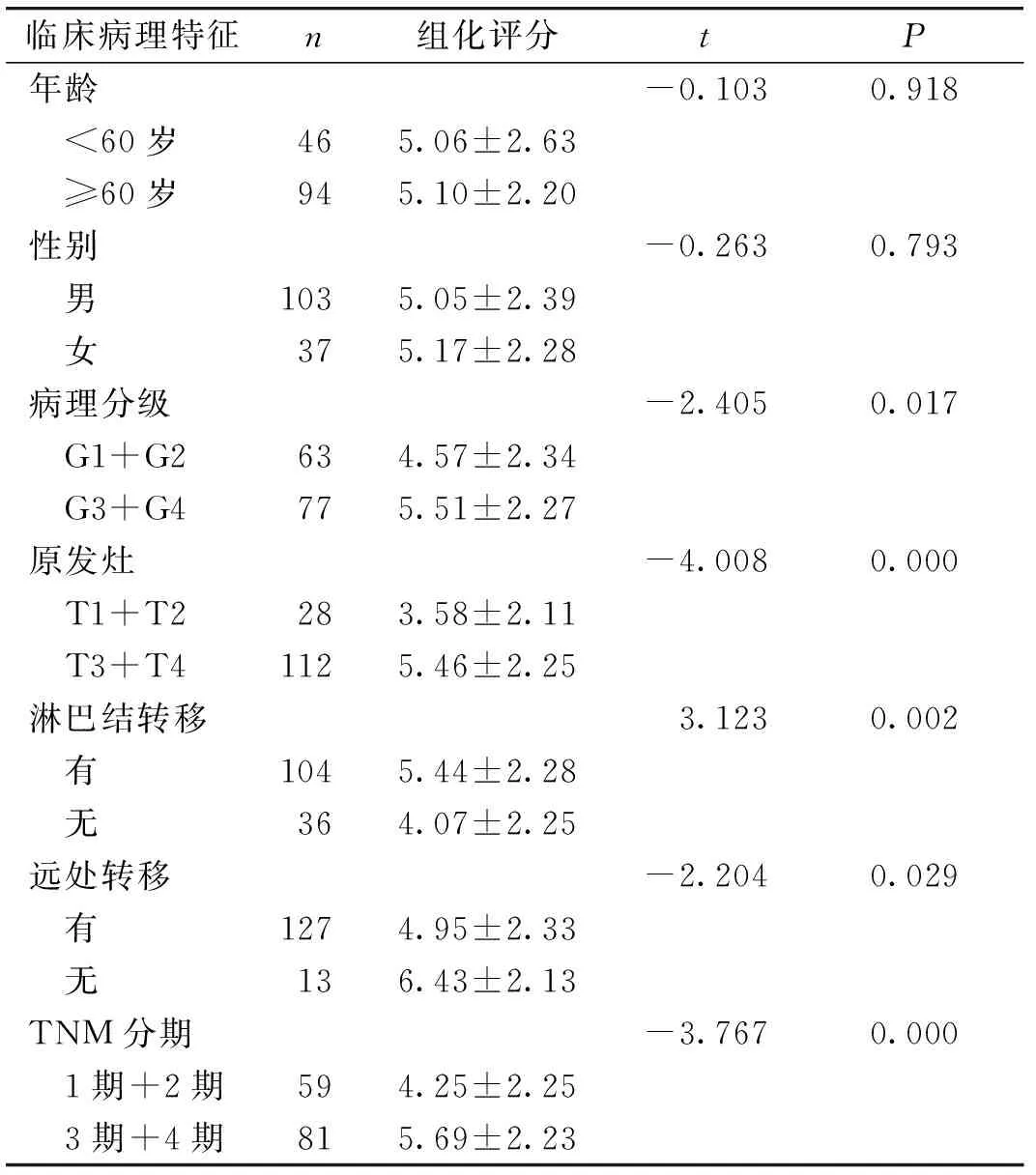
表2 CNTF表达与胃癌临床病理特征的关系分析Table 2 Correlation between CNTF expression and clinical pathological characteristics of gastric cancer
2.3 生存分析
对胃癌病理随访时间1-88月,中位随访时间35月。入组病例1年生存率82.8%,2年生存率67.2%,3年生存率48.3%,5年生存率30.5%,至随访结束存活率23.4%。术后中位生存时间在CNTF阴性组为46月,在CNTF阳性组仅27月。CNTF阴性及阳性组Kaplan-Meier生存曲线见图2,log-rank检验提示两组间生存率差异存在统计学意义(χ2=15.157,P<0.05)。
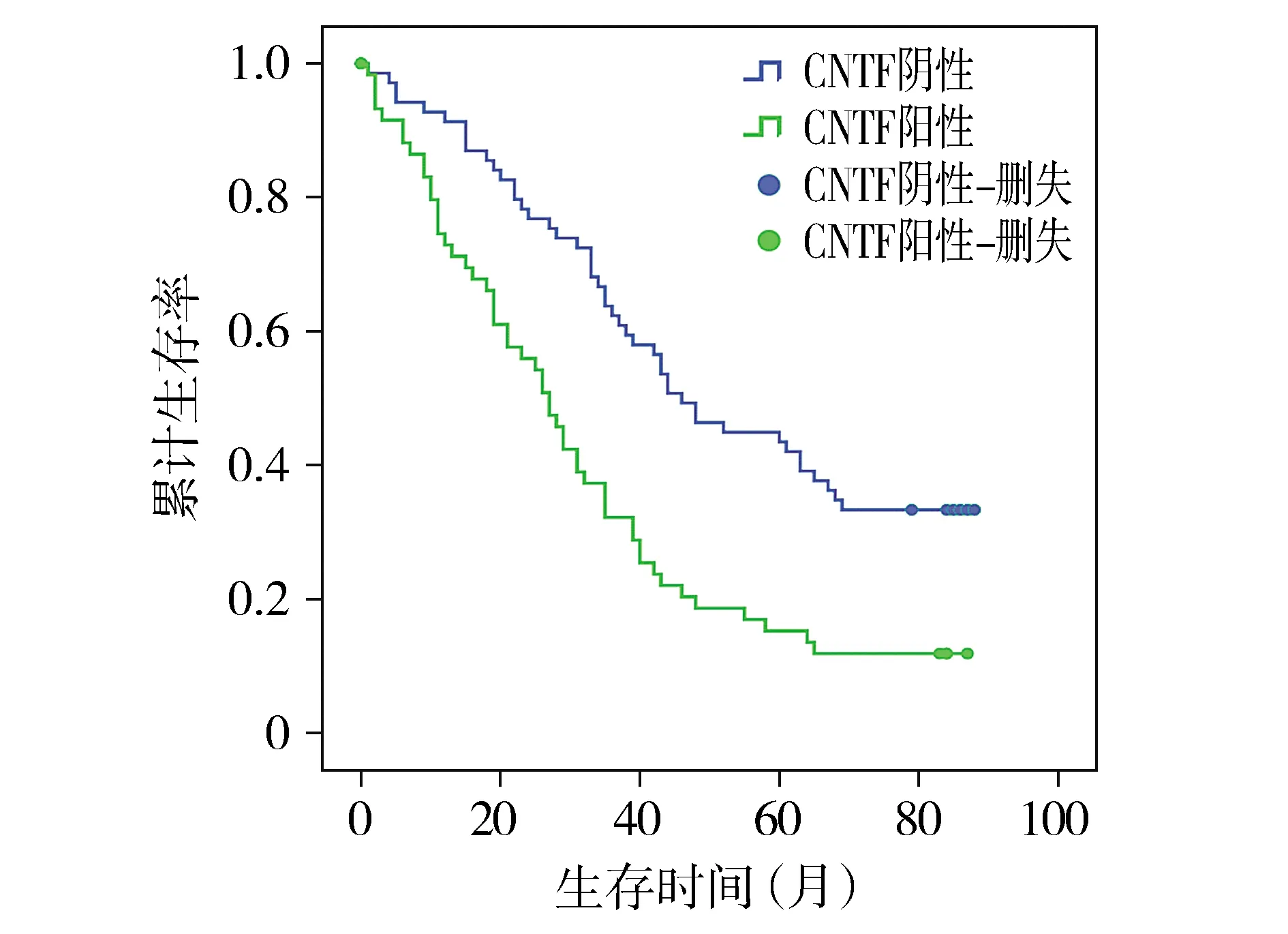
图2 CNTF不同表达胃癌患者生存曲线Figure 2 Survival curve of gastric cancer patients with different CNTF expression
多因素生存分析中,将2.2中已检验的与CNTF相关的临床病理特征包括病理分级、原发灶浸润深度、淋巴结转移、远处转移、TNM分期纳入Cox回归模型。表3结果显示,浸润深度、淋巴结转移、远处转移、TNM分期、CNTF表达均为胃癌的显著独立预后因素。
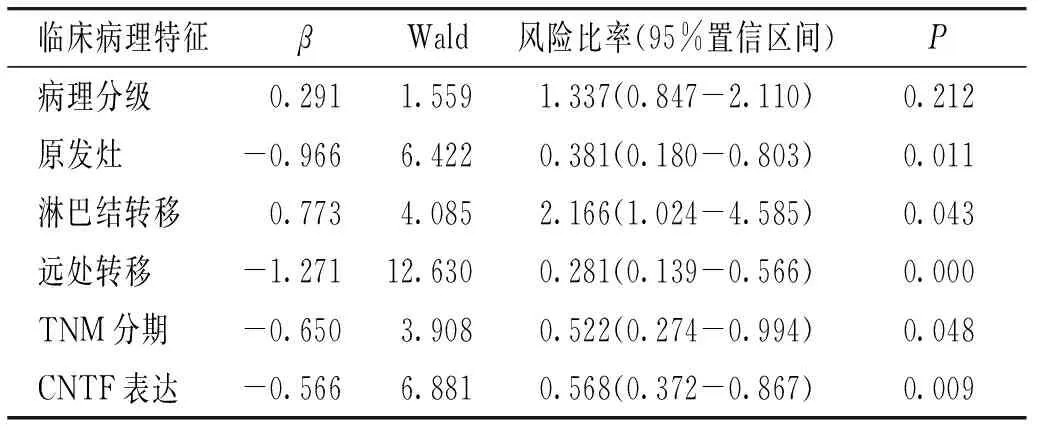
表3 胃癌患者生存时间的Cox多因素分析Table 3 Cox multi-factor analysis of survival time in patients with stomach cancer
3 讨论
肿瘤被公认为全身的系统性疾病,其发生发展可能与多项体内基因及内环境的改变相关,这过程中可能包括了神经内分泌调节系统。多个报道[14,15]显示,神经营养因子可能参与了神经对非神经系统肿瘤组织的营养作用以及神经内分泌系统对肿瘤形成环境的调节。以往关于CNTF与肿瘤的报道多集中于神经系统。Weis等[16]在多个神经胶质瘤细胞系以及人组织标本中检验CNTF以及其受体的表达,发现在所有的星状细胞瘤以及胶质母细胞瘤中,高达95%以上的肿瘤显示出CNTF阳性。
CNTF也被证实与非神经系统实体肿瘤相关。Wan等[17]在针对肝细胞癌进行大规模功能基因筛选时发现CNTF/CNTFR与肝癌生长密切相关。Hu等[4]发现CNTF/CNTFR在多种肝癌细胞里高表达,而正常肝细胞中无表达,CNTF可以在不同细胞系中激活JAK/STAT、Ras/MAPK、PI3K/AKT以及AMPK通路,继而调节肿瘤细胞糖代谢、促进肝癌细胞增殖及细胞周期改变。
CNTF因其蛋白结构隶属于IL-6家族,IL-6样细胞因子可以通过与细胞膜上含有gp130亚基的相应受体结合引发JAK-STAT途径的活化,是最重要的该通路胞外激活因子[18]。CNTF相关通路参与胃癌发生发展进程,其中的关键因子已成为胃癌靶向治疗的重要靶点。Jackson等[19]研究证实磷酸化的STAT3高表达于胃癌细胞中,推测STAT3是胃癌发生及发展的早期事件。Kanda等[20]发现,阻滞STAT3或JAK可以抑制survivin,减少细胞存活。Gong等[21]发现STAT3与VEGF在胃癌组织中有协同表达作用,也与血管生成有关。STAT3表达水平在不同肿瘤分期中有区别,证明与局部侵润、淋巴结转移与远处转移相关,影响到预后情况[6]。因此有利于推测CNTF与胃癌发生发展相关。
胃癌多具有明确的癌前状态与病变阶段,其肿瘤的发生模型可以被归纳为从慢性萎缩性胃炎等癌前疾病到癌前病变最终生成肿瘤的长达数年甚至数十年的过程[22]。因此本研究首先对不同病变的胃黏膜临床标本中CNTF进行检测。发现CNTF在慢性非萎缩性胃炎和慢性萎缩性胃炎组间表达差异不明显。在慢性胃炎及上皮内瘤变组中表达差异也不明显,但在胃癌组织中CNTF表达较慢性胃炎组织及癌前病变组织均可见显著上升,也显著高于相应癌旁组织,提示了CNTF在肿瘤发生过程中主要起到促进作用的过程,也提示了CNTF在肿瘤中表达的特异性。
在CNTF表达与胃癌临床病理特征的研究中发现,CNTF表达与年龄、性别的一般特征无明显关联。病理分级反映肿瘤恶性程度及预后,统计分析提示CNTF表达量在中高分化组低于低分化-未分化组,侧面提示了CNTF与疾病进程、预后的关联性。CNTF表达与肿瘤局部浸润、淋巴结转移、远处转移、TNM分期相关。以上因素是胃癌临床分期的决定性因素,也是代表胃癌远期预后最关键的特征,在既往的报道中,均以胃癌的独立预后因素存在[23,24]。因此提示CNTF的表达可能与肿瘤发展、转移相关,进而影响病人预后。
在进一步的生存分析中发现CNTF阳性病人生存率低于CNTF阴性病人。将影响预后及与CNTF表达相关的关键特征纳入多因素分析中,发现除肿瘤局部浸润、淋巴结转移、远处转移、TNM分期以外,CNTF表达也是影响病人预后的独立危险因素,证实了CNTF表达与胃癌预后的关系。
综上,CNTF在胃癌、不典型增生、胃炎胃黏膜中存在差异性表达;CNTF表达量与肿瘤临床病理分级分期相关,并且是胃癌的独立预后因素。提示CNTF可能参与了胃癌发生、进展、远处转移等过程,并影响疾病预后。之后的工作会通过对CNTF几条主要通路的研究继续明确其具体作用机制,挖掘CNTF可能的临床价值。

