二氧化氯对蝴蝶兰软腐病菌的抑杀作用评价——基于病害流行因子
沈会芳,张景欣,杨祁云,蒲小明,孙大元,刘平平,林壁润
(广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广州 510640)
0 引言
细菌性软腐病是蝴蝶兰的毁灭性病害,多发于叶片,受感染后叶片出现水渍状斑点。高温下病势发展快速,3天可使整叶腐烂,并向其他叶片和根部蔓延,引起全株腐烂死亡。据统计,自贵阳市引种蝴蝶兰以来,在夏秋两季,细菌性软腐病棚率82.3%、病株率52.7%、病叶率9.4%,给蝴蝶兰生产造成重大损失[1]。当前,蝴蝶兰规模化生产多采用温室栽培,蝴蝶兰生长光温需求相对较高,环境控制不当容易造成温度偏高、湿度过大、通风不良等情况,诱发软腐病的发生,因此,明确该病的发生流行条件,对病害防治有重要意义。浙江[2]、伊犁[3]和台湾[4]地区通过传统病害鉴定与分子生物方法相结合,将病菌鉴定为菊欧文氏菌(Erwinia chrysanthemi),与国外报道的一致[5]。随着对欧文氏菌研究的深入,该病菌命名产生较大变化,造成一些文献引用混乱,将同种异名混淆为不同种。菊欧文氏菌先被分类到果胶杆菌属,病菌被称为菊果胶杆菌(Pectobacterium chrysanthemi),后随着欧文氏菌属细分为5个属[6-7],蝴蝶兰软腐病菌被归为迪基氏属的Dickeya dieffenbachiae[8]。2018年,Zhang 等[9]对病菌全基因组进行分析,建议将病菌归为迪基氏属的新种D.fangzhongdai。该病蔓延速度极快,黄树钦等报道流行季节日增发病株率可达0.3%~0.8%,可迅速造成毁灭性危害[10]。蝴蝶兰主栽品种对软腐病菌的抗性较低,防治该病仍以药剂为主。以前,市场上以抗生素特别是农用链霉素为主要防治药剂,2016年最后一个农用硫酸链霉素登记证件到期,不再续展,意味着农用链霉素不再用于植物细菌病害防治,导致软腐病防治几乎无药可用,筛选新药剂成为当务之急。李艳梅等[11]选取24种对细菌有抑制作用的中草药,进行单因素与双因素的抑菌测定,结果表明乌梅-五倍子提取液1:3混合抑菌效果最好,平均抑菌圈直径为3.93 cm。尤毅等[12]在室内平板培养基上测定13种杀菌剂对病菌的抑菌活性,80%乙蒜素乳油、20%细美叶枯唑可湿性粉剂、50%氯溴异氰尿酸可溶性粉剂、1 g/100万单位硫酸链霉素和1 g/100万单位四环素对病原菌具有较强的毒力。沈会芳等[13]采用盆栽试验、杜启兰等[14]应用大棚药剂试验,报道氧氯化铜对蝴蝶兰软腐病的防治效果达70%以上。铜制剂起保护作用,铜颗粒可粘附在叶片表面,将病菌与其侵入伤口等隔开,形成物理保护屏障[15],一旦病菌侵入叶片内部,防治效果明显下降。因此,从源头控制病菌传播才是防治病害的有效手段。针对该病害发生流行条件尚不明确,缺少阻断病害传播的高效消毒剂的现状,笔者研究病害发生流行的适宜湿度、温度和侵染方式,明确病害流行条件,在此基础上评价消毒剂二氧化氯对病菌的抑杀效果,优化其消毒条件,用于农事操作中工具的消毒,以阻止病菌的传播扩散,达到从源头上控制病害、减少损失的目的。
1 材料与方法
1.1 试验时间、地点
试验于2019年3月—2020年10月在广东省植物保护新技术重点实验室进行。
1.2 试验材料
蝴蝶兰细菌性软腐病菌(D.fangzhongdai),保存于广东省农业科学院植物保护研究所。蝴蝶兰品种为‘富乐夕阳’。LB培养液:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1000 mL,pH 6.8~7.0,121℃灭菌30 min后备用。8%二氧化氯(新乡市康大消毒剂有限公司),50%溴氯海因(山西昌泰动物药业有限责任公司),61%三氯异氰脲酸片(运城市华丰生物科技有限公司),20%聚维酮碘(运城市贝尔特生物科技有限公司),高锰酸钾(分析纯,郑州中天实验仪器有限公司),20%戊二醛溶液(黑龙江省汇丰动物保健品有限公司)。
1.3 菌悬液制备及蝴蝶兰叶片采集
将病菌接种于LB培养液中,30℃摇床培养24 h,用LB培养液配成106~107cfu/mL的菌悬液,备用。用消毒剪刀剪取蝴蝶兰中下部叶片,75%酒精喷雾叶片消毒,备用。
1.4 温度和湿度对病害侵入和发展的影响
采用2种方法接种病菌。(1)针刺接种,在叶片上选取2点,每点用无菌大头针蘸菌液密集轻刺5次;(2)摩擦接种,用砂纸在叶片上摩擦后,将菌液喷雾在叶片上。处理后叶片放入磁盘保湿,温度设置24、26、28、30、32、34、36℃,恒温培养箱黑暗培养;湿度设置60%、70%、80%和90%,人工气候箱30℃黑暗培养。每处理10片叶,3次重复。24 h后测量病斑直径,记录发病面积,计算病情指数。
1.5 伤口对病害侵入的影响
(1)选取健康无伤口叶片,用砂纸在叶片上摩擦后,将菌液喷雾在叶片上。以健康叶片直接喷菌液为无伤口接菌对照,以砂纸摩擦后喷无菌水为有伤口无菌对照。喷菌液时注意遮住叶柄处伤口,防止伤口处沾上菌液。30℃保湿培养24 h后记录发病面积,计算病情指数。
(2)取无菌剪刀先剪1片病叶,再用这把剪刀连续剪去10片健康叶片顶部,同时以剪刀先剪1片健康叶片为对照;30℃保湿培养24 h后,记录叶片发病情况,计算发病率。
1.6 评价二氧化氯对病菌的抑杀作用
1.6.1 不同消毒剂对病菌的生物活性测定 取4.9 mL菌悬液加入无菌试管,加入0.1 mL不同消毒剂溶液,使消毒剂浓度为 1000、500、250、125、62.50、31.25、15.63、7.81、3.90、1.95、0 μg/mL。每处理3只试管,3次重复,30℃摇床培养,24 h后观察无细菌生长的最低浓度,即该消毒剂的最小抑菌浓度(MIC)。将LB培养基制成平板,用油性笔均匀分成8份,取上述消毒剂处理后菌液在平板上划线,30℃培养24 h,无细菌生长最低浓度,即该消毒剂的最小杀菌浓度(MBC)。
1.6.2 扫描电镜观察二氧化氯对病菌菌体形态的影响取4.9 mL菌悬液加入试管,加入0.1 mL二氧化氯溶液,使处理浓度为62.50、125 μg/mL,30℃摇床培养1 h,离心,用LB培养液冲冼菌体3次,离心保留菌体,扫描电镜处理方法参照文献[16]。
1.6.3 不同浓度二氧化氯对病菌杀菌时间测定 取4.9 mL菌悬液加入试管,加入0.1 mL二氧化氯溶液,使二氧化氯浓度分别为 1000、500、250、125、62.50、31.25、0 μg/mL,30℃摇床培养 0.5、1、2、4、8、16、32、64 min后,分别用接种环取处理后菌液在LB平板上划线,30℃培养24 h后观察病原菌生长情况。
1.6.4 离体叶片法验证二氧化氯对病菌的消毒效果 取无菌剪刀,各先剪一次病叶后,分别放入250、500 μg/mL的二氧化氯溶液中浸泡0、0.5、1、2、4、8、16、32、64 min后,取出剪刀连续剪10片健康叶片,每处理10片叶,3次重复,叶片30℃保湿培养24 h后,记录叶片发病情况。
1.7 病害分级调查标准和病情指数计算
叶片病情分级调查标准:0级,叶片无软腐症状;1级,总软腐病斑面积≤20%叶片面积;2级,20%叶片面积<病斑总面积≤40%叶片面积;3级,40%叶片面积<病斑总面积≤60%叶片面积;4级,60%叶片面积<病斑总面积≤80%叶片面积;5级,病斑总面积>80%叶片面积。

2 结果与分析
2.1 温度对病菌侵入和病害发展的影响
采用摩擦和针刺接种研究环境因子对病害发生发展的影响。摩擦接种时,病菌喷在叶片表面,需侵入才能危害蝴蝶兰,用于研究环境因子对病菌侵入的影响;针刺接种时,病菌随接种针直接进入叶片内部,用于研究环境因子对病害发展的影响。
不同温度对蝴蝶兰软腐病菌侵入和病害发展的影响差异明显。摩擦接种(图1a和c,图片均为叶背面)和针刺接种(图1b和d),24℃时叶片均不发病;26~36℃叶片可发病,其中28~32℃适宜病害发展;温度为30℃时,摩擦接种的叶片病情指数和针刺接种的病斑直径均最大,表明30℃是病菌侵入和病害发展的最适温度。

图1 温度对蝴蝶兰细菌性软腐病菌侵入和病害发展的影响
2.2 湿度对病菌侵入和病害发展的影响
摩擦接种叶片(图2a和c),湿度为60%和70%时叶片不发病,湿度为80%时叶片上出现病斑,湿度增加到90%时病情指数明显加重,因此,高湿利于病菌的侵入。针刺接种时(图2b和d),不同湿度处理的叶片均明显发病,病斑直径差异不显著。针刺接种直接把病菌接入叶片内,内部汁液可为病菌增殖提供足够湿度,因此,病菌进入叶片内部后,外部环境湿度对病害发展影响不大。试验结果表明,高湿度利于病原菌的侵入,病菌侵入后,病害发展与环境湿度相关性不大。
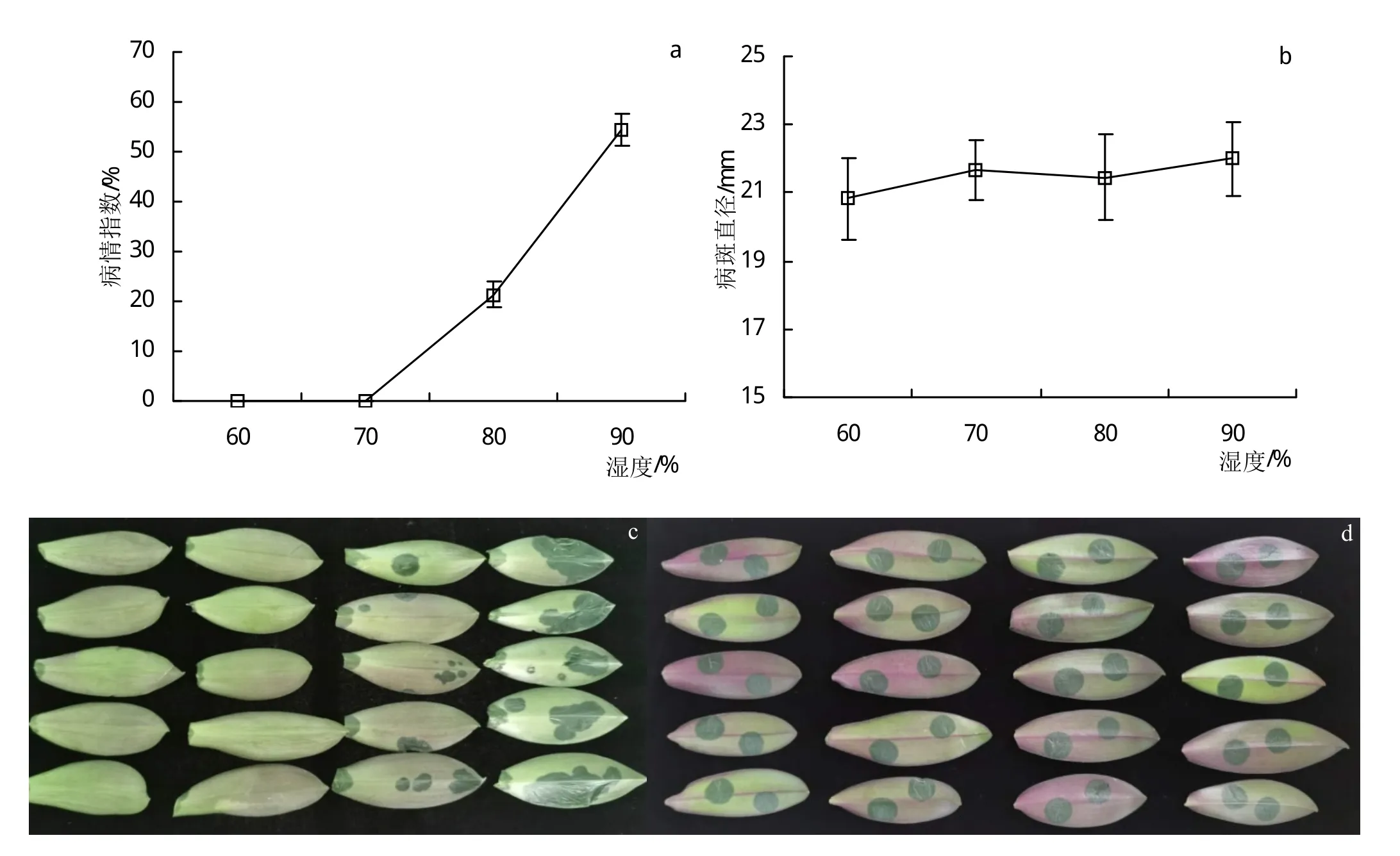
图2 湿度对蝴蝶兰细菌性软腐病菌侵入和病害发展的影响
2.3 伤口对病菌侵入和病害发展的影响
摩擦叶片造成伤口后喷病原菌液,24 h后叶片发病率为100%,而健康叶片喷菌液,叶片全部未发病,表明病菌需通过伤口才能侵入叶片为害(图3a)。用先剪健康叶片的剪刀再连续剪10片健康叶片,所有叶片均未发病;但剪过病叶的剪刀再剪10片健康叶片,处理叶片发病率为100%,在叶片顶端均可见明显软腐症状(图3b)。因此,病菌在温湿度适宜的情况下,极易通过农事操作造成的伤口,从病株传播到健康植株。

图3 伤口对蝴蝶兰细菌性软腐病菌侵入和病害发展的影响
2.4 评价二氧化氯对病菌的抑杀作用
2.4.1 不同消毒剂对病菌的生物活性测定 病菌需通过伤口侵入叶片为害,且病害在高温高湿条件发展迅速,极难防治,因此应用消毒剂对操作工具进行消毒,从源头上切断病菌传播,是预防病害的有效方法。
测定6种消毒剂对病菌的生物活性,消毒剂对病菌的最小抑菌浓度(MIC)结果见表1。高锰酸钾和聚维酮碘对病菌抑菌能力较弱,在1000.00µg/mL时无抑菌作用,三氯异脲酸在500.00µg/mL、溴氯海因和戊二醛在250.00µg/mL时抑制病菌的生长,二氧化氯对病菌的MIC为62.50µg/mL,抑菌效果最好。进一步对二氧化氯的最小杀菌浓度(MBC)进行测定,结果见图4,125µg/mL二氧化氯处理病菌时,病菌在LB平板上不生长,表明二氧化氯对病菌的MBC是125µg/mL。

表1 消毒剂对蝴蝶兰软腐病菌的生物活性
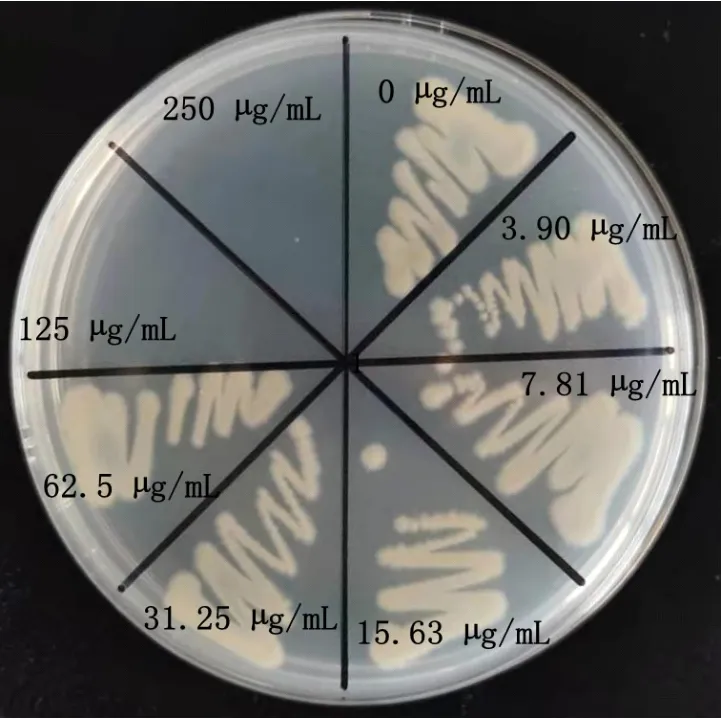
图4 二氧化氯对蝴蝶兰软腐病菌的最小杀菌浓度测定
2.4.2 二氧化氯对病菌菌体形态的影响 在扫描电子显微镜下,未用二氧化氯处理的对照菌体呈长圆柱形、长椭圆形,菌体饱满,边缘光滑(图5a)。用最小抑菌浓度62.50µg/mL的二氧化氯处理病菌1 h后,大部分病菌表面粗糙,出现皱褶、菌体萎缩(图5b),部分菌体细胞壁破损,细胞内物质外漏(图5c)。用最小杀菌浓度125.00µg/mL的二氧化氯处理后1 h后,菌体细胞壁多处破损,破裂,胞内物质大量渗漏,菌体严重皱缩变形,呈细长条形(图5d),此时,病菌已被完全杀死。

图5 二氧化氯对蝴蝶兰软腐病菌菌体形态的影响
2.5 不同浓度二氧化氯对病菌杀菌时间测定
125µg/mL的二氧化氯处理病菌,在32 min时,可以杀灭细菌;浓度增加到250µg/mL,二氧化氯处理2 min可杀灭细菌,当浓度为500µg/mL时,0.5 min就可完全杀灭细菌(表2)。因此,250、500µg/mL的二氧化氯可在较短时间内杀灭细菌,是较适合的快速消毒浓度。

表2 二氧化氯不同处理浓度和处理时间对蝴蝶兰软腐病菌的杀灭效果
2.6 离体叶片法验证二氧化氯对病菌的消毒效果
250µg/mL的二氧化氯溶液浸泡带菌剪刀0.5 min和1 min后,剪健康叶片,叶片平均发病率分别为16.67%和13.33%,浸泡时间增加到2 min及以上时,处理叶片均未发病(图6a)。用500µg/mL的二氧化氯溶液浸泡带菌剪刀0.5 min及以上再剪健康叶片,处理叶片均未发病(图6b)。表明用500µg/mL二氧化氯浸泡带菌剪刀0.5 min可完全杀灭病菌,可用于蝴蝶兰农事操作过程中工具的快速消毒,以阻断病菌传播。

图6 二氧化氯对蝴蝶兰软腐病菌的消毒效果
3 结论
蝴蝶兰细菌性软腐病在高温、高湿条件下发展迅速,28~32℃适宜病菌的侵入和病害发展,最适温度为30℃;湿度高于80%利于病菌侵入和发展;病菌需要通过伤口才能侵入植株内部,容易通过农事操作造成的伤口从病株传播到健康植株。二氧化氯对病菌最小抑菌浓度(MIC)为62.5µg/mL,最小杀菌浓度(MBC)为125µg/mL。二氧化氯使病菌菌体萎缩、破裂,胞内物质外漏致菌体皱缩变形,严重时呈细长条形,最终杀死病菌。应用500µg/mL二氧化氯浸泡0.5 min能完全杀死细菌,可用于农事工具的快速消毒,以阻止病菌传播。
4 讨论
软腐病是蝴蝶兰生产上的重要病害,发展迅速,危害严重,极难防治。本研究表明,28~32℃适宜病菌侵入和病害发展,最适温度为30℃;湿度为80%时,叶片出现病斑,湿度增加到90%,病情指数明显加重。黄树钦等观察发现温度超过26℃、湿度超过60%时,大棚蝴蝶兰植株开始发病,随着温度、湿度的增高,发病速度逐步加快[10]。刁平芬等[1]报道病菌生长适温29℃,高温、高湿、通风不良有利该病的发生。张敏[17]也认为防治该病害关键是严格控制湿度,应尽最大程度保持在70%左右,与本研究基本一致。病菌需要通过伤口才能侵入植株,当农事操作损伤到叶片,软腐病菌容易通过工具传播,如剪除病部组织时不及时对工具进行消毒,接触其他植株时,病菌会从伤口侵入蝴蝶兰植株。本研究结果表明,无论是带菌剪刀剪伤叶片或是带菌砂纸摩擦造成伤口,均易将病菌传播到健康叶片,发病率高达100%。黄树钦等[10]强调避免用山泉水直接浇灌蝴蝶兰,山泉水含细砂较多,在水流冲击下,砂粒易造成蝴蝶叶表的伤口,利于传染病菌。本研究表明,高温高湿利于蝴蝶兰软腐病菌的侵入和病害扩展,一旦病菌侵入,病害发展迅速。丁银花等[18]也报道在环境适宜的情况下,病斑会迅速扩大,2~3天小苗出现死亡,4~5天成株苗死亡,即使使用化学药剂也极难控制病害蔓延。但病菌需经过伤口才能侵入叶片,评价高效消毒剂对病菌的抑杀作用,优化其消毒方法,用于操作工具的快速消毒,可在源头阻断病菌传播,有效预防病害,且成本较低。
二氧化氯是世界卫生组织向全世界推荐的A级广谱高效、安全的化学消毒剂,具有较强的氧化作用,对微生物细胞壁有较好的吸附和透过性能,与蛋白质中部分氨基酸发生氧化还原反应,使氨基酸分解破坏,进而控制微生物蛋白质的合成,最后导致微生物死亡,对细菌、病毒、真菌、芽孢均有杀灭作用[19-20]。在细菌性软腐病防治方面,Mahovic等[21]、Pao等[22]利用二氧化氯防治西红柿软腐病(Erwinia carotovorasubsp.carotovora)。陈远凤等[23]报道高于5 mg/L的二氧化氯进行水体消毒可预防香蕉软腐病(Dickeya zeae)通过水源传播,对发病蕉穴土壤的消毒可以使用1500 mg/L二氧化氯处理以达到清除病原的目的。田世龙等[16]报道,离体条件下,近缘种马铃薯块茎软腐病原菌(Pectobacterium carotovorum)对二氧化氯具有较好的敏感性,EC50和EC90分别为0.2524 µg/mL和0.4872 µg/mL。Tsai等[24]也报道二氧化氯可有效抑制马铃薯块茎软腐病菌,对病害有较好的效果,且无化学残留,对人体无害。乔勇进等报道二氧化氯处理能够破坏大白菜软腐病菌(Pectobacterium carotovorum)细胞膜渗透性,抑制果胶杆菌的生长繁殖,降低其存活率;还可抑制其纤维素酶、果胶酶等致病酶的活性,降低其致病性[25]。本研究发现,二氧化氯对病菌最小抑菌浓度(MIC)为62.5µg/mL,最小杀菌浓度(MBC)125µg/mL。125µg/mL的二氧化氯可使蝴蝶兰软腐病菌菌体细胞壁破裂,胞内物质大量渗漏,菌体严重皱缩变形为细长条形,最终杀死病菌。500µg/mL二氧化氯在0.5 min内能完全杀灭蝴蝶兰软腐病菌,可用于农事操作中工具的快速消毒,以防止病菌传播蔓延。可见,二氧化氯对蝴蝶兰软腐病菌也有较好的抑杀作用,可用于蝴蝶兰细菌性软腐病的防治。
本研究在明确软腐病发生流行条件的基础上,筛选出高效消毒剂二氧化氯,评价其对病菌的抑杀效果,优化其消毒条件,为病害提供简单实用的防治技术,在蝴蝶兰生产中极具推广应用价值。但二氧化氯的消毒效果还需要在生产上进行验证,因此下一步工作将通过田间应用验证二氧化氯的消毒效果,同时开展二氧化氯对病菌的消毒机理研究。

