基于海绵共附生放线菌的抗结核活性物质筛选
王亚月,褚亚东,吴佩春,曹旭鹏,薛松,马郁芳
(1.商丘师范学院 生物与食品学院,河南 商丘 476000;2.中国科学院大连化学物理研究所 生物技术部,辽宁 大连 116023;3.大连理工大学 生物工程学院,辽宁 大连 116024;4.大连医科大学 基础医学院,辽宁 大连 116044)
结核病(Tuberculous,TB)是由结核分枝杆菌感染引起的慢性传染病,被认为是世界上最大的威胁之一[1,2].WHO报道,2015 年全世界有1040万人患有结核病,180万人死于该病(http://www.who.int/mediacentre/factsheets/fs104/zh/).同时由于治疗不当,不适当或错误使用抗结核病药物,或使用劣质药物导致结核分枝杆菌对抗结核药的耐药性不断增长[3].例如耐多药结核和广泛耐药结核,前者它是由至少对异烟肼(isoniazid)和利福平(rifampicin)这两种最为有效的一线(或标准)抗结核药物没有反应的细菌引起的.后者是由对异烟肼和利福平以及任何氟喹诺酮(fluoroquinolone)和任何二线抗结核病注射药物硫酸卷曲霉素(capreomycin sulfate)、卡那霉素(kanamycin)或阿米卡星(amikacin)具有耐药性的病原体引起的一种结核病形式.2015年,结核病患者中近5%患耐多药结核病[4].然而,现有抗结核药物对耐多药结核病患者的有效性甚低,治愈率仅为40%-70%.因此,更安全、高效的抗结核生物药物的开发成为当前的迫切需求,而多年的新药开发历程表明,海洋因其生境与陆地差异较大,成为了重要的新结构化合物的来源,而其中贡献位于首位的是最低等的多细胞滤食动物——海绵[5,6].
自上世纪60年代开始,海绵一直是海洋新结构化合物最大来源,根据Nature Product Reports的统计,贡献了约1/3的海洋来源新结构化合物,而其多样的新结构化合物的产生,据推测很大一部分来自其相关微生物(共生、附生).在这些微生物中放线菌占据了重要地位[5,7,8].因此,如果能够有效地对海绵相关放线菌进行探索,将有可能再寻找到新的抗结核药物或前体化合物.
本研究正是基于这一思路,以涵盖黄渤海、南海和南极地区海绵的2000余株海绵相关放线菌资源库为出发点,建立安全、高通量的筛选技术,通过对其中近500株放线菌进行活性评估,确定这一资源库在开发新型拮抗结核药物方面的优势和价值.筛选高活性组分,为开发抗结核药奠定基础.
1 材料与方法
1.1 材料
1.1.1 菌株
供试放线菌菌株由本实验分离自大连黄渤海、南海和南极的海绵样品,保存于国家海洋局海洋药源生物种质资源库.放线菌菌株及代谢物抗结核活性表型筛选模式菌耻垢分枝杆菌(Myobacterium smegmatis str.mc2155)菌株惠赠于美国科罗拉多州立大学微生物系分枝杆菌研究室.
1.1.2 培养基
耻垢分枝杆菌培养基(LBT):胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,10% 吐温80:5 mL/L,调整pH值为7.0.
放线菌培养基(ISP-2):麦芽浸粉 10 g/L,酵母粉 4 g/L,葡萄糖 4 g/L,调整pH值为7.2.每个试管中加入5 mL,灭菌备用;配置ISP-2固体培养基,灭菌后稍凉至60 ℃左右,倒入无菌培养皿中(约30 mL),制成固体平板备用.
1.1.3 试剂与仪器
刃天青(阿拉丁),DMSO(SIGMA),LA Taq酶(TaKaRa),DL2000 DNA Marker(TaKaRa),其余试剂均为国产分析纯.16s rDNA的引物对:8f:5'-GAG AGT TTG ATC CTG GCT CAG-3',1492r:5'-CGG CTA CCT TGT TAC GAC-3',由Takara公司合成.高压蒸汽灭菌器,培养箱,摇床,一次性96孔板,荧光分光光度计(Agilent Cary Eclipse),GeneQuant Pro(Bio-Rad)PCR 仪(GeneAmp 2700,AB).
1.2 方法
1.2.1 耻垢分枝杆菌(Msm)培养
将在LB固体培养基上37 ℃培养2 d的Msm挑取单菌落接种于装有5 mL LBT培养基的20 mL试管内,置于37 ℃摇床(220 r/min)中培养约24 h;测定Msm在600 nm处的吸光度(OD600),当其OD600范围在0.7~1.0之间,计算要使用的Msm菌液体积为7/OD(μL);将计算好的Msm菌液加入25 mL LBT培养基内吹打均匀配成Msm菌工作液,并涂板计数其浓度为2×105CFU·mL-1.
1.2.2 放线菌培养
菌种复苏是选取-20 ℃冰箱(或-70 ℃超低温冰箱)保存的菌株,室温融化,无菌条件下取一环菌悬液,在平板上划线复苏菌株,放置28 ℃培养箱培养5~7 d.期间,每天观察菌落大小变化,及时从固体培养基上挑出一环单菌落接种于含5 mL/15 mL ISP-2培养基的试管中,置于30 ℃摇床(220 r/min)培养3~5 d.扩大培养为是试管中培养的放线菌取1 mL接种于装有150 mL ISP-2培养基的500 mL三角瓶中,置于30 ℃摇床(220 r/min)培养7 d,每种菌接种10瓶.
1.2.3 抗Msm菌的放线菌菌株活性筛选样品处理
EF1样品是将菌液6500 r/min(9916 g)离心,收集菌体,按菌体湿重∶水∶丙酮=1∶2∶2萃取24 h,抽滤后旋转蒸发浓缩,冷冻干燥后制得.EF2样品是将菌液6500 r/min(9916 g)离心,收集上清液,按上清液∶乙酸乙酯=1∶4萃取24 h后,由分液漏斗留下乙酸乙酯相,旋转蒸发浓缩,冷冻干燥后制得.不同浓度梯度样品制备是于96孔板上设置样品梯度孔即每孔加入50 μL LBT,第一孔加入50 μL 样品(EF1或EF2样品)吹打均匀,并向下一孔等比稀释到所需孔数.由于EF1样品在水溶液中的溶解度高于EF2溶解度,故对于两种来源的工作液,设置不同的测试浓度梯度(见表1).
1.2.4 确定刃天青显色法最佳试验条件
活细胞中的乳酸脱氢酶能将刃天青 (蓝色)转化为荧光物质试卤灵(粉红色),产生荧光信号.试卤灵会继续被细胞还原为无荧光的物质二氢试卤灵(白色),使荧光信号下降,无活性的或死亡的细胞丧失了代谢能力而不能还原刃天青,也就不能产生荧光信号,所以该法能特异性检测活性细胞(McMillian,M.K.,2002).通过其颜色变化判定药物MIC值.称取90.2 mg亚硫酸钠加入到2 mL去离子水中,加入刃天青显色剂10 μL(1 mg/mL),待溶液变为粉色,1/10稀释后用安捷伦荧光分光光度计测定最佳发射波长和测量波长。
1.2.5 DMSO对Msm菌生长的影响
在LBT中加入终浓度为0.0015%~2%(v/v)DMSO,37 ℃培养箱培养Msm 24 h,每孔加入20 μL 刃天青工作液,再放回37 ℃培养箱继续培养5 h,于荧光分光光度计测定,激发波长573 nm,检测波长586 nm,检测DMSO浓度对Msm生长的影响,当 DMSO 浓度为2%时,Msm菌的存活率仍在80%以上.因此在筛选抗Msm菌活性菌株时,确定2% DMSO为起始浓度浓度进行等比稀释.
1.2.6 抗Msm菌活性测定
利用孔板等比稀释法测定样品Msm活性,并分为初筛、精筛、高活比较三级测定.如表1,于96孔板上另设置空白孔4个;阴性对照孔6个;观察孔2个;阳性梯度孔初筛、精筛12个,高活比较16个;样品梯度孔初筛6个,精筛12个,高活比较16个.空白孔为100 μL LBT培养基,阴性对照孔为 50 μL LBT培养基+50 μL Msm菌工作液,观察孔为 50 μL LBT培养基+50 μL Msm菌工作液+20μL 刃天青工作液;阳性梯度每孔加入50 μL LBT,初筛,精筛第一孔加入50 μL氨苄青霉素(Amp)工作液,高活比较第一孔加入50 μL乙胺丁醇(ethambutol,EB)工作液,吹打均匀并向后等比稀释,最后每孔加入50 μL Msm菌工作液;样品梯度孔每孔加入50 μL LBT,第一孔加入50 μL样品液吹打均匀并向后等比稀释中最后加入50 μL Msm菌工作液.96孔板封口膜封边后至于37 ℃培养箱培养约24 h.培养20 h后观察96孔板内观察孔,当观察孔为紫红色时将96孔板内除观察孔外其余孔每孔加入20 μL 刃天青工作液,再放回37 ℃培养箱继续培养5 h,于荧光分光光度计测定,激发波长573 nm,检测波长586 nm.在测定后发现有跳孔或有染菌嫌疑的样品孔,需要重新培养测定.以测得的荧光值发生跳变的孔前一孔的样品浓度作为此样品的MIC值.考虑到EF1与EF2样品的处理方式不同,故按不同抑制浓度,对样品抗Msm活性进行分级.对EF1样品,将MIC在1250~5000,156.3~625.0,19.5~78.1,2.4~9.8 μg/mL范围内的样品被认为分别具有低,中,高,强的抗Msm活性.对EF2样品,将抑制浓度在250.0~1000.0,15.6~125.0,1.8~7.8,0.1~1.0 μg/mL范围内的样品被认为分别具有低,中,高,强的抗Msm菌活性.
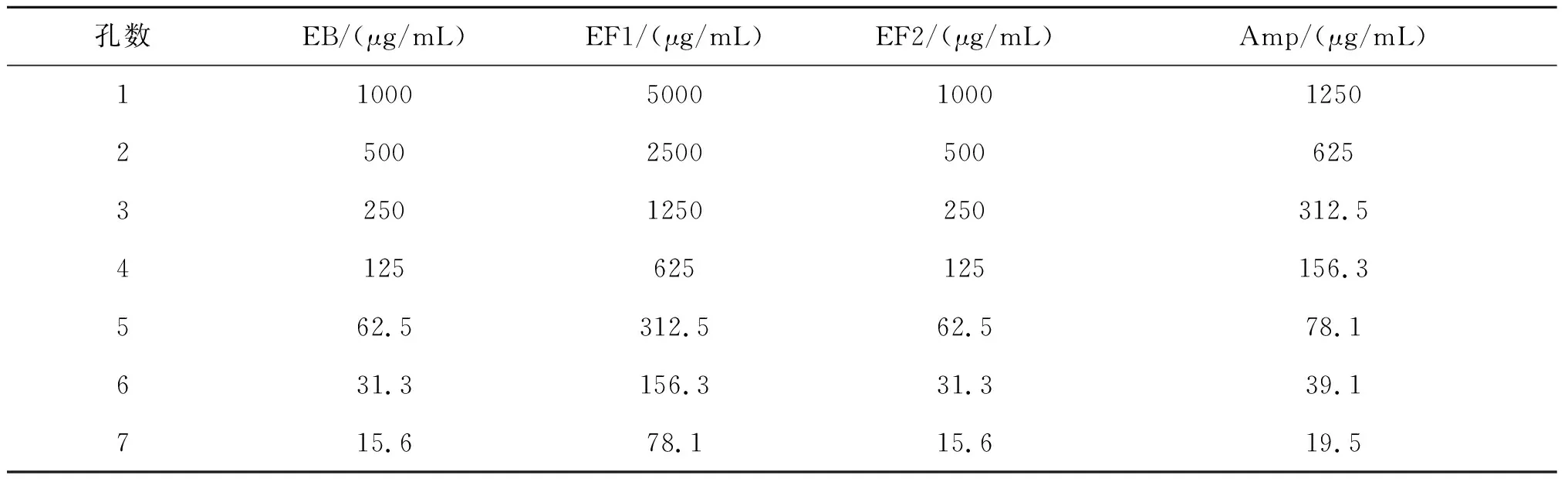
表1 EF1与EF2样品与阳性对照药物的浓度梯度设置Table 1 The concentration gradient table of positive control drugs,EF1 and EF2 samples

续表1
1.2.7 EF1与EF2组分薄层层析(TLC)分离
将萃取获得的EF1与EF2组分,EF1用丙酮和水(1∶1)溶解,EF2用二氯甲烷和甲醇(1∶1)溶解,通过TLC板,将两组分内各物质进行分离.EF1组分展开剂为二氯甲烷、甲醇和冰醋酸(比例为2∶1∶0.1);EF1组分展开剂为石油谜、乙酸乙酯和冰醋酸(比例为10∶3∶0.1).显色剂为茴香醛、硫酸、冰乙酸和甲醇(比例为1∶10∶20∶170).
1.2.8 16S rDNA 序列测定和系统发育分析
用PCR扩增16S rDNA的引物与扩增条件同文献[9].所测得的 16S rDNA 序列提交 NCBI的GeneBank数据库,与其中已有的序列进行比较分析(http://www.ncbi.nlm.nih.gov/BLAST/).从数据库中得到相关种属的有效发表序列的 16S rDNA 序列信息.使用 MEGA v6软件进行多序列比对及系统发育树的构建.
2 结果和分析
2.1 抗Msm菌活性的放线菌菌株筛选
筛选的461株放线菌中,394株具有抗Msm菌活性,这些菌株主要来自于大连湾潮间带,大连淩水潮间带,大连20~30 m深处分离的海绵中及旅顺海底,拮抗Msm阳性率为85.5%,远高于从南海海域的海绵中筛选出的放线菌菌株拮抗结核活性阳性率(为1.4%)[11],表明了本文所选择的放线菌资源库以抗结核为目标呈现较高的阳性筛选效率,可作为寻找新的抗结核药物先导化合物的重要资源之一.在抑Msm菌的组分中,EF2组分比EF1组分量高出8%,表明菌株活性组分更倾向于分布在培养液的乙酸乙酯萃取物中,这些脂溶性的活性组分更易穿过分枝杆菌富脂的疏水性外壁,从而渗入菌体内,发挥更好地抗结核活性.EF1与EF2组分同时表现出抗Msm活性菌株占阳性菌株的32%(127株)(图1),表明这些菌株可产生多样性的抗结核活性成分,实现了菌株资源的充分利用.

图1 具抗Msm菌活性的菌株活性组分与级别分布Figure 1 The active components and activity level of anti-Msm strain
获得26株高强抑菌活性菌株中,菌株编号772与D98菌体和培养液提取物均表现出高抗Msm菌活性(表2).菌体丙酮提物中抑菌活性最高的菌株为D98,MIC为19.5 μg/mL.培养液萃取物中活性最高的菌株为772,596和DL238,MIC均为0.24 μg/mL,低于目前所使用的异烟肼(16 μg/mL)[12],利福平(16 μg/mL)[12],卷曲霉素(4 μg/mL)[13],阿米卡星(1 μg/mL)[13]等抗结核药物.通过薄层色谱法对来自不同菌株粗提物EF1与EF2组分进行初级分离,如图2,可观察到粗提物EF1与EF2组分中含有多种成分(图2),表明了筛选出的阳性菌株中有效的抗Msm活性成分含量更低,实际MIC值要低于粗提物MIC值,可见这些菌株具有进一步挖掘新型抗结核药物的潜力.
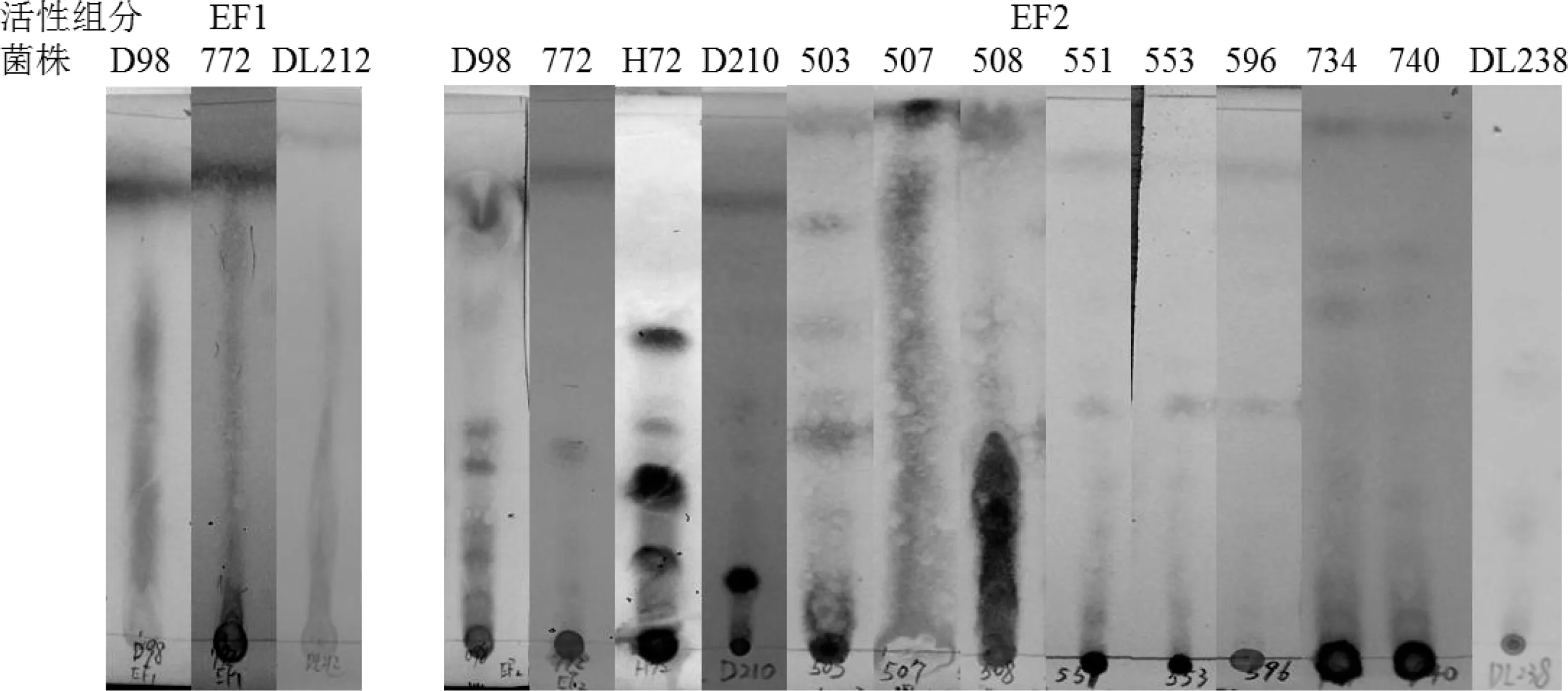
图2 不同菌株EF1与EF2组分的薄层层析分离Figure 2 The components of EF1 and EF2 from different strains were separated by thin-layer chromatography (TLC) and visualized by iodine vapor
2.2 抑Msm菌活性菌株分子鉴定
将23株高强抑菌活性菌株的16S rDNA序列信息分别输入至NCBI的GenBank数据库,与其中已有的序列进行比较,进行属一级归类.如表2,这些高强抗Msm活性菌株均来自于链霉菌属(Streptomyces).其中菌株HVG29与Streptomycesmicroflavus(GeneBank:EU570571.1),D116与Streptomycesgriseoplanus(GeneBank:KR476418.1),D224与Streptomycesrutgersensis(GeneBank:KJ488980.1),H72与Streptomycesparvus(GeneBank:JX976304.1)及D170与Streptomyceslavendulae(GeneBank:KC626003.1)间的同源性至少为99%,故认为菌株HVG29,D116,D224,H72与D170分别属于S.microflavus,S.griseoplanus,S.rutgersensis,S.parvus与S.lavendulae.

表2 高抗Msm活性菌株活性组分,MIC,种属分布及已报道抗生素种类Table 2 The active component,MIC,species of the strains with highly antimicrobial activity and the reported antibiotics produced by corresponding species
在菌株772与D23可能所属的链霉菌的一些种里,虽然已报道可以产生具有抗结核分枝杆菌活性的核苷类抗生素[14],然而不同来源的链霉菌,其次级代谢产物可能不同.海洋由于其高压、高盐、寡营养、低温等特点,被认为是生命活动的极端环境.生活在这一特殊环境中的放线菌,其生理生化特征及其次级代谢途径与陆生放线菌有很大的区别,可以产生具有新颖的化学结构和独特生理功能的代谢产物[15].因此,这也正说明了菌株772与DL238的高抑菌活性.同理菌株596与D98可能所属的链酶菌的一些种里,虽已有产生多肽类抗生素如卷曲霉素可抑制结核分枝杆菌的报道[16,17],然而菌株596与D98高的抑菌活性意味着其产生的抗菌活性物质可能不同于已有报道.
2.3 与抗结核药物活性比较
抗Msm菌的实验结果为以乙胺丁醇为对照,其MIC值为0.24 μg/mL,来自菌株编号596,772与DL238的EF2组分的MIC与对照相同,对Msm菌有较强的抑制作用.乙胺丁醇对结核分枝杆菌与耻垢分枝杆菌的MIC值分别为0.47 μg/mL和0.25 μg/mL,为二线抗结核药,可用于经其他抗结核药治疗无效的病例[10].来自于菌株编号596,772与DL238的EF2组分含有多种物质,因此其抗Msm菌活性成分比目前广泛应用的抗结核药物乙胺丁醇具有更低的MIC值,表明了在这些菌株中,很有潜力分离出新型抗结核药物.
3 结 论
本研究通过以抗Msm菌活性为导向,评价了来源于大连周边海绵中放线菌对于抗分枝杆菌的阳性率非常高,提供了拮抗结核药物的先导物储备资源库;从海绵共附生放线菌中筛选出26株来自于链霉菌属的高抑菌活性的菌株,为新型抗结核药物的研发提供新的目标.

