乙醇和二甲醚在激波管内的裂解试验与动力学研究
吕恩雨, 马志豪, 王鑫, 董永超, 李新, 金亦凡
(河南科技大学车辆与交通工程学院, 471003, 河南洛阳)
随着全球能源需求的日益增长以及化石燃料燃烧过程产生的有害污染物问题日趋严峻,众多学者一直致力于改进传统的燃烧过程或设计新型的燃烧过程,同时寻找高效清洁的替代燃料。其中,含氧燃料是一种极具发展前景的替代燃料,为了设计和适应燃烧的应用,需要深入了解其燃烧过程。在燃烧过程中,热解反应总是伴随着氧化反应进行,高温条件下燃料裂解生成的小分子产物,主要包括一些C2、C3、C4物种。然后,进行下一步氧化,这些物种的成分决定了燃料的氧化速率进而影响其燃烧特性。此外,这些物种可由后续的聚合反应生成高碳物种如多环芳香烃(PAHs),PAHs则是碳烟Soot的前驱体。因此,准确认识燃烧过程的同时有必要研究燃料的裂解过程。
在众多含氧燃料中,乙醇和二甲醚(DME)在替代柴油和汽油等碳氢化合物燃料中起着重要的作用。与传统的柴油相比,DME由于较低的自燃温度、较短的着火延迟期和更易于蒸发等特性成为学者的研究热点。DME常被用作汽油和柴油的添加剂,其作为燃料添加剂可以抑制多环芳烃和碳烟的形成[1],并减少NOx排放[2]。此外,DME作为柴油的替代燃料,可降低发动机尾气中NOx和颗粒物等的排放[3-4];DME分子结构中不存在C—C键且本身含氧原子,被认为可抑制碳烟的形成[5]。类似地,乙醇作为常规燃料添加剂、含氧添加剂、辛烷值增强剂以及作为纯燃料引起了学者的广泛关注[6-7]。汽油中添加乙醇可以提高燃料的辛烷值,同时可以减少颗粒物[8-9]和CO[10]的排放。此外,有研究还发现柴油中添加乙醇能够改善燃油经济性[11]。
国内外学者对DME和乙醇的燃烧和氧化等方面进行了广泛的试验研究,而近些年来关于这两种燃料的热解研究相对较少。其中,Pyun等通过测定CO、CH4和C2H4的浓度变化时间历程进而研究了DME热解特性,发现CO、CH4和C2H4的浓度随时间变化对反应CH3OCH3→CH3+CH3O高度敏感[12]。Tranter等分析了漫游通道对DME中热解的重要性[13]。Hashemi等发现DME主要的裂解产物有CH4、CH2O和CO[14]。Hidaka等详细讨论了5个反应在高温下的速率常数表达式,认为DME热解的主要产物为CO、CH4、C2H4、C2H2和C2H6[15]。Fischer等认为甲基在DME的热解和氧化中起着关键性作用[16]。
对于乙醇的热解研究,Aghsaee等使用激波管研究了乙醇的热解和氧化过程,在热解过程中检测到的主要产物为C2H4、H2O、C2H5OH、CH3CHO、CH4和C2H2,并将质谱数据与多人的机理模拟结果进行对比[17]。Methling等记录了乙醇的热解产物浓度时间曲线,通过3种详细的化学动力学反应模型关于物种的浓度分布进行建模[18]。Hashemi等构建了乙醇氧化和热解的详细化学动力学模型[19]。Zhao等测量了主要的热解产物CO、CH4和H2的浓度,并讨论了其对热解过程中碳烟形成的影响[20]。Kiecherer等发现乙醇的主要裂解产物为H2O和C2H4,这两种产物主要在C2H5OH→C2H4+H2O反应中形成[21]。
相对于乙醇和DME的燃烧和氧化特性研究,含氧燃料裂解特性和规律的研究还相对不足,且多数研究仅致力于一种燃料或同一种类型的燃料模型的构建,而对于构建组合模型的研究较少。此外,一个精确的化学反应动力学模型的构建需要温度和压力范围更广的试验数据来完善。本文利用激波管对乙醇和DME在温度1 200~1 700 K和压力0.20~0.25 MPa下的裂解过程进行了试验研究,并利用直接关系图法构建了详细的组合简化机理,通过进行产率和敏感性分析,讨论了乙醇和DME的消耗路径及4种小分子物种的生成及消耗途径,以期为替代燃料的工程实践提供理论依据,并为验证化学反应动力模型提供基础试验数据。
1 试验装置及方法
1.1 试验装置
试验装置主要分为两部分:一部分是横截面为圆形的不锈钢化学激波管,关于激波管的详细介绍可参见文献[22];另一部分为气相色谱仪检测系统。试验前,利用真空泵将高、低压段和预混罐抽至真空(10 Pa以下,整个装置漏气率低于0.1 Pa/min),然后将预先在混气罐配置好的混合气充入低压段;将高纯He(体积分数99.999%)按照设定的压力充入高压驱动段。试验装置如图1所示。

图1 激波管试验装置Fig.1 Shock tube experiment device
试验段侧壁放置3个相互间隔200 mm的压力传感器(PCB113B24),因为采集到的压力信号较微弱,故在每个压力传感器后加装低噪声电压前置放大器(SR560),以准确采集测量点在试验过程中压力的变化。通过示波器(Tek TDS2014B)连接所有压力传感器,示波器采集模式为单次采集,以PCB1为触发信号。已知各压力测量点之间的距离和激波到达不同测量点之间的时间差,可计算出激波的平均速度,结合理想正激波方程,得到反射激波后的裂解温度和压力。由于激波的衰减,激波速度不确定度约为0.2%,对应的裂解温度误差为±15 K。试验完成后,打开低压段末端的阀门,通过采样袋对裂解产物进行收集,再通过气相色谱仪(Shimadzu,GC2010-Plus)检测和定量气体组分。本试验检测到4种产物,分别为CH4、C2H4、C2H2和CH2O。小分子碳氢产物选用50 m BOND/KCL毛细管色谱柱和氢火焰离子化检测器(FID)进行定量分析,醛类选用30 m Rtx-Wax毛细管色谱柱和介质阻挡放电等离子体检测器(BID)定量分析。测量得到的物种浓度的不确定度在10%以内。
本文所用燃料为乙醇和DME,二者为同分异构体。试验选用的燃料纯度(体积分数)均为99%,稀释气体选用高纯Ar(体积分数99.999%),通过激波管雾化预混系统配置混合气,液态燃料被拉伐尔喷管产生的高速气流剪切进而破碎雾化,在混气罐中可形成粒径较小的气溶胶。为减少液滴撞击进气管路壁面以及壁面吸附,采用大管径、低速流、小拐角的低压试验段端部进气装置设计。此外,在靠近膜片的位置安装抽气口,使混合气在试验段内形成连续进气状态,持续抽气1~2 min,可在试验段形成均匀稳定的混合气。徐胜利等用二维米勒散射法测量了低压段激波管内的煤油/空气溶胶粒径的分布状态,发现连续进气方式可以有效地使混合物在低压段均匀分布,气溶胶平均粒径维持在2~5 μm,根据气溶胶理论,粒径小于10 μm可形成稳定可悬浮的气溶胶[23]。另外,Davidson等认为在激波试验中,燃料经过拉伐尔喷管雾化形成的气溶胶颗粒尺寸与燃料种类关系不大[24]。
1.2 动力学模型
基于激波管试验,本文通过CHEMKIN-Pro软件中的闭式均相反应器模块模拟燃料的裂解过程,模拟条件与激波管内的试验条件一致,试验温度范围为1 200~1 700 K。对于乙醇,本文选Zhang模型[25]和Mittal模型[26]进行模拟,这2种模型适用条件范围较广,温度范围为833~2 000 K,压力范围为0.065~26 MPa。DME选用Kaiser模型[27]和Burke模型[28]进行模拟,其中Burke模型适用于600~1 600 K的温度和0.7~4.1 MPa压力范围,Kaiser模型是基于温度400~2 000 K和压力0.1 MPa的反应条件。基于Mittal模型和Kaiser模型,使用直接关系图方法构建了组合简化机理(DME-Ethanol)。几种模型的反应物种和反应数如表1所示。在新构建的简化机理中,一些关键的反应列于表2,其中化学反应速率常数表达式为
k=ATnexp(-Ea/RT)
基于本文构建的简化机理,对试验中检测并定量的4个物种的摩尔分数进行了模拟,与试验结果及详细机理的模拟结果进行了对比,并进行了产率和敏感性分析,讨论了乙醇和DME的消耗路径及4种小分子产物的生成及消耗路径。

表1 模型的组分和反应数

表2 DME-Ethanol模型中的关键反应
2 试验结果及分析
2.1 乙醇裂解
试验检测了温度范围为1 200~1 700 K和压力范围为0.20~0.25 MPa条件下摩尔分数为3%的乙醇在氩气稀释下的裂解产物。在试验温度范围内,通过对裂解产物中气体CH4、C2H4、C2H2和CH2O成分进行检测分析,得到4种产物浓度c随温度的分布,并将相同试验工况下的他人模型和简化模型的模拟结果与试验结果进行对比,如图2所示,其中c0表示燃料的初始浓度。在试验温度范围内选择1 300 K进行了产率和敏感性分析,如图3和图4所示。在1 300 K时,乙醇的裂解转化率为39.6%,燃料分解转化率较低,可以更清晰地看出燃料的初始反应路径。敏感性分析是将某些特定反应的指前因子变化一极小量所引起的目标物种的摩尔分数的变化量,是一个偏微分概念。正敏感性系数表示对产物浓度增加有促进作用,负值表示对产物浓度的增加有抑制作用。
由图2可知,在乙醇的裂解产物中,CH4是最主要的产物,C2H4次之。CH4、C2H4和CH2O的浓度随着温度的升高先升高后降低,C2H2的浓度随着温度的升高而增大,其中CH4的浓度在1 500~1 550 K温度范围内达到最大值,然后下降,浓度降低速率较为缓慢。C2H4的浓度在1 500 K左右达到最大值。CH2O的浓度在试验初始温度附近达到最大值,之后很快下降。由裂解产物的模拟结果与试验结果对比可知,本文构建的DME-Ethanol模型能够较好地预测裂解产物浓度,对于试验值的预测误差在10%以内。

(a)CH4

(b)C2H2

(c)C2H4

(d)CH2O图2 乙醇裂解产物浓度随温度的变化Fig.2 Concentration variation of ethanol pyrolysis products with temperature
由图3可知,CH4的生成主要来自由CH3引发的夺氢反应。CH3主要是由C2H5O和CH3CO经过β断裂生成,其中β断裂指的是按照正碳自由基反应机理,在正碳自由基的第2、第3碳原子间发生C—C键断裂,并生成一个烯烃和一个新自由基的过程。由图4可知,反应R1对于CH4的生成有最大的敏感性系数,这也验证了CH3在生成CH4过程中的关键作用。CH4的消耗主要是通过OH引发的夺氢反应R2进行,OH主要是由PC2H4OH的直接分解生成的,生成速率较低,从而导致CH4的消耗速率较低,CH4浓度曲线下降速率放缓。

图3 T=1 300 K、p=0.2 MPa时乙醇裂解的产率分析Fig.3 ROP analysis of ethanol pyrolysis

图4 T=1 300 K、p=0.2 MPa时乙醇及裂解产物的敏感性分析Fig.4 Sensitivity analysis of ethanol and pyrolysis products
C2H4主要通过反应R3即C2H5OH的直接断键生成。与CH4相比,C2H4的浓度降低速率较快,主要是因为C2H4通过大量的自由基如H、CH3和OH等引发的夺氢反应消耗。C2H2主要通过C2H3的β断裂反应生成,而OH引发的夺氢反应R4是生成C2H3的最主要途径,同时反应R4对于C2H2的生成具有最大的敏感性系数,这也验证了C2H2主要是由C2H4的后续分解生成。C2H2的消耗主要是其和CH3结合生成C3H4-P,此过程对于C2H2的消耗贡献极小,故在图2中未观察到随着温度上升C2H2的浓度有下降的趋势。
对于含氧产物CH2O,由产率分析可知,反应R8占据了CH2O 59.4%的产量,C2H5O可以通过乙醇的夺氢反应R1和SC2H4OH的异构化反应R9生成,SC2H4OH主要来源于R1。在试验条件下,大量的H、CH3和OH等自由基参与的夺氢反应是CH2O被消耗的主要路径,敏感性分析也表明了R1和R10分别对于CH2O的生成和消耗影响最大。
从图2中新构建的简化模型DME-Ethanol与Zhang和Mittal模型的预测结果对比可以看出,DME-Ethanol模型的预测结果的准确度和原有模型基本保持一致,4种产物浓度的变化趋势可以较好地得到预测。从图3中产率分析可知,乙醇的热解消耗主要包括两种途径,分别为H、CH3和OH等自由基引发的夺氢反应,以及C—C键、C—O键和O—H键断裂引发的单分子解离反应。其中,由H、CH3和OH等自由基引发的夺氢反应占据乙醇消耗的主导地位。由乙醇的分子结构图5可知,夺氢反应发生的位点有3个,分别为C(1)、C(2)和O(3)。由于C(1)和C(2)位置上的C—H键的键能较小(相较于O—H键),故在C(1)和C(2)位置发生的夺氢反应的比例较大,分别为20.9%和56.5%,而O(3)位置发生夺氢反应的比例约为3.1%。C(1)和C(2)位置发生夺氢反应之后生成的两种同分异构体分别为CH2CH2OH和CH3CHOH,其中CH3CHOH不稳定,最易脱氢生成乙烯醇(C2H3OH,R14)以及乙醛(CH3CHO,R13),乙烯醇主要通过异构化反应生成乙醛,乙醛主要经过H、CH3和OH等自由基引发的夺氢反应生成CH3CO,后续通过β断裂生成CO;CH2CH2OH主要通过β断裂反应脱去OH自由基生成C2H4,还可以使得C(2)位置C—H键断裂生成乙烯醇。

图5 乙醇的O—H和C—O键解离能[29]Fig.5 O—H and C—O bonds dissociation energies of ethanol
其次,乙醇另外一个重要的热解路径为单分子解离反应。乙醇中C—O键和C—H键的直接断裂最终生成C2H4和H2O,约占15.5%乙醇的消耗,这也是生成C2H4的主要来源。此外,乙醇断裂C(1)—C(2)键分解为CH2OH和CH3自由基,CH2OH自由基极易发生脱氢反应生成CH2O,此为生成CH2O的主要路径之一。
由图4可以看出,在本试验条件下,C(1)—C(2)键的直接断裂反应R1对于乙醇消耗的敏感性系数最大,说明反应R1对于乙醇的消耗是至关重要的。这是由于反应R1生成的CH3和CH2OH自由基均为高活性基团,此二者的生成均可以参与到后续的反应体系中,增大了反应体系的反应活性,其中CH3参与后续的夺氢反应是乙醇热解反应体系的关键。反应R1对于CH4的生成同样具有最大的敏感性系数,根据产率分析可知,CH4的生成主要是来自于CH3引发的夺氢反应,而反应R1正是CH3自由基的最主要来源。对于C2H4,反应R3对于C2H4的生成具有最大的敏感性系数,主要原因是乙醇通过反应R3直接分解为C2H4和H2O。反应R4对于C2H2的生成具有最大的敏感性系数,R4导致大量C2H3自由基的生成,其可以通过单分子解离反应R7直接生成C2H2,这也是C2H2最重要的生成来源。关于CH2O,C2H5O的直接分解是其最主要的生成来源(R8)。R1对于CH2O的生成具有最大的敏感性系数,这主要是由于CH3的生成有利于C2H5O自由基的生成,进而对于CH2O的生成有利。
2.2 二甲醚裂解
试验检测了温度范围为1 200~1 700 K和压力范围为0.20~0.25 MPa条件下摩尔分数为3%的DME在氩气稀释下的裂解产物。DME的裂解产物模拟结果与试验结果对比如图6所示。在1 300 K条件下DME裂解转化率为45.3%,并通过本文构建的简化机理进行了产率和敏感性分析,如图7和图8所示。从图中可以看出,与乙醇的裂解类似,C2H2的浓度随着温度的升高而单调递增,其他产物的浓度均在试验范围内存在最大值,CH4的浓度约在1 350~1 400 K时达到最大值,C2H4的浓度约在1 400~1 500 K达到最大值。CH2O的浓度在1 250 K时达到最大值。

(a)CH4

(b)C2H2

(c)C2H4

(d)CH2O图6 DME裂解产物浓度随温度的变化Fig.6 Concentration variation of DME pyrolysis products with temperature
由图7可知,DME的分解路径主要为单分子解离反应R15和夺氢反应R16、R17,DME的分子结构如图9所示,可以看到C(1)和C(2)是完全对称的两个C原子,故DME夺氢的位点为C(1)或C(2)位置,且是完全等效的。夺氢反应生成的产物主要为CH3OCH2,其后续主要通过β断裂反应生成CH2O和CH3自由基,CH2O最终分解生成CO。其次,DME的单分子解离反应是其直接断裂C—O键生成CH3O和CH3自由基,CH3O自由基后续主要发生脱氢反应生成CH2O。

图7 T=1 300 K、p=0.2 MPa时DME裂解的产率分析Fig.7 ROP analysis of DME pyrolysis
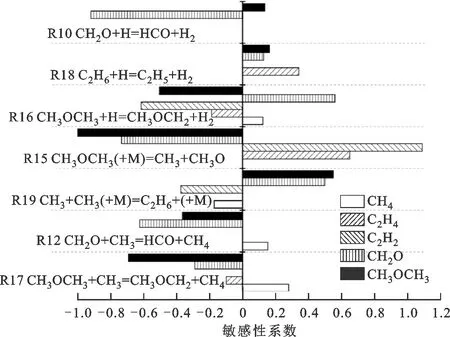
图8 T=1 300 K、p=0.2 MPa时DME及裂解产物的敏感性分析Fig.8 Sensitivity analysis of DME and pyrolysis products

图9 DME C—H和C—O键解离能[30]Fig.9 C—H and C—O bonds dissociation energies of DME
由产率分析可知,CH4几乎全部由CH3引发的夺氢反应生成。C2H4主要来源于C2H5的脱氢反应,C2H6的夺氢反应是C2H5生成的最主要来源,而由CH3的结合反应生成的C2H6是C2H5的最直接来源,故C2H4的生成主要取决于CH3自由基。C2H2主要来自于C2H3的脱氢反应,而C2H4是C2H3的直接来源。本试验测得的唯一含氧产物CH2O主要来自于CH3OCH2的β断裂反应。综上可知,CH3自由基对于DME裂解起关键作用。此外,反应R15对DME裂解具有最大的敏感性系数,这也说明了CH3在DME热解体系中的重要性。
2.3 乙醇和二甲醚对比
乙醇和DME作为同分异构体,具有不同的官能团,结构的差异决定了两者裂解路径的差异。乙醇在热解过程中夺氢反应是主导路径,夺氢反应主要由CH3、H和OH等自由基引发,主要生成SC2H4OH和PC2H4OH两种自由基。还有约15.5%的C2H5OH通过直接脱去H2O生成C2H4,约4.1%的C2H5OH脱去CH3生成CH2OH自由基,同时约有3.1%的C2H5OH由CH3、H等引发的夺氢反应断裂O—H键生成C2H5O自由基。DME的分子结构如图9所示,其具有对称的分子结构,结构化学键共两种,分别为C—O键和C—H键。其中,约有73%的DME由H和CH3自由基等引发的夺氢反应生成CH3OCH2自由基,约有26.6%的DME通过断裂C—O键生成CH3O和CH3自由基。裂解过程中生成的大量CH3自由基主要发生结合反应生成C2H6,CH3作为活泼自由基,增大了反应体系的反应活性,并参与到后续多个物种的生成反应中。
对比乙醇和DME的裂解产物可以看出,乙醇裂解生成的C2H2和C2H4更多。这主要是因为DME分子结构中不包含C—C键,生成C2产物必须经过C—O键断裂再经过C—C键聚合的过程,故DME生成C2H2和C2H4相对较少。C2H4的产量不同的另外一个原因是,在乙醇的裂解过程中,乙醇发生脱氢和脱OH反应即可直接生成C2H4,而在DME的裂解中,C2H4主要来自于CH3的重组反应,甲基是一种较为活泼的自由基,许多基元反应的发生都离不开CH3的参与。与乙醇的裂解产物相比,DME的裂解产物中CH4的产量更高,这主要是因为CH4的生成几乎全部来自于CH3引发的夺氢反应。由DME分子结构可知,其存在两个对称的甲基结构,这会导致更高的CH3产量。对于含氧产物CH2O,由两者产率对比分析可知,其中26.6%的DME主要是通过断裂C—O键脱去CH3生成CH3O自由基,CH3O自由基可直接通过脱氢反应生成CH2O,3.1%的乙醇通过夺氢反应生成C2H5O自由基,C2H5O自由基脱去CH3后生成CH2O。因此,DME裂解产生的CH2O远多于乙醇。
此外,两种燃料的裂解产物中CH4、C2H4和CH2O浓度峰值温度不同,DME的裂解产物浓度在较低的温度下取得峰值。CH3作为活泼自由基,其引发的夺氢反应是DME和乙醇裂解过程进行的关键。在DME裂解过程中,CH3主要是由DME中的C—O键直接断裂生成的,而在乙醇裂解体系中,C2H5OH断裂O—H是生成CH3的关键。由两种燃料的键解离能图5和图9对比可知,在较低的温度下,DME生成CH3较为容易,故DME裂解产物取得的浓度峰值温度较低。
3 结 论
(1)DME和C2H5OH具有不同的结构,二者在热解过程中均主要是通过由H和CH3等引发的夺氢反应消耗,由于DME独特的对称分子结构,其通过单分子解离反应消耗的比例要大于乙醇,更多的CH3增大了DME热解体系的反应性。
(2)将DME和C2H5OH热解过程中的4种热解产物进行对比分析可以看到,DME裂解生成的CH4和CH2O的产量较高,而C2H2和C2H4的产量则较低。
(3)本文使用直接关系图法构建的DME和C2H5OH的简化组合机理DME-Ethanol预测结果和试验结果符合较好,在10%的误差范围内。

