微囊性附属器癌临床病理分析
梁国栋,孟亚飞,包海龙,朱林琳
(呼伦贝尔市人民医院病理科,内蒙古 呼伦贝尔 021008)
微囊性附属器癌(microcystic adnexal carcinoma,MAC)又称为硬化性汗腺导管癌,是一种罕见的皮肤附属器肿瘤,具有向毛囊和汗腺双向分化的低度恶性肿瘤。MAC好发于头面部,本文报道2例发生在上唇和面部的MAC,并结合文献复习探讨MAC的临床病理特征、病理诊断及鉴别诊断,以提高对该肿瘤的认识。
1 资料与方法
1.1 临床资料 病例1,男性,64岁,50多年前左侧上唇皮肤一肿物,初始较小,约“黄豆粒”大小,自行挤压,局部瘢痕,未经诊治,自1年前发现肿物明显增大,否认疼痛,现因局部隆起较大,明显突出来来诊,门诊以“上唇肿物”收入院。专科查体:左侧上唇皮肤可见包块隆起,表面皮肤部分呈黄白色,肿物约3 cm×2 cm大小,触诊质地较硬,与周围组织粘连紧密,活动度差,无触压痛。将肿物全切后送病理检查,病理报告为微囊性附属器癌,底切缘可见肿瘤浸润,未行进一步治疗,目前持续随访16个月,未见肿物复发,考虑肿瘤细胞生长缓慢而未形成临床所见的肿物,见表1。
病例2,女性,60岁,发现面部皮肤肿物10余年,未经诊治,现要求手术就诊本院。专科查体:左侧面部可见大小约0.4 cm×0.3 cm肿物,表面无破溃,边界欠清,质地略硬,无移动度。将肿物全切后送病理检查,病理报告为微囊性附属器癌,侧切缘及基底切缘见癌组织,于外院行局部扩大切除。目前持续随访13个月,未见肿物复发,见表1。

表1 2例微囊性附属器癌临床病理资料Table 1 Clinicopathological data of 2 cases of microcystic adnexal carcinoma
1.2 方法 标本均经10%中性福尔马林固定,石蜡包埋,4μm厚切片,HE染色,光镜观察。免疫组化标记,采用SP法。选用的抗体CK5/6、CK7、P63、CEA、EMA、CK20、Ki-67均购自福州迈新生物技术开发有限公司。
2 结果
2.1 巨检 病例1:附皮肤灰粉色组织一块,大小:3 cm×2 cm×0.8 cm,皮肤面积:1.5 cm×1.2 cm,皮肤表面无异常,切开实性,切面灰白灰粉色,质地中等。
病例2:附皮肤灰褐色组织一块,大小:1.2 cm×0.6 cm×0.5 cm,皮肤面积:1.2 cm×0.6 cm,皮肤之上可见灰褐色突起,大小:0.4 cm×0.3 cm×0.2 cm,高出周围0.2 cm,切开实性,灰白灰褐色,质地中等。
2.2 镜检 表皮结构正常,真皮内瘤细胞由基底样细胞及鳞状细胞呈条索状、小巢状排列(见图1),部分呈腺管样排列,管腔内可见嗜酸性物质(见图2),浅层可见角质囊肿形成。肿瘤细胞轻度异型,胞质淡粉染,部分胞质透亮,胞核卵圆形,轻度不规则,可见小核仁,核分裂像罕见,间质纤维化。肿瘤细胞浸润骨骼肌及神经组织。

图1 正常表皮结构Figure 1 Normal epidermal structure

图2 瘤细胞呈腺管样排列Figure 2 Tumor cells are arranged like glands
2.3 免疫组化结果 所有肿瘤细胞表达CK5/6(见图3)。CK7、EMA及CEA在有腺体特征的区域阳性表达。腺管周围细胞P63阳性,而其中央的细胞阴性(见图4)。CK20阴性。Ki-67增殖指数<5%。

图3 肿瘤细胞CK5/6阳性表达SP法Figure 3 CK5/6 positive expression in tumor cells.SP method
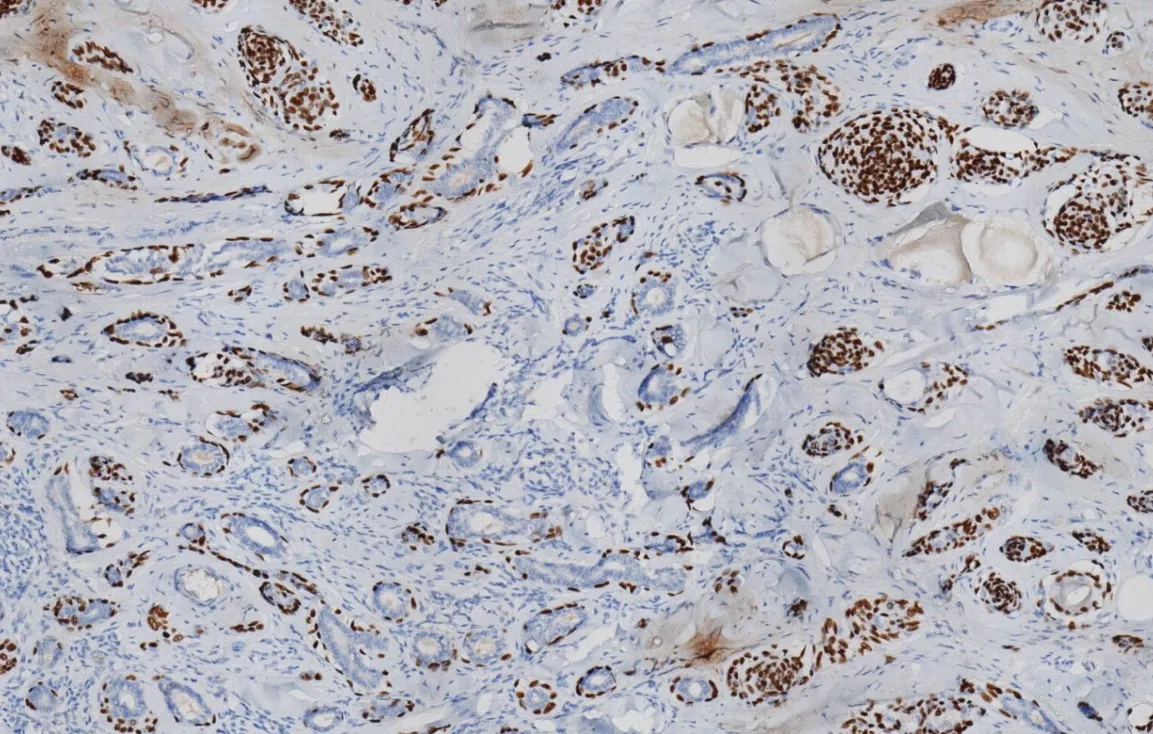
图4 腺管周围细胞P63阳性,而其中央的细胞阴性SP法Figure 4 P63 positive cells around the glandular duct,but negative cells in the center.SP method
2.4 病理诊断 病例1:(左上唇)微囊性附属器癌,侵及神经,底切缘可见肿瘤浸润。病例2:(面部皮肤肿物)微囊性附属器癌,侧切缘及基底切缘见癌组织。
3 讨论
3.1 临床特征 MAC是一种罕见的低度恶性皮肤附属器肿瘤,发病率为1.6%~6.5‰[1],1982年由Goldstein等[2]首先报道。平均发病年龄为68岁,男女比例约2∶3[3]。MAC病因不明,辐射暴露史可能是诱发因素,其他易感因素包括紫外线照射和免疫抑制[4]。绝大多数典型病例发生在头面部,最常见的发病部位为鼻唇部及眼眶周围,此外肿瘤可发生于腋窝、舌和阴茎等部位。临床表现无特异性,以局限性斑块或结节多见,肿瘤边界不清,可有溃疡。MAC生长较缓慢,可持续数月至数十年,本例病史50多年,向深部侵袭性生长,界限不清,可浸润骨骼肌、脂肪及骨,有很高的侵袭神经倾向,17.5%~59%的MAC可见神经浸润[1],引起局部麻木、疼痛或感觉异常。由于MAC浸润较深,肿瘤细胞多见于真皮深部,与周围组织边界不清,其组织学边缘往往超出临床所见,手术不易完整切除。本文报道的2例MAC最初手术切除,切缘均可见肿瘤细胞。
3.2 病理特点 MAC诊断主要依靠组织病理学检查。组织学上表现为表皮结构基本正常,肿瘤位于真皮内,向皮下组织侵袭性生长,可浸润脂肪、肌肉、骨及神经组织。瘤细胞由基底样细胞及鳞状细胞呈条索状、小巢状或腺管样排列,间质为增生的结缔组织。真皮浅层可见小至中等大小的角质囊肿;下部可见腺管结构,其内可见嗜伊红性物质。瘤细胞异型性不明显,核分裂像罕见。少数患者伴皮脂腺细胞分化区,还有部分患者可见相似于毛鞘分化的区域,提示为向毛—皮脂腺—大汗腺单位分化。免疫组化染色无特异性指标,但在MAC的诊断及鉴别诊断有参考价值。瘤细胞索、腺管样结构和角质囊肿CK阳性,表明瘤细胞系向毛发和汗腺分化;腺管样结构CEA及上皮膜抗原EMA阳性,表明向汗腺方向分化[5]。P63在腺管周边的肿瘤细胞中多阳性表达,而其中央的细胞多阴性,这种差异在真皮深部更加明显[6]。Ki-67增殖指数<5%。
3.3 诊断及鉴别诊断 肿瘤来源于多潜能附属器角朊细胞,在发展过程中分化不完善,故组织分化多样,仔细的组织病理学检查是准确诊断的关键,神经周围和肌内侵犯强烈提示MAC的诊断。MAC罕见,实际工作中与之鉴别是非常重要的,因为这些肿瘤的临床处理是完全不同的。主要与以下肿瘤进行鉴别。①结缔组织增生性毛发上皮瘤:该病临床和组织病理与MAC极为相似,取材表浅时易误诊[7]。肿瘤位于真皮内,边界清楚,肿瘤细胞多呈条索状,周围可见明显的纤维组织增生,常见多个毛囊漏斗部角囊肿。但肿瘤与周围组织界限清楚,并无侵袭性生长模式,未侵犯神经的组织学表现,缺少MAC毛囊和汗腺双分化的特点。免疫组化:CK20阳性,CEA阴性可与MAC鉴别。②硬斑型基底细胞癌:肿瘤细胞呈基底细胞样,部分区域与表皮基底细胞相连,排列成团或索状镶嵌在增生的结缔组织中,周边细胞呈栅栏样排列,与周围组织有收缩裂隙,无角质囊肿形成。免疫组化:EMA、CEA均阴性有助于鉴别。③汗管瘤:肿瘤位于真皮浅层,组织学表现为瘤细胞呈导管样、腺样排列,衬覆两层细胞。形成多个囊性扩张的汗腺导管和细胞条索,大多数细胞条索的中央有一个管腔样的空隙,表现为发育不良的汗腺导管。最有特点的病理表现为一端呈导管状,另一端为实体细胞条索,整个形状像蝌蚪或逗号。无浸润性生长及无角质囊肿形成可与MAC鉴别。④鳞状细胞癌:鳞癌细胞异型明显,核分裂像多见,无导管分化的特点;而MAC细胞轻度异型,核分裂像少见。免疫组化:CK7阴性,P63阳性。而MAC在腺管特征的区域CK7阳性表达,P63在腺管周围呈阳性可辅助鉴别。⑤毛发腺瘤:位于真皮内,界清,实性瘤细胞团和多数角质囊肿嵌于纤维血管性间质内,囊壁主要由鳞状上皮构成,有角化现象,囊内含有毳毛结构。
3.4 治疗及预后 目前临床治疗多采用局部扩大切除术或Mohs显微外科手术。MAC局部广泛切除后的复发率为17%~60%,而Mohs显微外科手术为12%[1]。Mohs显微外科手术复发率较低,被报道为MAC的首选治疗方法;使用局部扩大切除术的足够边缘仍无统一标准[8]。已有报道采用放疗及化疗治疗MAC,但其疗效仍有争议[9-10]。MAC是很少发生转移的低度恶性肿瘤[11],40%~60%的患者在标准的广泛局部切除术后6个月至30年内出现1次或多次局部复发[12],完全切除肿瘤对降低复发率非常重要[13]。有MAC病史的患者至少每6个月检查1次,以及时发现复发、转移和其他皮肤癌的发展情况[14]。

