Notch2在肝细胞癌中的表达及相关microRNAs的筛选
陈 虹, 陈 琪, 陶 璇, 林 斓, 黄爱民
肝细胞癌(hepatocellular carcinoma, HCC)是全球范围内常见的恶性肿瘤,虽然针对HCC的治疗水平不断进展,但其预后并未得到有效改善,肿瘤相关死亡率不降反升[1]。Notch信号是进化中高度保守的信号通路,存在4种受体(即Notch1、Notch2、Notch3、Notch4)和5种配体(即DLL1、DLL3、DLL4、Jagged1、Jagged2),具有调控胚胎发育、组织内稳态及细胞分化、增殖、凋亡等作用[2]。在肿瘤中,Notch信号通路的调控作用取决于肿瘤的类型,有的作为“癌基因”,有的则作为“抑癌基因”[3-5]。HCC中Notch信号通路的作用也存在争议,部分研究认为,Notch信号通路受体在HCC中高表达,通过抑制Notch信号通路受体及其靶基因可以抑制HCC的生长,发挥“癌基因”的作用[6-9];另有研究认为,Notch信号通路受体在HCC中发挥的是“抑癌基因”的作用,抑制HCC的生长[10-12]。为进一步明确Notch信号通路受体在HCC中的作用,本研究通过比较Notch信号通路家族4个受体在HCC和癌旁肝组织中的表达量,寻找在HCC中发挥关键作用的Notch信号通路受体。通过分析Notch信号关键受体与HCC临床病理特征的相关性,探讨Notch受体在HCC中的可能作用。应用生物信息学技术筛选可能调控Notch信号关键基因的microRNAs,并在组织中进行验证,以期为深入研究Notch信号通路受体在HCC中的作用机制提供前期实验基础。
1 材料与方法
1.1 材料
1.1.1 样本 收集2011-2017年笔者医院手术切除的原发性HCC标本106例,男性90例,女性16例,年龄中位数56岁(30~71岁)。术前均未进行新辅助治疗。按“Edmondson组织学分级法标准”[13],HCC Ⅰ~Ⅱ级为高-中分化(77例),Ⅲ~Ⅳ级为低分化(29例)。临床分期按“BCLC肝癌临床分期系统”[14],分为0/A期(48例),B/C/D期(58例)。微血管浸润、肝硬化及肝外转移等由病理组织学和影像学资料判断。术前血清甲胎蛋白(alpha-fetoprotein,AFP)水平和乙肝表面抗原(hepatitis B surface antigen,HBsAg)等相关数据来源于病案系统存档资料。分别取HCC和癌旁肝组织的存档蜡块,制成组织芯片行免疫组织化学染色。另收集38例新鲜的原发性HCC组织样本,取HCC组织和癌旁肝组织,进行Notch信号通路受体mRNA的检测;46例新鲜的HCC组织和正常肝组织(取自肝脏血管瘤切除周围的肝组织)进行microRNAs的筛选和Notch2 mRNA的检测。
1.1.2 试剂 Notch2抗体(ab118824,英国Abcam公司);EnvisionTMplus试剂盒(福州迈新生物技术开发有限公司);Notch1、Notch2、Notch3、Notch4和β-actin引物(上海生工公司);Trizol试剂和mRNA逆转录试剂盒(中国赛默飞公司);实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)检测试剂盒(美国Invitrogen公司);miR-146a、miR-16、miR-30b、miR-181a、miR-29b、U6引物以及microRNAs逆转录和实时定量PCR试剂盒(日本TaKaRa公司)。
1.2 方法
1.2.1 RT-qPCR检测 肝组织匀浆Trizol抽提RNA,37 ℃逆转录为cDNA,microRNAs和Notch1、Notch2、Notch3、Notch4在ABI7500定量PCR仪上扩增和检测,反应条件分别为:95 ℃预变性 30 s,95 ℃ 5 s→60 ℃ 34 s,40个循环;95 ℃预变性 60 s,95 ℃ 15 s→60 ℃ 20 s,40个循环。各样本mRNA和microRNAs相对表达水平采用相对定量(relative quantity,RQ)法(RQ=2-△△Ct)计算,以实验组目的基因相对对照组基因的倍数来比较不同样品基因表达的差异。每个反应设3个复孔,结果取平均值。Notch1、Notch2、Notch3、Notch4选用β-actin作为内参;miR-146a、miR-16、miR-30b、miR-181a、miR-29b选用U6作为内参,引物序列见表1。

表1 RT-qPCR引物序列
1.2.2 组织芯片免疫组织化学染色 106例HCC组织样本先经H-E染色,显微镜下圈定HCC组织和癌旁肝组织,分别取3个组织芯(每个孔径约2 mm)制成组织芯片,厚度3~4 μm,常规脱蜡水化,经EnvisionTMplus免疫组织化学二步法染色,显微镜下观察。Notch2抗体稀释度为1∶300,阳性细胞定位于细胞质和细胞核。每个病例于高倍镜视野(400×)下计数500个细胞。当细胞质和细胞核出现中重度染色强度的棕黄色、棕褐色颗粒,阳性肿瘤细胞比例≥10%定义为阳性;中重度染色强度的肿瘤细胞<10%或呈现为微弱棕黄色或不着色均定义为阴性。以上资料均由2位病理科医师以双盲的形式独立评估获得。
1.2.3 蛋白免疫印迹法(Western-blot)检测 取新鲜HCC组织和癌旁正常肝组织4例,液氮中研碎洗涤离心后取上清液。采用Bradford法检测蛋白浓度,15%聚丙烯酰胺凝胶电泳、转膜、封闭,Notch2抗体孵育过夜,二抗孵育后显色,凝胶电泳图像Image J系统分析目的条带的分子量和灰度值。
2 结 果
2.1 Notch信号通路受体mRNA在HCC组织和癌旁肝组织中的表达 RT-qPCR检测结果显示,HCC组织中Notch1 和Notch4 mRNA的相对表达量均低于癌旁肝组织,癌旁肝组织表达量分别是HCC组织的1.3和1.5倍,但差别无统计学意义(P>0.05);而Notch2和Notch3 mRNA的相对表达量均高于癌旁肝组织,其中Notch2 mRNA是癌旁肝组织的2.1倍,差别有统计学意义(P<0.05),Notch3 mRNA是癌旁肝组织的1.4倍,差别无统计学意义(P>0.05)(图1)。
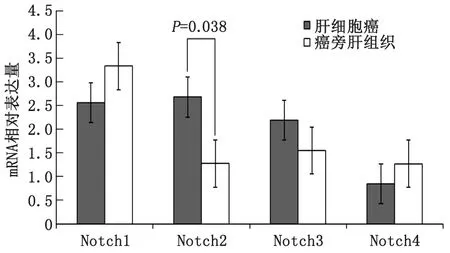
图1 Notch信号通路受体家族成员在肝细胞癌和癌旁肝组织的表达情况
2.2 Notch2蛋白在HCC组织和癌旁肝组织中的表达 免疫组织化学检测显示,Notch2蛋白主要定位于细胞质和细胞核。HCC组织中除了细胞质以外,部分细胞核也有阳性表达,阳性表达率为37.7%(40/106);癌旁肝组织中主要表现为细胞质着色或不着色,阳性表达率为23.6%(25/106),明显低于HCC组织(P<0.05,图2)。Western-blot检测显示,HCC组织Notch2蛋白表达高于癌旁肝组织,差别有统计学意义(P<0.05,图3)。
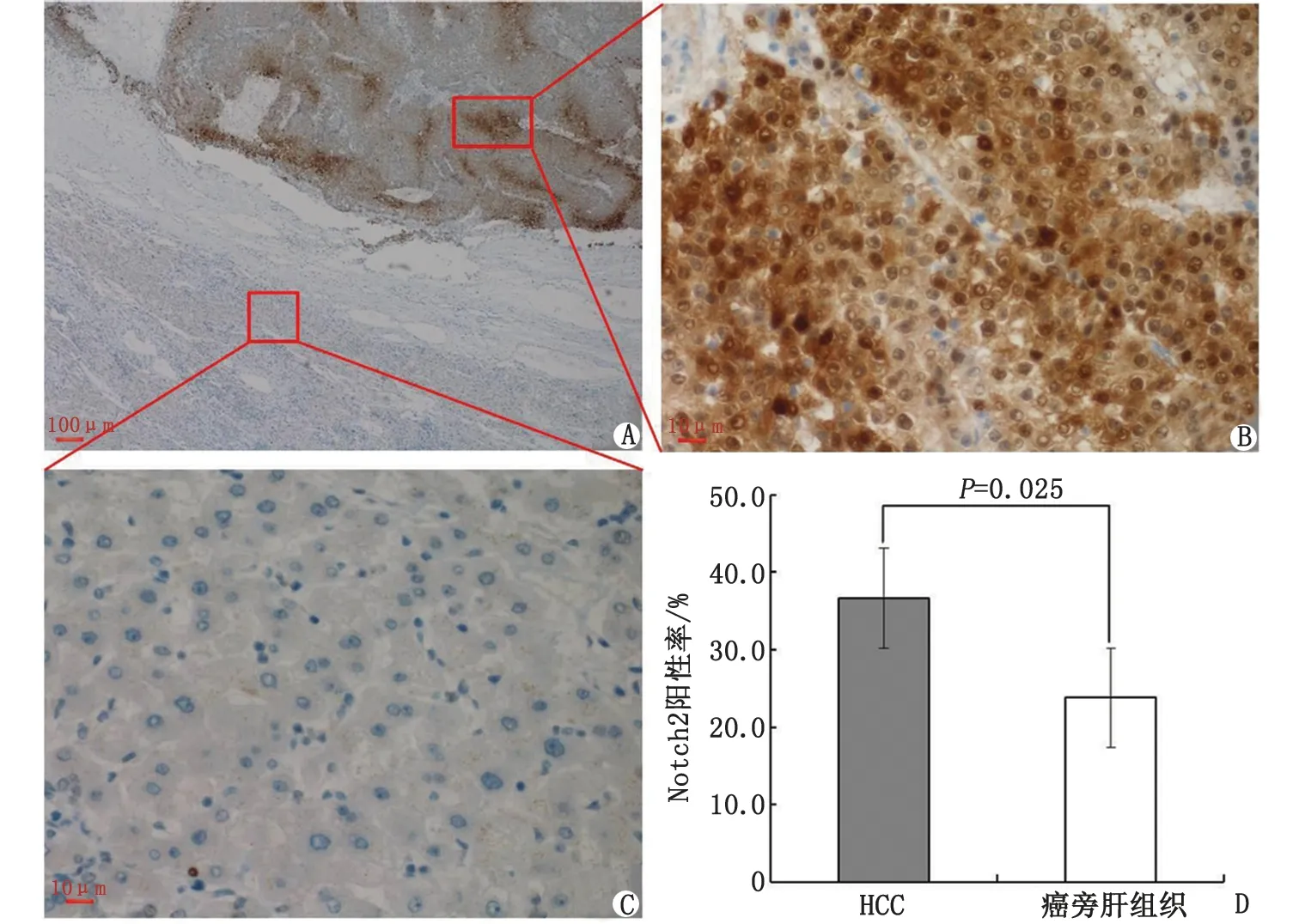
HCC:肝细胞癌。A:HCC组织Notch2蛋白呈阳性表达,癌旁肝组织呈阴性表达(Envision×40);B:HCC组织中Notch2在胞质和胞核中呈棕褐色强阳性表达(Envision×200);C:癌旁肝组织中Notch2蛋白在胞质中呈微弱棕黄色颗粒,为阴性表达(Envision×200);D:Notch2蛋白在HCC组织的阳性表达率高于癌旁肝组织(P<0.05)。
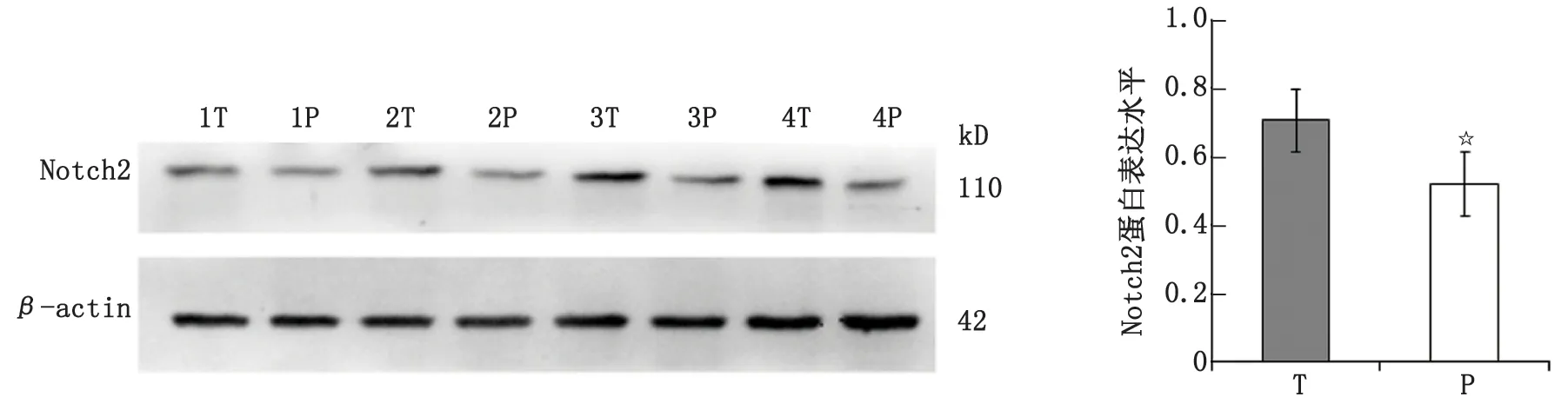
HCC:肝细胞癌,T:HCC组织;P:癌旁肝组织。☆:P<0.05。
2.3 HCC组织中Notch2蛋白的表达与其临床病理特征的关系 HCC组织中,Notch2蛋白在复发、肝外转移及B-D期的HCC患者中的表达水平明显高于未复发、未转移和0-A期的患者(P<0.05),而与患者的性别、年龄、术前血清AFP水平、HBsAg状态、微血管浸润、有无肝硬化及组织学分级无关(P>0.05,表2)。
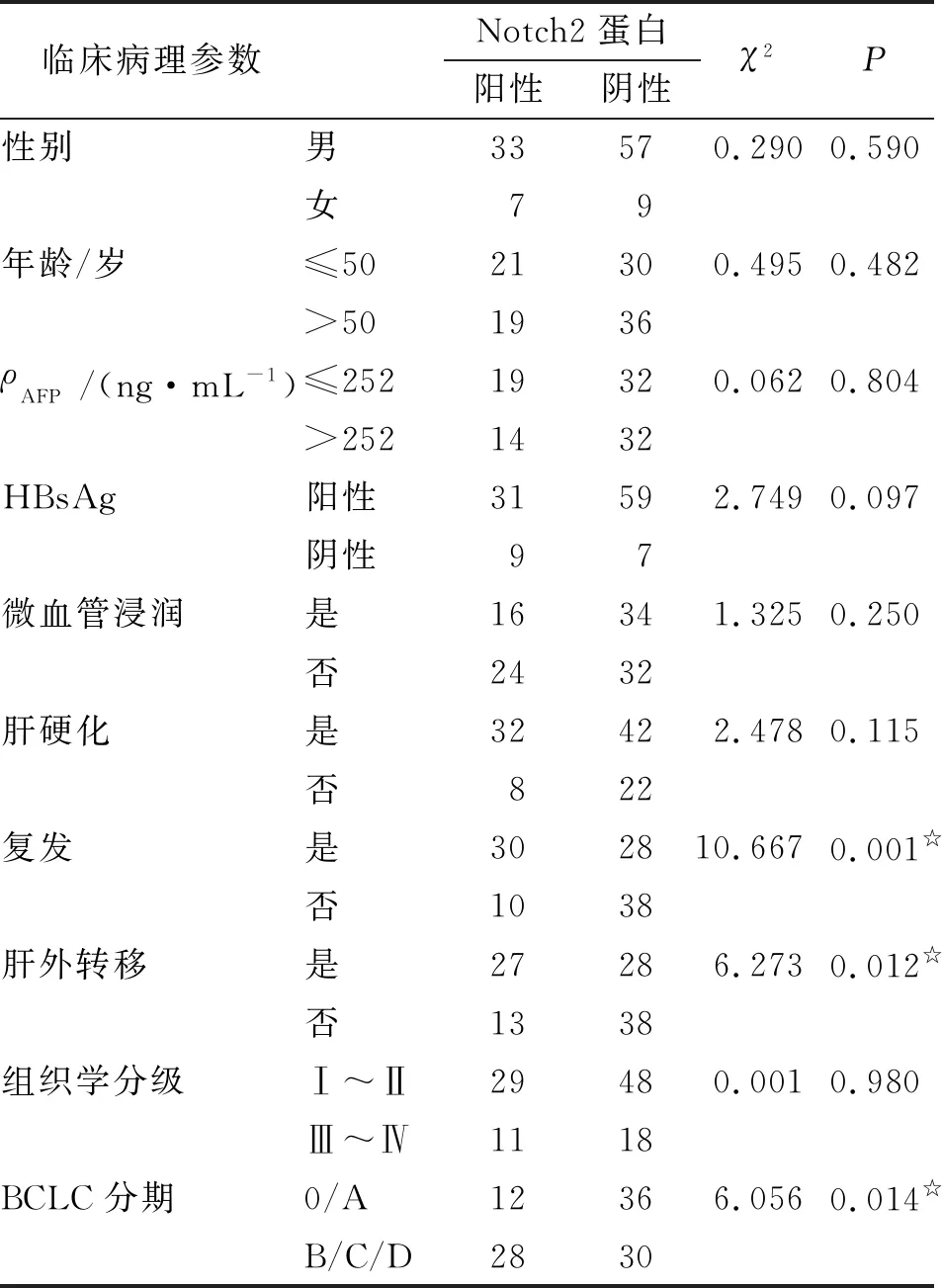
表2 HCC中Notch2蛋白的表达与其临床病理特征的关系
2.4 生物信息学预测筛选与Notch2靶基因可能相关的microRNAs 通过microRNAs预测软件TargetScan、ENCORI、miRWalk获取Notch2基因相关的microRNAs,分别获取1 448、274和2 228个,取交集后得157个(图4),包含本研究的microRNAs。同时,进一步在http://www.mirbase.org和https://bibiserv.cebitec.uni-bielefeld.de/上进行验证,最后通过评估microRNAs的综合相关评分(context++score percentile,Pct)等相关参数,选择5个microRNAs进行验证。再用GEO数据库在线分析工具GEO2R分析GSE21362数据集,筛选出30个与HCC组织Notch2相关的差异显著的microRNAs(P<0.01,|log2FoldChange|>1),其中包括miR-146a(P=0.00,log2FoldChange =-1.04)。靶基因Notch2和miR-16、miR-146a、miR-30b、miR-181a、miR-29b互补配对的序列见图5。
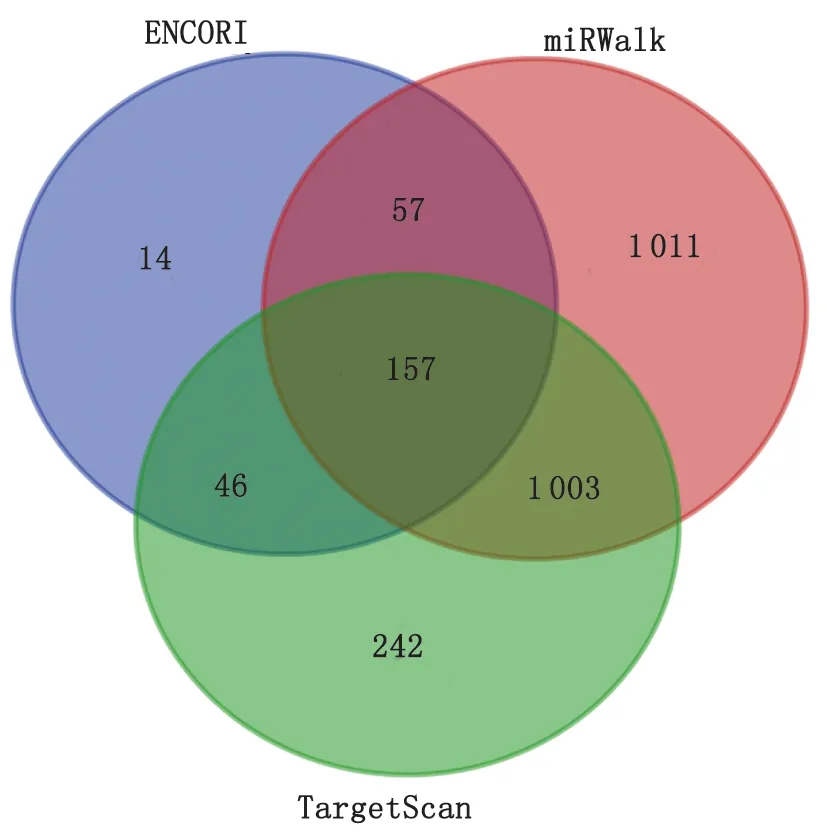
图4 生物信息数据库预测Notch2基因相关microRNAs的交集图

图5 Notch2和miR-146a、miR-181a、miR-16、miR-30b、miR-29b互补结合位点
2.5 Notch2相关microRNAs在HCC组织和正常肝组织中的表达 应用RT-qPCR对以上5种与Notch2相关的microRNAs进行检测,结果显示,正常肝组织的miR-30b、miR-181a和miR-29b的相对表达量高于HCC组织,而miR-16的相对表达量低于HCC组织,4种microRNAs在正常肝组织和HCC组织的相对表达量差别均无统计学意义(P>0.05)。而正常肝组织的miR-146a相对表达量是HCC组织的1.8倍,差别有统计学意义(P<0.05,表3)。
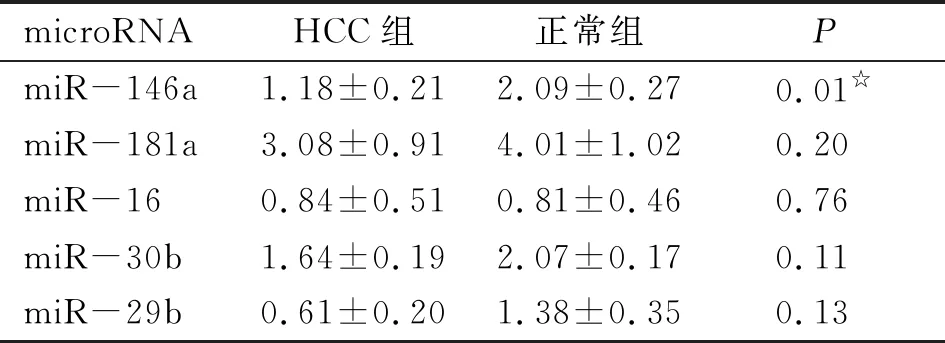
表3 microRNAs在HCC组织和正常肝组织中的表达情况
2.6 HCC组织中Notch2和miR-146a表达的相关性 分析46例HCC组织中Notch2和miR-146a相对表达量,发现Notch2 mRNA在HCC组织中的表达高于正常肝组织,而miR-146a在HCC组织的表达量低于正常肝组织,两者呈现相反的趋势。通过Pearson′s相关分析发现,Notch2和miR-146a在HCC组织中的表达呈明显负相关,差别有统计学意义(P<0.05,图6)。
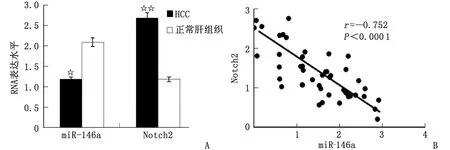
HCC:肝细胞癌。A:HCC组织中Notch2 mRNA的相对表达量明显高于正常肝组织(☆☆:P=0.043),而miR-146a表达量则明显低于正常肝组织(☆:P=0.010);B:Pearson′s相关分析显示,HCC组织Notch2和miR-146a的表达呈明显负相关(r=-0.752, P<0.0001)。
3 讨 论
Notch信号通路受体在HCC中的作用报道不一。Gao等[6]研究发现,激活Notch1可促进HCC细胞的增殖和生长;而Viatour等[11]却发现,活化Notch信号通路受体使转录因子E2F失活,导致HCC细胞生长变慢;过表达Notch1诱导细胞凋亡,抑制HCC细胞生长[12]。HCC组织中Notch2的表达水平是上调还是降低,相关研究的结果也不一致[15-16]。为明确Notch信号通路受体在HCC中的作用,本研究检测HCC和癌旁肝组织中Notch信号通路4个受体的mRNA表达量,结果发现,HCC组织和癌旁肝组织中Notch1、Notch3和Notch4的表达并没有明显差异,只有Notch2的表达量有显著差异,推测Notch2可能是HCC中发挥关键作用的Notch信号通路受体。当然,Notch信号通路受体家族在不同研究中的结果也大相径庭,可能与不同研究纳入的人群不同有关。
Notch2蛋白在HCC组织中的表达水平高于癌旁正常肝组织,这与Notch2 mRNA水平的表达是一致的。免疫组织化学形态学显示,HCC组织和癌旁肝组织Notch2的阳性表达定位不同,阳性细胞在HCC组织定位于细胞质和细胞核,在癌旁肝组织则定位于细胞质,这种差异可能与Notch2的功能状态相关。众所周知,Notch信号受体与相邻细胞间配体结合后,受体经2次蛋白水解作用被分为胞外段和胞内段,其中胞内段从细胞质转移到细胞核调控下游靶基因,而胞外段则与其结合的配体胞外段一起被细胞内吞[17]。HCC组织中既有细胞质亦有细胞核的阳性表达,推测HCC组织和正常肝组织中Notch2的功能处于不同状态,当Notch2的胞内段从细胞质转移到细胞核时,开始发挥其激活下游靶基因的生物学效应。HCC复发、肝外转移和BCLC分期高的患者,Notch2蛋白的阳性表达率较高,提示Notch2蛋白高表达可作为预测HCC复发或转移的生物标志物。BCLC高分期的HCC患者,Notch2蛋白高表达,与文献报道一致[18]。
microRNAs是基因在转录后表达水平的重要调控因子,调控大量的癌基因和抑癌基因[19]。已知多种microRNAs的靶基因作用于HCC的发生、进展相关的信号通路,调控HCC细胞的增殖、侵袭和凋亡等过程[20-21]。本研究通过生物信息学预测软件TargetScan、ENCORI、miRWalk获取Notch2基因相关的microRNAs,取交集后共获得157个microRNAs,miRBase和BiBiServ进一步筛选,GEO数据库在线分析工具GEO2R分析验证,发现miR-146a在HCC组织和癌旁肝组织中的表达量有明显差异(P=0.00,log2FoldChange=-1.04)。本研究选择46例HCC组织对所筛选的5个microRNAs进行验证,同样发现miR-146a在HCC组织和正常肝组织中的表达量有明显差异。进一步研究发现,在HCC组织中,miR-146a低表达,而Notch2高表达,两者的表达情况恰好相反,推测miR-146a与Notch2可能存在调控关系。相关分析显示,HCC组织中,Notch2的表达和miR-146a呈明显负相关,提示Notch2可能是miR-146a调控的下游靶基因。既往研究发现,miR-146a在HCC中通过调控不同的靶基因发挥不同的抗肿瘤作用。miR-146a下调表达TRAF6抑制HCC细胞的增殖和浸润[20],下调VEGF抑制HCC细胞转移[22],miR-146a还可通过STAT3调控HCC细胞的抗肿瘤免疫抑制[23]。因此,HCC组织中可能还存在miR-146a调控的其他信号通路。本研究结果提示,Notch2可能是miR-146a调控HCC的又一个靶基因,为将来进一步研究miR-146a和Notch2在HCC中具体的调控机制奠定前期理论基础。

