粗皮桉近红外光谱差异与其遗传差异间的关系
王楚彪,杨 艳,白卫国,林 彦,谢耀坚,卢万鸿*,罗建中
1.国家林业和草原局桉树研究开发中心遗传育种研究室,广东 湛江 524022 2.南京林业大学林学院,江苏 南京 210037 3.湛江科技学院经济与金融学院,广东 湛江 524094 4.广西国有东门林场,广西 崇左 532199
引 言
粗皮桉天然分布于新几内亚岛南部和澳大利亚昆士兰州北部,其不同种源的生物学特征和生长适应性均具有很大的遗传差异[1]。在炎热潮湿的热带地区,粗皮桉良好的抗病虫害能力使其逐渐取代金合欢属(Acacia)树种,成为地区重要的造林树种[2]。巴西、东南亚等国对粗皮桉进行了大量的引种和高世代改良[3]。国内系统的粗皮桉引种改良始于20世纪80年代,并于2011年在两广多地建立了其高世代育种群体[4]。粗皮桉在国内主要作为杂交亲本用于开发桉树优良无性系,并针对其开展速生、抗病虫害等杂交育种理论研究。
摸清育种群体的遗传亲缘关系是推动粗皮桉群体世代改良的基础工作。目前常用的表型数据分析方法很难精确估算家系的遗传和环境分量。DNA生物信息学分析专业要求高,程序复杂且成本高。鉴于此,本研究计划通过对比基于DNA分析的遗传距离和基于NIRs分析的光谱距离间的关系,探索近红外光谱技术用于粗皮桉群体遗传基础分析的精度和可行性。
1 实验部分
1.1 材料
研究对象为粗皮桉育种群体试验中的23个天然种源(表1)。遗传材料基本涵盖了粗皮桉的天然原生地,即澳大利亚昆士兰州(QLD, AUS)北部和新几内亚岛(New Guinea Island)南部(印度尼西亚(Indonesia)和巴布亚新几内亚(Papua New Guinea, PNG))。两地被大洋分隔,最近的海岸线距离约为150 km。在粗皮桉大田群体试验中,每家系采集10~15片新鲜叶样,每个种源采样8~12个家系代表该种源。叶样尽快置于-30 ℃冰箱,用于后续遗传分析及NIRs信息采集。

表1 粗皮桉23个天然种源信息
1.2 光谱仪器
手持式近红外仪Phazir Rx(1624)(Polychromix, Thermo Scientific, USA)用于叶样NIRs的采集。Phazir Rx波长范围为1 600~2 400 nm,分辨率12 nm,单次扫描获得100维向量数据,自带背景校正,内置可编程的MEMS技术微衍射光栅。
1.3 方法
1.3.1 光谱采集
光谱采集样本与DNA分析样本完全对应,每个家系选择4~6片外形健康的叶片,置于ClassicLine干燥箱(BINDER,德国),设置60 ℃,72 h,以至绝干。用中药打粉机粉碎后装入透明自封口塑料袋。用Phazir Rx(1624)隔袋扫描5次,其均值代表该样品的近红外NIRs信息[5],每个种源共获得8~12条NIRs。
1.3.2 NIRs数据的预处理和分析
经不同的预处理效果对比后,本研究对NIRs原始数据进行Savitzky-Golay平滑的二阶导数预处理[6-7]。采用全交互式内部交叉验证算法,建立目标种源的主成分分析(PCA)模型,通过簇类独立软模式(SIMCA)判别分析,统计对比种源到目标种源模型间的NIRs光谱距离。基于NIRs欧氏距离(Euclidean distance)按全链接算法(Complete linkage),对测试种源进行层级聚类(Hierarchical clustering)。根据样本NIRs数据PCA的因子得分图分析种源间的遗传亲缘关系及其遗传变异。NIRs数据的预处理和分析均由The Unscrambler x10.4(CAMO, Oslo, Norway)实现。
1.3.3 样本遗传距离计算
通过全基因组重测序(Whole Genome Resequencing)方法获得粗皮桉种源各家系的DNA信息,根据Kimura提出的核苷酸序列差异原理,使用Mega-X软件估算粗皮桉种源间的遗传距离[8-9]。
2 结果与讨论
2.1 粗皮桉种源间的遗传距离与其NIRs光谱距离
粗皮桉新几内亚岛7个种源间的平均遗传距离为0.186,昆士兰州16个种源间的平均为0.157(数据冗余,未列出)。表2为新几内亚岛与昆士兰州2大区域种源间的遗传距离。数据显示,2大区域种源间的最小、最大及平均遗传距离分别为0.229,0.370和0.295,明显大于区域内种源间的遗传距离。新几内亚岛种源A20659,S16120,S16121和S16122与昆士兰州各种源间的遗传距离均超过了0.300。2大区域内和区域间种源间遗传距离的差异,说明区域分隔(海洋)明显拉大了粗皮桉种源间的遗传亲缘关系。

表2 粗皮桉新几内亚岛种源与昆士兰州种源间的遗传距离
利用NIRs光谱距离可以从不同角度解析、印证样本间的内在遗传差异。表3为粗皮桉新几内亚岛种源与昆士兰州种源间的NIRs光谱欧式距离。数据显示,2大区域种源间NIRs平均光谱距离大小与其遗传距离的大小趋势基本一致,如种源S16120与昆士兰州种源间的平均遗传距离最大(0.370),两者之间的平均光谱距离(0.220)也明显大于其他种源间的光谱距离。偶有例外,S16122与昆士兰州种源间的平均光谱距离就与其遗传距离的大小关系相悖。种源A17854与昆士兰州种源间的NIRs光谱距离偏大可能与其有效样本偏少有关。

表3 粗皮桉新几内亚岛种源与昆士兰州种源间的NIRs欧氏距离
因实际值太小,表中所列光谱距离为实际数值放大100倍后的结果。
2.2 粗皮桉种源基于NIRs光谱距离的层级聚类
图1中粗皮桉天然种源的NIRs层级聚类显示,23个种源的聚类效果在一定程度上印证了其遗传距离、光谱距离的差异。巴布亚新几内亚岛的S16120,S16121和S16122与昆士兰州种源间的遗传距离和光谱距离均大于其他种源间的两类距离,也基本显示了与昆士兰州种源的分别聚类。但23个种源并没有完全按照巴布亚新几内亚岛和昆士兰州2大地域分别聚类,来自巴布亚新几内亚的种源A18197,A17854,A18199及A20659与多数来自昆士兰州的种源聚在了一起。这或与几个种源的海拔较低(<50 m),且两大地域间的地理距离比较接近,地域间存在花粉、种子或传粉媒介等某种形式的基因交流有关。
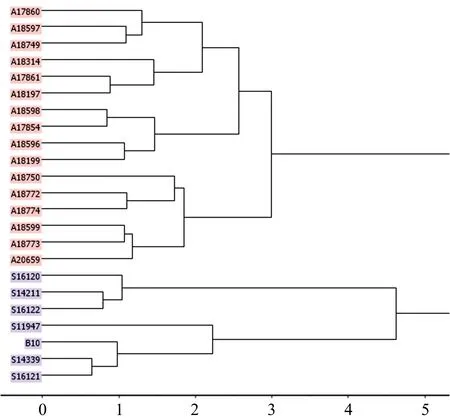
图1 粗皮桉23个种源基于叶样NIRs欧氏距离的层级聚类
2.3 粗皮桉巴布亚新几内亚岛种源与昆士兰种源间的主成分分析
由于巴布亚新几内亚岛种源与昆士兰种源间的遗传距离普遍较大,因此,主要列举了2大区域种源间的PCA主因子得分聚类结果。图2中巴布亚新几内亚岛内种源S16120与A18199间(a),及S16120与昆士兰州种源A18750间(b)相同主因子的因子得分显示,不仅不同地理区域的种源可以清晰聚类(S16120与A18750),同一地理来源的种源也可以清晰地区分(S16120与A18199)。对比种源间的遗传距离大小及其PCA主因子的得分图,遗传距离小的种源间其因子得分有可能将其清晰地区分;而遗传距离大的种源间,其因子得分有可能存在严重的重叠,这可能与种源内家系间的遗传变异较大有关。研究中大多数种源间的PCA主因子得分都显示出清晰的聚类,为免冗余,未一一展示。
图2显示种源S16120与B10(c)和S14339(d)不能清晰区分,这与它们之间具有较大的遗传距离不符,可能是种源B10和S14339内家系间存在较大的遗传变异,从其非常分散的因子得分图也能看出。另外,图2各种源因子得分的聚集度各不相同,B10和S14339的得分比较分散,而S16120,A18199和A18750的得分则相对集中,影响了种源间的相互区分。从遗传角度也反映了种源内家系间的遗传变异信息,分散可能表明其遗传变异大,集中则表示遗传变异小。
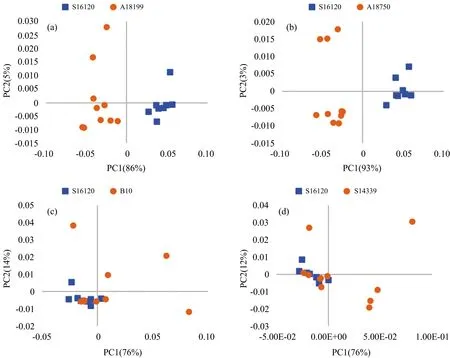
图2 粗皮桉种源间的PCA因子得分图(部分)
2.4 主成分分析中不同波段的因子载荷


图3 种源S16120与A17861的PCA分析中第一主因子不同波段的载荷(其他种源间因子载荷与此相似)
3 结 论
对比粗皮桉天然种源间的遗传距离与其NIRs光谱距离间的关系发现,种源遗传距离与其光谱距离间普遍存在正相关关系,但个别种源间的遗传距离与其光谱距离呈负相关。种源NIRs聚类结果与地理距离间的关系也非完全对应,这印证了粗皮桉群体不同地域间的基因交流对其遗传亲缘关系有较大的影响。NIRs数据的PCA聚类显示,遗传或光谱距离大的种源间存在严重重叠,而遗传或光谱距离小的种源样本反而会清晰聚类,这既表明了NIRs信息的敏感性,也在一定程度反映了粗皮桉各种源内存在不同水平的遗传变异。

