狮源猫细小病毒分离鉴定及其VP2 基因序列分析
吕梦娜,韦柳明,单 芬,彭仕明,陈 武,翟俊琼
(1.广州动物园,广州市野生动物研究中心,广东广州 510070;2.华南农业大学兽医学院,广东广州 510642)
猫细小病毒(feline parvovirus,FPV)又名猫泛白细胞减少症病毒(feline panleukopenia virus),是造成动物患上猫泛白细胞减少症(feline panleukopenia,FPL)的病原[1]。FPL 是一种高度传染性和致死性疾病,其临床特征是急性肠炎,出现严重脱水和败血症,以淋巴衰竭和全血细胞减少为显著特征[2-3]。FPV 已经被欧美地区多个国家定义为严重的猫传染病之一。1957 年Bilin 首次分离培养出该病毒,1964 年Johnson 从豹的脾脏中也分离出FPV[4]。
FPV 是无囊膜的单股DNA 病毒,其病毒粒子直径为20~24 nm,呈二十面体对称结构。
FPV 的衣壳蛋白由VP1、VP2、VP3 组成,其中VP2 占90%,为最主要的结构蛋白,决定宿主范围和病毒与宿主的相互作用[5]。FPV 基因组全长4~6 kb,相对分子质量为(1.5~2.0)×106。FPV 在自然界中分布极为广泛,对外界因素抵抗力强[6],60 ℃加热30 min 不能使其完全灭活;对乙醚、氯仿和丙酮等脂溶性溶剂和酸、碱、酚(0.5%)及胰蛋白酶都有抵抗力,0.2%~0.5%甲醛溶液处理20~24 h 能够使其灭活,0.5%福尔马林和0.175%次氯酸钠能有效将其杀灭[7-8]。
研究表明,FPV 在自然条件下可感染虎、豹、狮等大型猫科动物[3,9-12],而小型猫科动物和水貂最易感[13]。国外研究者还曾对俄罗斯远东地区的野生东北虎进行FPV 抗体检测,发现抗体阳性率很高[14]。在我国,FPV 全年流行,尤其是冬季及初春季节。目前,国内对狮源FPV 的研究较少。为此,本研究通过细胞培养从非洲狮粪便中分离得到1 株FPV,并对其VP2基因进行扩增和序列分析,以了解FPV 的遗传进化情况,对该病的诊断和治疗提供依据,也为后期相关疫苗的研制打下基础。
1 材料与方法
1.1 细胞、病料及主要试剂
本研究所用的猫肾细胞F81,由华南农业大学兽医学院微生物教研室馈赠,由本实验室培养和冻存;病料,由广东省某动物园提供,且经胶体金试纸条检测为细小病毒阳性;病毒总RNA/DNA 提取试剂盒,购自AXYGEN;胶回收试剂盒,购自OMEGA;pMDTM19-T 载体、反转录试剂盒、ExTaq酶、DH5α 感受态细胞,均购自TAKARA;胎牛血清、DMEM 培养基、PBS 缓冲液和0.25%胰蛋白酶,购自Gibco。
1.2 引物设计
登录NCBI 查找细小病毒序列,用Primer premier 5.0 设计并合成2 对特异性引物。其中:1对为鉴定细小病毒引物,目的条带大小约为600 bp(F1:5'-AAAGAGTAGTTGTAAATAATT-3';R1:5'-CCTATATAACCAAAGTTAGTAG-3');1 对为扩增细小病毒VP2基因引物,目的条带大小约为1 800 bp(F2:5'-ATGAGTGATGGAGCAGTTCA-3';R2:5'-GGAATATAATTTTCTAGGTGCTAGT-3')。2 对引物均由北京擎科生物科技有限公司合成。
1.3 病料收集与处理
采集广东省某动物园疑似感染FPV 的非洲狮粪便,用适量已灭菌的PBS 稀释成悬液并加入青、链霉素,涡旋振荡后12 000 r/min 4 ℃离心10 min,取上清液经0.22 μm 过滤除菌后-80 ℃保存备用。
1.4 病毒分离培养与鉴定
常规方法培养F81 细胞,待细胞长满单层后,弃培养基,用PBS 小心清洗后,加入0.25%的EDTA 胰蛋白酶进行消化,待细胞逐渐脱落时,加入含10%胎牛血清和1%双抗的DMEM 培养基终止消化并吹打均匀。细胞传代的同时,在培养液中按体积比1/10 的量接种处理好的病毒滤液,同时设立不接毒的对照组,置于37 ℃、5% CO2培养箱中培养。待细胞长至80%左右,若还未产生细胞病变(CPE)则将培养液更换为含2%胎牛血清、1%双抗的DMEM 培养基,继续观察3~4 d,每天观察有无产生CPE;若无CPE,盲传4~5 代,仍无弃之。若出现CPE ≥80%,则反复冻融3 次收毒,提取细胞培养物DNA,使用鉴定引物按照25.0 μL反应体系(Primemix ExTaq酶12.5 μL,上下游引物各1.0 μL,模板1.0 μL,ddH2O 9.5 μL)进行PCR 扩增(95 ℃预变性4 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸40 s,共30 个循环;最后72 ℃终延伸10 min),产物经1.0%琼脂糖凝电泳观察结果。若条带大小相符,送至北京擎科生物科技有限公司测序。
1.5 VP2 基因扩增、测序及序列分析
以1.4 中提取的DNA 为模板进行PCR 反应,扩增VP2基因序列(反应体系、程序以及操作同1.4);电泳后切胶回收目的条带大小的产物,将其连接到pMDTM19-T 载体,转化至DH5α 感受态细胞后,涂布于含Amp+的LB 平板;待平板上形成肉眼可见的单个菌落后,挑取单个菌落摇菌提取质粒,将鉴定为阳性的质粒送至北京擎科生物科技有限公司测序。将测序结果与NCBI 上的26 个序列(表1)进行比较,用软件MEGA 6.06 分析本研究得到的VP2基因与参考毒株的遗传进化规律,用MegAlign 分析核苷酸序列同源性。
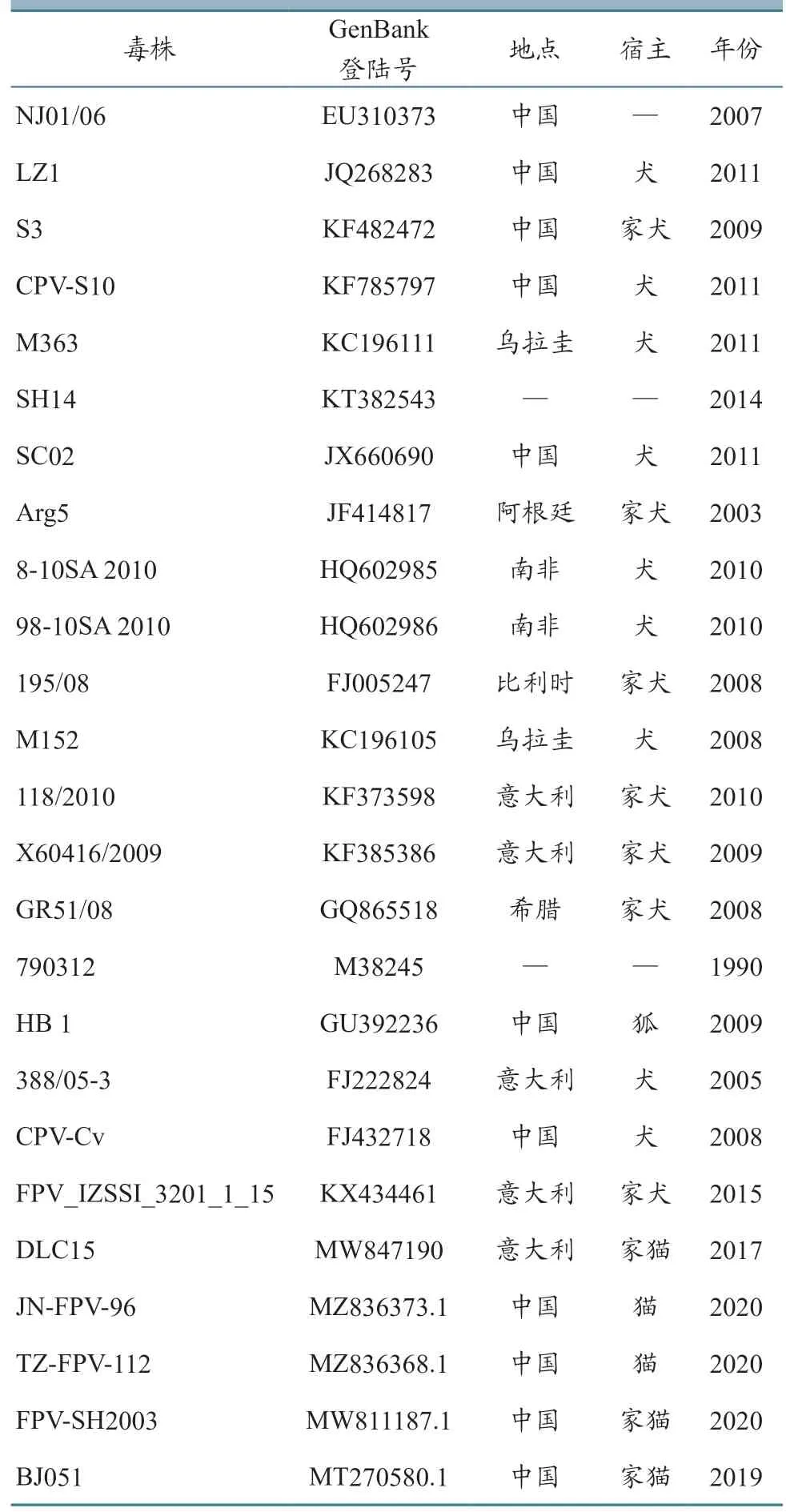
表1 参考毒株信息
2 结果
2.1 病毒分离与鉴定
病毒滤液接种F81 细胞,盲传至第3 代,48 h后细胞发生典型病变,表现为细胞拉丝现象,随后,细胞间隙慢慢变大,逐渐脱落(图1)。经细小病毒特异性引物PCR 扩增,1%琼脂糖凝胶电泳检测,在600 bp左右处出现特异性条带且对照组为阴性,与预期目的条带片段大小一致(图2),测序结果经比对确定为FPV,并将该毒株命名为FPV CHNHN-1。
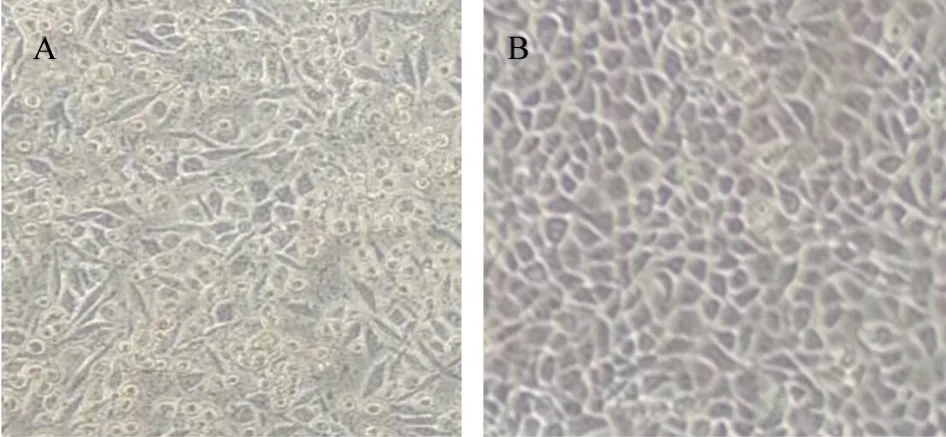
图1 细胞接毒培养结果
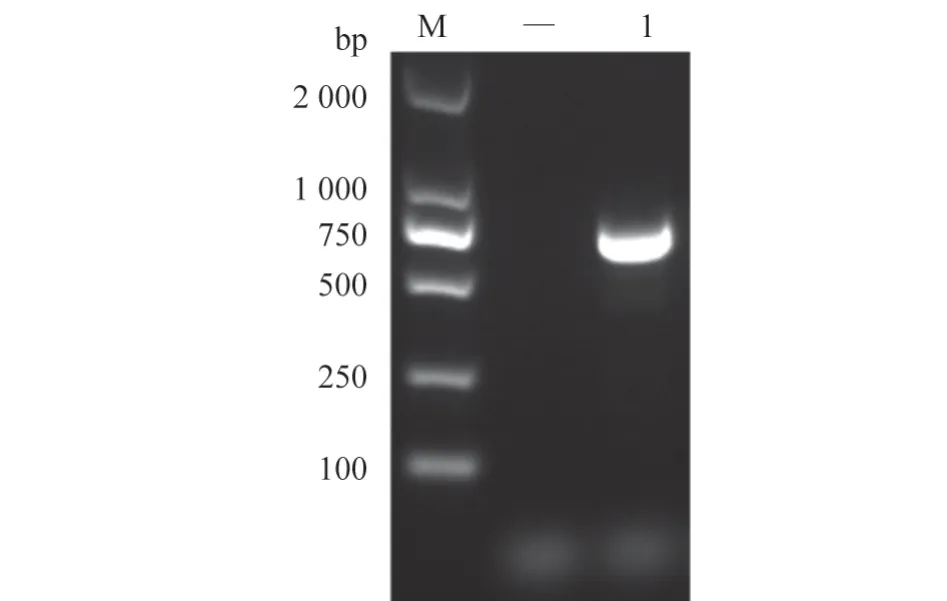
图2 病毒培养液PCR 鉴定结果
2.2 VP2 基因序列扩增与测序
经细小病毒VP2特异性引物扩增,1%琼脂糖凝胶电泳检测,发现在1 800 bp 左右处出现特异性条带,与预期目的条带大小一致(图3),经连接、转化后,提取质粒、测序、拼接得到FPV CHNHN-1 毒株的VP2基因序列。
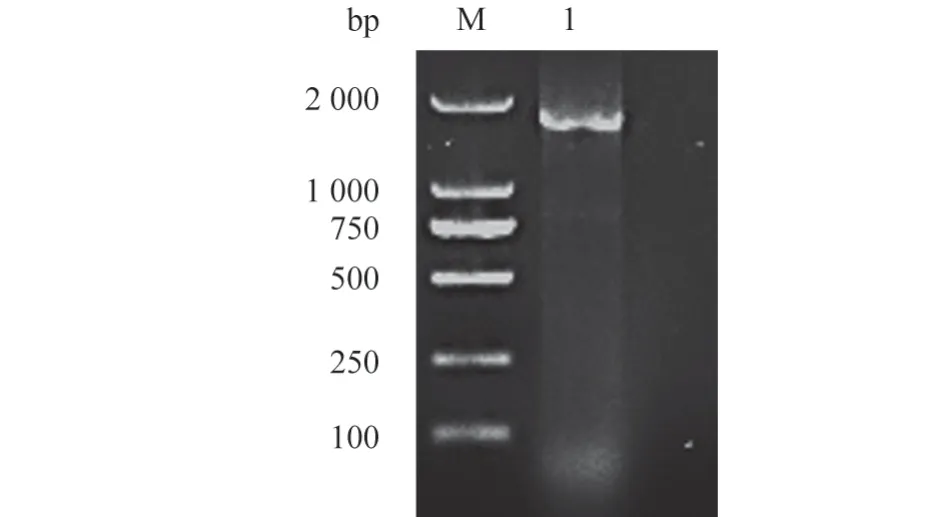
图3 VP2 基因扩增结果
经序列分析发现,FPV CHN-HN-1 毒株VP2蛋白的6 个决定宿主差异的氨基酸位点80、93、103、323、564 和568 位均未发生改变(图4),而当80、564 和568 位分别为赖氨酸、天冬酞胺和丙氨酸时,细小病毒只能在猫科动物体内增殖。
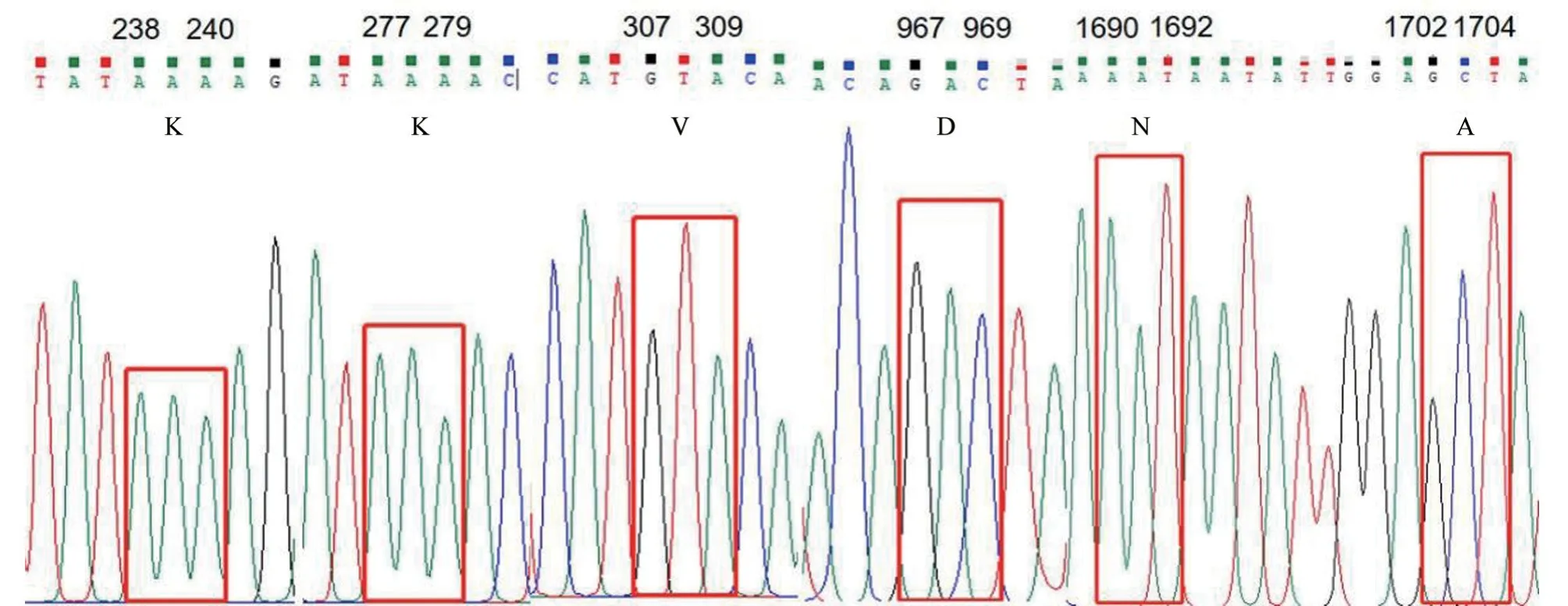
图4 VP2 基因测序峰图
2.3 VP2 基因序列分析
将FPV CHN-HN-1 的VP2基因序列与GeneBank 上公布的26 株参考株VP2基因序列进行同源性比对。由图5 可知,分离株FPV CHNHN-1 与GeneBank 上公布的其他26 株毒株同源性在97.8%~100%,其中与JN-FPV-96(MZ836373.1)、TZ-FPV-112(MZ836368.1)、FPV-SH2003(MW811187.1)、BJ051(MT270580.1)相似性最高,均为100%;而与98-10SA2010(HQ602986.1)、118/2010(KF373598.1)相似性最低,均为97.8%。
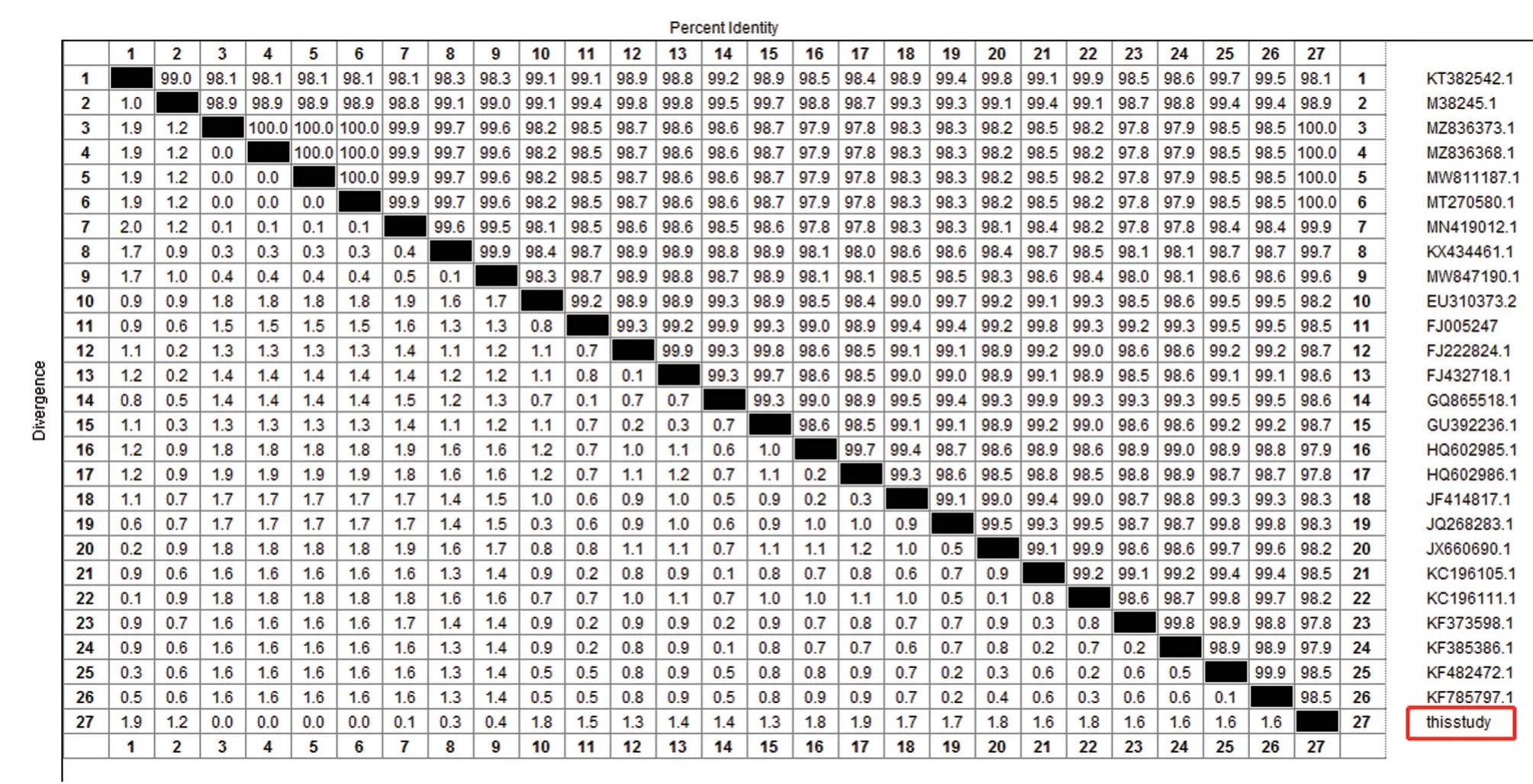
图5 VP2 基因核苷酸同源性分析结果
2.4 VP2 基因遗传进化树分析
使用MEGA6.06 软件将FPV CHN-HN-1 毒株与国内外26 株细小病毒VP2基因核酸序列进行比对,构建遗传进化树。结果(图6)显示,FPV CHN-HN-1 株与其他7 株FPV 同属一个大的分支,与JN-FPV-96、TZ-FPV-112、FPV-SH2003、BJ051遗传距离最近,与其他犬源和狐源的细小病毒参考毒株遗传距离较远。
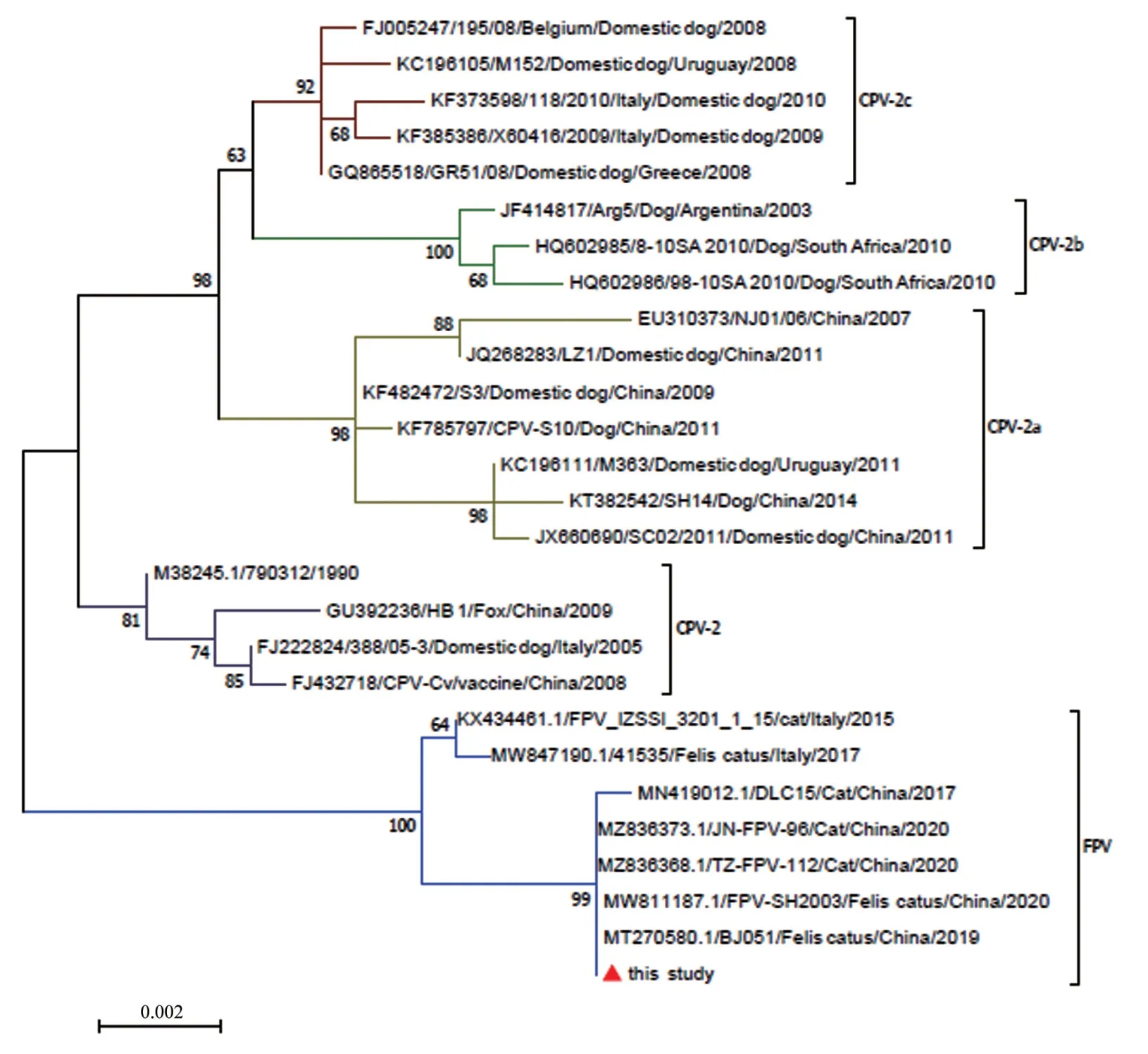
图6 基于VP2 基因的遗传进化树
3 讨论
FPV 是一种单链DNA 病毒,在家养动物和野生动物中均有流行,动物感染后出现高热、急性肠炎、呕吐、白细胞减少和心肌炎等症状,对犬、猫、鼬等家养、圈养、经济动物及野生猫科动物的危害十分严重。江苏、安徽、湖北等10 余个省市都曾发生过FPV 感染事件[15-16]。近年来,由于家养犬、猫等动物疫苗的使用,细小病毒病得到很好地控制,但在野生动物中还时有发生[17-18]。曾有学者用血凝抑制试验(HI)对我国某野生动物园圈养虎进行FPV 血清学调查,发现抗体阳性率接近50%[8];2017 年李同义等[19]报道某动物园东北虎和非洲狮感染细小病毒。可见,大型猫科动物如虎、狮感染该病毒也十分普遍。到目前为止,国内虽然有关于虎细小病毒序列的分析报道,但暂未有狮源细小病毒序列的相关分析报道,因此应加强大型猫科动物FPV 监测,以减少该病的发生与流行。
VP2 蛋白是FPV 主要的抗原蛋白,其非常保守,与病毒的血凝特性、致病性密切相关。本研究成功从疑似感染FPV 的非洲狮粪便中分离出FPV CHN-HN-1 毒株。对该分离株的VP2基因进行PCR 扩增测序,并分析其遗传变异情况,结果发现分离株与26 株参考株的序列相似性为97.8%~100%,与JN-FPV-96、TZ-FPV-112、FPVSH2003、BJ051 高度同源,相似性均为100%,同时决定分离株VP2 蛋白的6 个关键氨基酸位点均未发生突变,这符合FPV 的序列特征。遗传进化分析显示,FPV CHN-HN-1 与其他7 株猫源细小病毒同属一个分支,表明本株狮源FPV 与猫源FPV病毒亲缘关系较近,与犬源和狐源的细小病毒株亲缘关系较远,遗传进化分析进一步证明分离株FPV CHN-HN-1 起源于FPV。
动物园作为大型圈养猫科动物的主要活动场所,除了在动物早期进行免疫预防接种,加强环境消毒外,还应做好FPV 分子流行病学和遗传变异机制研究,以便对该病的诊断和治疗提供依据,也为后期相关疫苗的研制打下基础,同时对野生动物保护也具有重要意义。

