外周血SP-D、SP-A、IL-1β对创伤性肠破裂患者术后急性肺损伤的预测及病情评估价值
王琪,高明,葛魏巍,孙远松
(安徽医科大学第二附属医院急诊外科,安徽合肥230601)
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是以急性低氧血症为主要临床表现的严重呼吸系统疾病[1], 创伤性肠破裂(traumatic enterorrhexis,TE)是发生ALI/ARDS 的常见诱因之一[2]。然而目前临床上对于TE 患者的术前管理措施仍以稳定血流动力学为主,而忽视了TE 本身以及手术相关因素所诱发的急性远程器官损伤,其中以ALI/ARDS 最为严重,直至2014年其总体病死率仍保持在40%左右[3-4],直接影响患者的预后[5]。因此,临床上迫切需要寻找一种或几种具有高特异度和灵敏度的相关指标以早期预测TE 术后ALI/ARDS 的发生并评估病情严重程度。随着近年来对ALI/ARDS 病理生理机制认识的逐步深入,越来越多的研究表明,炎症趋化导致肺泡上皮和血管内皮细胞受损是TE 手术患者伴发ALI/ARDS 的主要病理过程[6-7]。相关研究还发现肺表面活性蛋白D(SP-D)、肺表面活性蛋白A(SP-A)、白细胞介素1β(IL-1β)的高表达在ALI/ARDS 中的组织损伤修复和免疫炎症调节方面发挥重要作用,有望成为评价TE 术后伴发ALI/ARDS 的特异性标志物[8-9]。本研究目的在于通过监测TE 患者SP-D、SP-A 及IL-1β 水平的动态变化,进而分析其在术后伴发ALI/ARDS 的早期预测以及病情严重程度评估中的价值,以期对TE术后伴发ALI/ARDS 患者的预防和治疗提供帮助。
1 资料与方法
1.1 一般资料
本研究经安徽医科大学第二附属医院伦理委员会批准。收集我院急诊外科2019年8月—2020年12月诊治的78 例TE 患者相关临床资料,男51 例,女27 例;年龄32~71 岁。ALI/ARDS 的共识定义及分类原则由Europe-America ARDS 联席委员会制定通过[10],即:存在ALI/ARDS 的高危因素;急性起病、呼吸频率>28 次/min 和(或)呼吸窘迫;低氧血症:ALI 时动脉血氧分压(PaO2)/吸入氧分数值(FiO2) ≤300, ARDS 时PaO2/FiO2≤200; 胸部X 线检查显示两肺浸润阴影; 肺动脉楔压(PAWP)≤18 mmHg(1 mmHg=0.133 kPa)或临床上能除外心源性肺水肿。根据定义及分类,78 例患者中,52 例术后无肺损伤(对照组),15例术后伴发ALI(ALI组),11 例术后伴发ARDS(ARDS 组)。
1.2 纳入及排除标准
纳入标准:⑴所有纳入对象均诊断为TE 且无其他脏器损伤,并在我院检查和手术,ALI 和ARDS 组患者符合相应的诊断及分类标准;⑵均在发病后6 h 以内入院,且之前未接受任何治疗措施;⑶临床资料完整。排除标准:⑴3 个月内有外伤及输血史的患者;⑵恶性肿瘤个人史且接受过放化疗的患者;⑶既往或长期服用免疫抑制剂及激素的患者;⑷既往伴有急慢性肺部疾病的患者;⑸术后7 d 内死亡的入组患者。符合任何一条排除标准的患者,都将被排除出研究队列。
1.3 研究方法
所有患者入院后均行急诊开放性腹部手术治疗。并在宋磊等[11]的实验方法基础上改良,分别在术前及术后第1、4、7 天凌晨空腹收集外周静脉血3 mL,以4 000r/min 离心10 min 分离出血清,将血清置于EP 管中并于-80 ℃液氮冷冻保存,进行统一检测。采用酶联免疫吸附试验法(ELISA 法)检测血清SP-D、SP-A、IL-1β 以及PCT 水平。
1.4 统计学处理
数据分析采用SPSS 23.0 软件,服从正态分布的计量资料结果以均数±标准差(±s) 表示;计数资料用频数和率表示;组间计量资料对比使用单因素方差分析,组间计数资料对比使用χ²检验,计量资料间的相关性分析使用Pearson 或Spearman 相关分析;应用ROC 曲线分析各项指标的预测效能并确定最佳截断值;使用平行诊断试验计算联合检测敏感度:试验A 敏感度+(1-试验A 敏感度)×试验B 敏感度;使用系列诊断试验计算联合检测特异度:试验A 特异度+(1-试验A 特异度)×试验B 特异度。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组临床资料比较
对照组、ALI 组及ARDS 组患者间年龄、性别、BMI、致伤因素、损伤部位、手术方式、手术时长及术中失血量的差异无统计学意义(均P>0.05);ALI 组和ARDS 组患者的机械通气时长、PCT 水平、肺损伤预测评分(LIPS) 以及肺损伤评分(LIS)在ALI 组和ARDS 组患者中均明显高于对照组,且ARDS 组明显高于ALI 组,差异均有统计学意义(均P<0.05);ALI 组和ARDS 组患者的氧合指数明显低于对照组,且ARDS 组明显低于ALI 组,差异均有统计学意义(均P<0.05)(表1)。
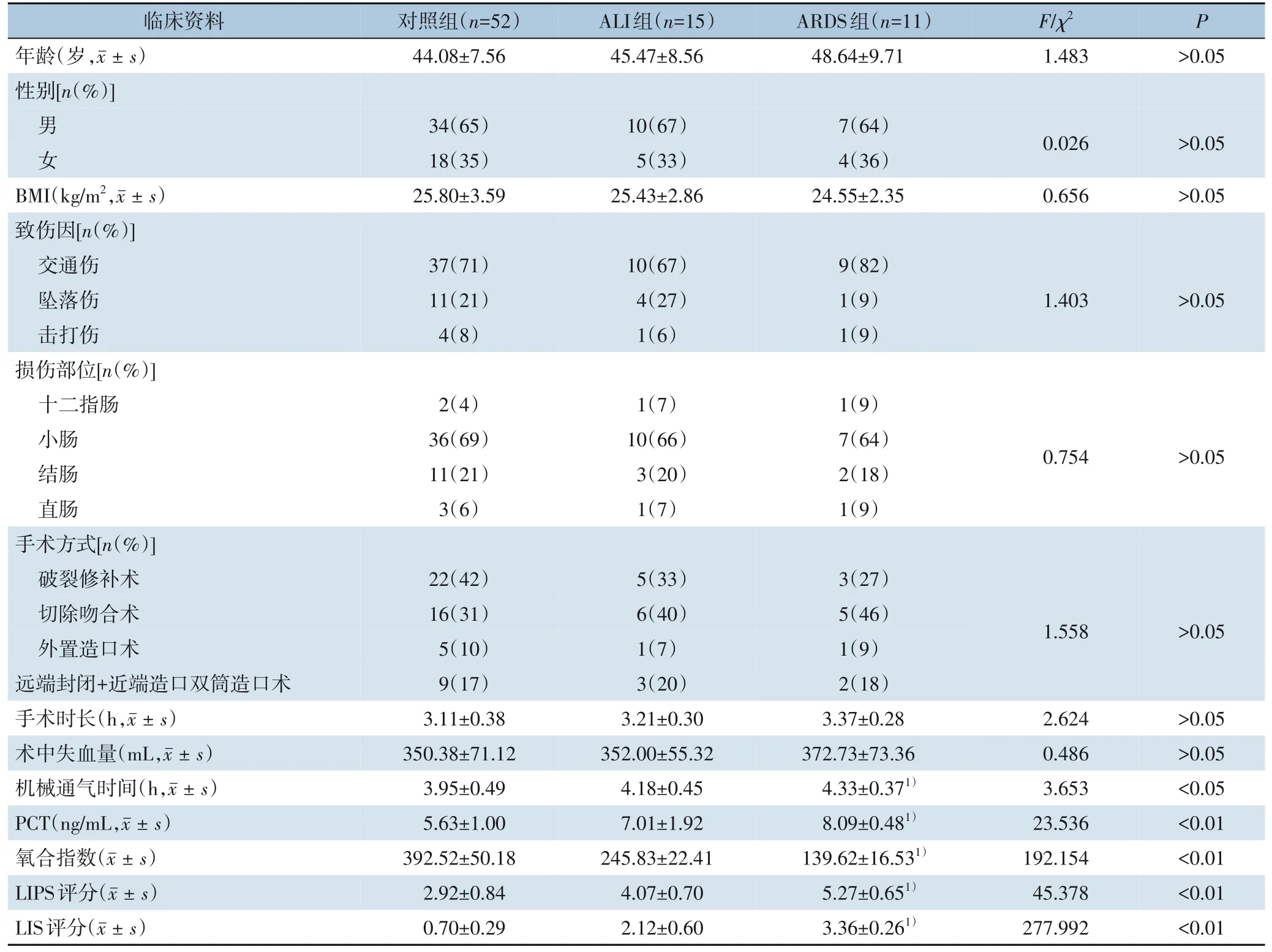
表1 各组临床资料比较Table 1 Comparison of the clinical variables among the three groups
2.2 外周血SP-D、SP-A、IL-1β水平比较
术前外周血SP-D、SP-A、IL-1β 水平在ALI 组和ARDS 组患者中均明显高于对照组,且ARDS 组明显高于ALI 组(均P<0.05)。动态分析发现,ALI 组和ARDS 组患者SP-D、SP-A、IL-1β 水平在不同时间点均明显高于对照组(P<0.01);ALI 和ARDS 组间比较发现,除SP-A 水平在术后第7 天两组无明显差异外(P>0.05),其余各时间点ARDS 组的SP-D、SP-A、 IL-1β 水平均明显高于 ALI 组 (P<0.01)(图1)。
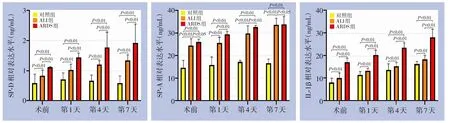
图1 外周血SP-D、SP-A、IL-1β水平在三组患者不同时间点的动态变化比较Figure 1 Comparison of dynamic levels of SP-D,SP-A and IL-1β among three groups
2.3 ROC曲线分析
考虑到患者术中术后治疗的个体差异性,故选取影响因素较少的术前SP-D、SP-A、IL-1β、PCT检测值以及LIPS评分作为早期预测资料并做ROC曲线分析。
2.3.1 TE 术后伴发ALI 的ROC 曲线分析三项指标对TE 术后伴发ALI 的早期预测分析结果显示:SP-D 最佳阈值为0.66 ng/mL,此时灵敏度为90.4%,特异度为62.9%,AUC 为0.800;SP-A 最佳阈值为20.02 ng/mL, 此时灵敏度为90.4%, 特异度为82.3%,AUC 为0.919;IL-1β 最佳阈值为9.81 ng/mL,此时灵敏度为65.4%,特异度为82.3%,AUC 为0.755;以SP-D≥0.66 ng/mL、SP-A≥20.02 ng/mL、IL-1β≥9.81 pg/mL 为阈值,三者联合进行平行试验时的灵敏度及特异度分别为99.7%、42.6%;三者联合进行系列试验时的灵敏度及特异度分别为53.4%、98.8%(表2)(图2)。
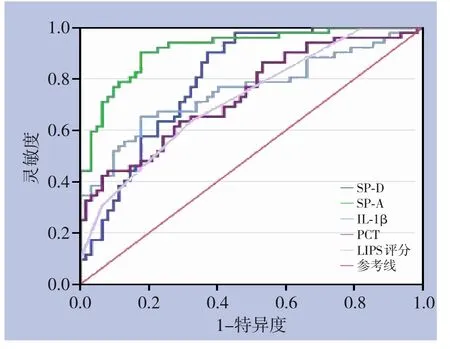
图2 SP-D、SP-A、IL-1β早期预测ALI的ROC曲线Figure 2 ROC curves of SP-D,SP-A and IL-1β for early prediction of ALI
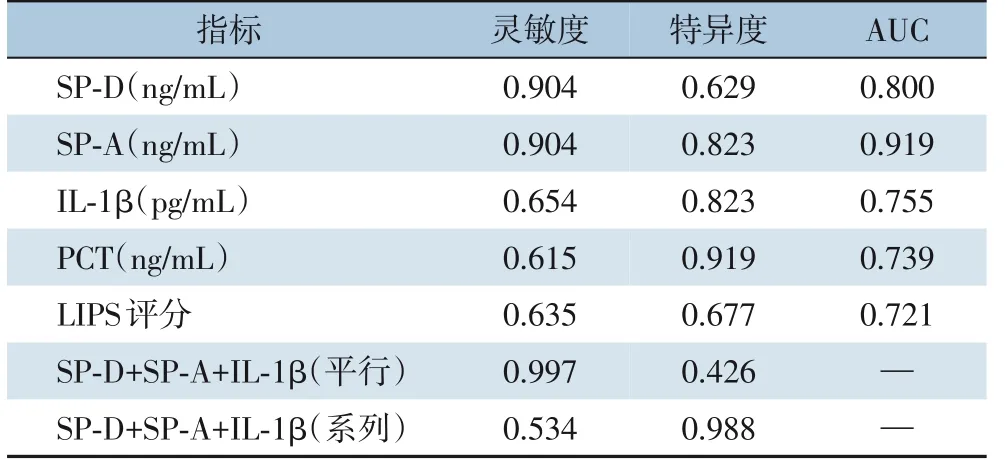
表2 SP-D、SP-A、IL-1β对ALI预测价值的ROC曲线分析Table 2 ROC curve analysis of the predictive value of SPD,SP-A and IL-1β for ALI
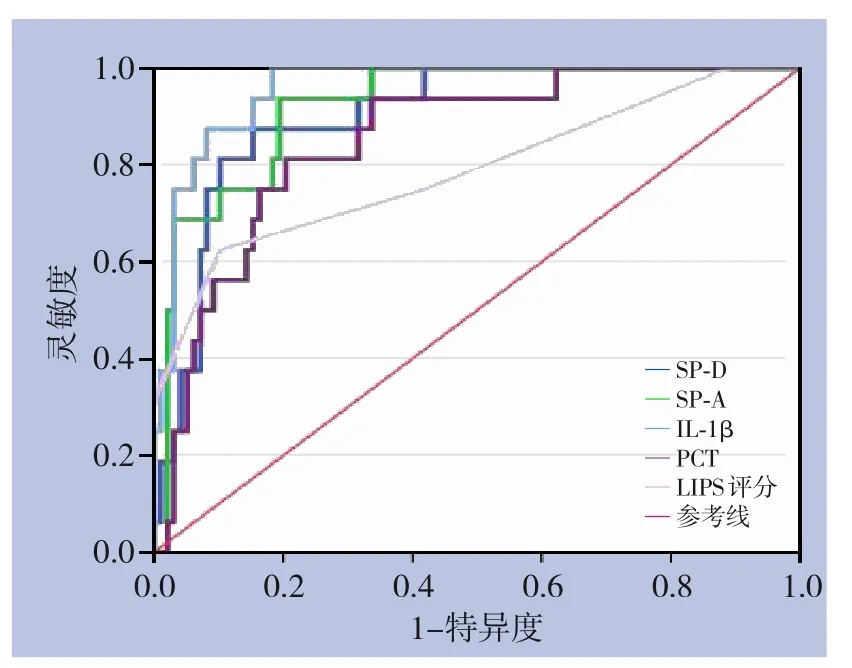
2.3.2 TE 术后伴发ARDS 的ROC 曲线分析三项指标对TE 术后伴发ARDS 的早期预测分析结果显示:SP-D 最佳阈值为0.96 ng/mL,此时灵敏度为87.5%,特异度为84.7%,AUC 为0.902;SP-A 最佳阈值为21.26 ng/mL,此时灵敏度为93.8%,特异度为80.6%,AUC 为0.931;IL-1β 最佳阈值为14.64 ng/mL,此时灵敏度为87.5%,特异度为91.8%,AUC 为0.957;以SP-D≥0.96 ng/mL、SP-A≥21.26 ng/mL、IL-1β≥14.64 pg/mL为阈值,三者联合进行平行试验时的灵敏度及特异度分别为99.9%、62.7%;三者联合进行系列试验时的灵敏度及特异度分别为71.8%、99.7%(表3)(图3)。
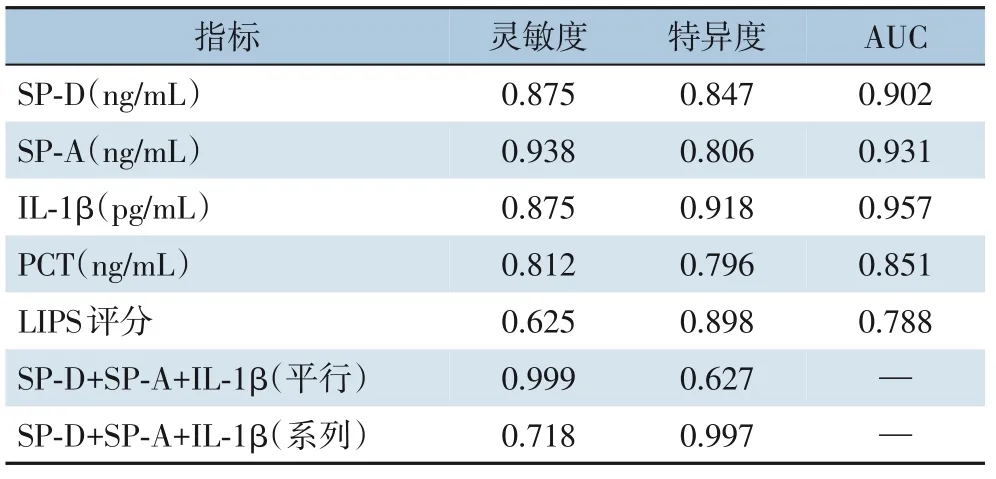
表3 SP-D、SP-A、IL-1β对ARDS预测价值的ROC曲线分析Table 3 ROC curve analysis of the predictive value of SP-D,SP-A and IL-1β for ARDS
2.4 相关性分析
2.4.1 三项指标与氧合指数的相关性分析将三组患者术前各指标水平与氧合指数做Pearson 检验并制作散点图,结果显示:SP-D、SP-A、IL-1β检测值与氧合指数值均呈明显负相关(r=-0.504、-0.657、-0.717,均P<0.01)(图4)。
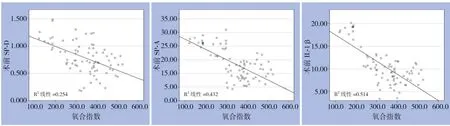
图4 SP-D、SP-A、IL-1β与氧合指数的相关性Figure 4 Correlation of SP-D,SP-A,and IL-1β with oxygenation index
2.4.2 三项指标与LIS 评分的相关性分析将三组患者术前各指标水平与诊断ALI/ARDS 时的LIS 评分做Spearman 检验并制作散点图,结果显示:SP-D、SP-A、IL-1β 检测值与LIS 评分均呈显著正相关(r=0.471、0.654、0.634,均P<0.01)(图5)。
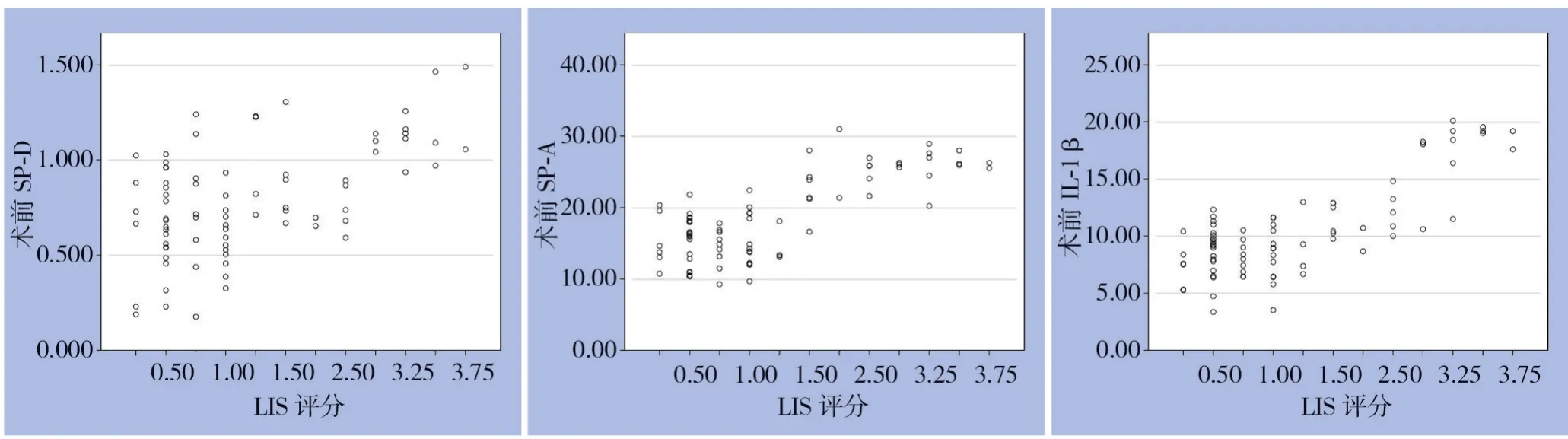
图5 SP-D、SP-A、IL-1β与LIS评分的相关性Figure 5 Correlation of SP-D,SP-A,and IL-1β with LIS score
3 讨 论
TE 在腹部创伤中较为常见,是急诊行剖腹探查术的适应证之一[12]。有研究发现,TE 术后患者常伴随细菌易位、炎症细胞激活以及促炎因子的过量释放[13],从而引发全身炎症反应并造成多器官功能障碍或衰竭,其中肺组织对炎症损伤最为敏感,极易导致TE 术后伴发ALI/ARDS[14]。ALI/ARDS 是以炎症趋化和弥漫性肺泡损伤为病理特点的肺部疾病[15],临床上表现为低氧血症难以改善,严重患者可导致肺功能衰竭甚至死亡[16],故在TE患者中行快速准确的ALI/ARDS 早期预测及动态病情评估对其有效治疗和改善预后均可起到关键性作用。然而,目前临床上尚无特异性及敏感度较强的指标可用,其中PCT 水平对TE 术后伴发ALI/ARDS 早期预测和病情评估的特异性不高,LIPS 评分和LIS 评分存在项目繁杂、耗时长等问题[17-18]。因此,寻找一项或几项高敏感度及特异度的指标来对TE 术后伴发ALI/ARDS 进行早期预测并动态评估病情严重程度,已成为越来越多的临床工作者研究的热点及难点。
SP-D 作为钙依赖性凝集素家族中的糖蛋白,是肺表面活性物质系统的组成部分。其不仅发挥宿主防御和免疫调节功能[19],也可以通过激活酪氨酸磷酸酶SHP-1 来减轻局部单核细胞/巨噬细胞浸润,同时抑制其促炎因子的分泌,显著降低巨噬细胞介导的肺泡细胞毒性,发挥抗炎作用[20]。Mackay 等[21]的研究发现,脓毒症性肺损伤患儿SP-D水平明显高于正常患儿(P<0.000 1)。且有研究[22]还显示,ALI/ARDS 患者氧合指数通过无氧通气法(AOI)得到明显提高的同时,SP-D 水平明显下降,表明SP-D 水平可反映肺功能受损程度。本研究结果显示,ALI 组、ARDS 组患者的SP-D 水平在各时间点均显著高于对照组,且ARDS 组显著高于ALI 组(P<0.01),且相关性分析显示SP-D 与氧合指数负相关、与LIS 评分正相关,表明SP-D 水平与肺损伤的严重程度呈正比,可有效评估TE 术后伴发ALI/ARDS 的病情严重程度。
SP-A 属于亲水性糖蛋白,在所有肺表面活性蛋白中占比最大,其水平高低可反映肺泡上皮屏障损伤状况[23]。SP-A 不仅可以通过与吞噬细胞相互作用调节多种细胞因子的释放,启动对病原体或炎症因子的免疫反应;还可以通过抑制肺对致敏原产生的超敏反应而起到保护肺组织的作用[24]。Liu 等[25]发现,大鼠经LPS 诱导发生ALI 后,其肺组织受损严重并伴随着SP-A 水平显著升高,而经优帕替林(eupatilin)干预后肺组织损伤情况明显改善,且SP-A 水平相比无干预组显著下降(P<0.001),表明SP-A 水平与肺损伤严重程度成正相关。本研究中的ALI 组、ARDS 组患者SP-A 水平均持续显著高于对照组(P<0.01),且ARDS 组的SP-A水平在术前及术后第1、4 天显著高于ALI 组(P<0.01),与上述研究结果相向;此外本研究的相关性分析显示SP-A 与氧合指数负相关、与LIS 评分正相关,表明SP-A 可以作为评估TE 术后伴发ALI/ARDS 病情严重程度的有效指标之一。但本研究同时也发现,SP-A 水平在术后第7 天ALI 和ARDS 组间无统计学差异(P>0.05),这可能是由于SP-A 在ALI/ARDS 中表现出促炎效果同时也发挥抑制炎性损伤的作用有关,SP-A 胶原结构域与CD91/CRT 结合激活促炎通路,而SP-A 通过调节钙依赖性CRD与信号抑制调节蛋白α(SIRPα)的相互作用产生抗炎效果,上述双向的负反馈调节使得SP-A 水平在ALI/ARDS 患者后期阶段达到平衡抑制。
IL-1β 是一种热源性的细胞因子,其促炎作用强效[26]。创伤和休克等因素通过激活损伤相关分子模式致使巨噬细胞在肺组织中异常积聚并过度分泌IL-1β[27],IL-1β 一方面通过趋化炎症细胞来进一步加重肺组织局部炎症反应[28],另一方面通过抑制钠通道进而导致肺水肿。IL-1β 作为肺损伤的潜在关键细胞因子,在急性肺损伤病情恶化中占据中心地位[29]。Kong 等[30]研究发现ARDS 患者的IL-1β 水平显著高于健康对照组(P<0.01),且在ARDS 组患者中,IL-1β 水平越高则患者的28 d 生存率越差,表明IL-1β 水平与病情严重程度存在正相关。Zheng 等[31]发现ALI/ARDS 组大鼠IL-1β 水平明显高于无ALI/ARDS 组(P<0.05),并提出IL-1β是ALI/ARDS 早期最具生物活性的促炎因子。相比上述动物实验研究及IL-1β 水平的单一时间点分析而言,本研究是基于临床上TE 患者术前术后不同时间点的IL-1β 指标水平动态监测比较,并分析发现:IL-1β 水平在ALI 组和ARDS 组中各时间点均显著高于对照组(均P<0.01),且ARDS 组患者显著高于ALI 组(均P<0.01),并与氧合指数负相关、与LIS 评分正相关,强调IL-1β 的动态监测在TE 术后伴发ALI/ARDS 的病情严重程度的评估中更具意义。
在本研究中,ROC 曲线分析示SP-D、SP-A、IL-1β 各指标单独预测ALI/ARDS 的AUC 均高于PCT、LIPS 评分,表明三者有望替代上述传统指标而对ALI/ARDS 的发生具备更有效的预测价值。ROC 曲线分析还发现,SP-A 在早期预测TE 术后伴发ALI/ARDS 方面均表现出较高的灵敏度,且ALI和ARDS 组患者SP-A 水平在术前即开始明显高于对照组,表明SP-A 可以作为早期预测TE 术后伴发ALI/ARDS 的敏感指标之一;IL-1β 预测ARDS 的AUC 最高,表明其在早期预测TE 术后伴发ARDS方面具有更高价值。此外,三者联合平行试验可提高预测TE 术后伴发ALI/ARDS 的灵敏度,系列试验则有助于提高特异度。但基于本研究中TE 术后伴发ALI 和ARDS 患者样本数较少,尚待后续扩大样本以进一步佐证。
综上所述,血清SP-D、SP-A、IL-1β 在TE 术后患者伴发ALI/ARDS 的早期预测和病情严重程度评估中均有一定的临床价值,其中三者联合动态监测的临床价值更高,且各指标检测方便快捷,值得临床上进一步推广应用。

