FDA连续制造对中药智能制造的借鉴和思考
孙 昱,徐 敢,文海若
·药事管理·
FDA连续制造对中药智能制造的借鉴和思考
孙 昱1,徐 敢2*,文海若3*
1. 国家药品监督管理局 药品审评中心,北京 100022 2. 北京中医药大学,北京 102248 3. 中国食品药品检定研究院,北京 100050
通过了解美国食品药品监督管理局(Food and Drug Administration,FDA)的《连续制造的质量考虑指导原则》,结合片剂连续制造、中药智能制造的研究进展以及智能制造相关的方法进展,探索中药智能制造的分级研究思路。建议中药智能制造从3个层次进行研究:(1)中药智能制造的总体研究,从中药智能制造的全过程质量控制角度考虑其质量控制的注意事项。如生产过程的关注点、控制策略、工艺验证、扩大生产规模(如适用)、将已有生产工艺桥接到智能制造(如适用)。(2)中药智能制造的共性技术方法研究,如过程分析技术研究、数字化研究、建模研究、基于模型的实时反馈研究、自适应控制研究。(3)中药固体口服制剂智能制造的研究。
智能制造;连续制造;过程分析技术;数字化;建模;自适应控制
《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》[1]指出:“深入实施智能制造和绿色制造工程,发展服务型制造新模式,推动制造业高端化、智能化、绿色化。培育先进制造业集群,推动集成电路、航空航天、船舶与海洋工程装备、机器人、先进轨道交通装备、先进电力装备、工程机械、高端数控机床、医药及医疗设备等产业创新发展”。2015年国务院发布的《中国制造2025》[2]指出:“着力发展智能装备和智能产品,推进生产过程智能化”“发展针对重大疾病的化学药、中药、生物技术药物新产品,重点包括新机制和新靶点化学药、抗体药物、抗体偶联药物、全新结构蛋白及多肽药物、新型疫苗、临床优势突出的创新中药及个性化治疗药物”。2016年工业和信息化部、财政部发布的《智能制造发展规划(2016—2020年)》[3]指出:“智能制造是基于新一代信息通信技术与先进制造技术深度融合,贯穿于设计、生产、管理、服务等制造活动的各个环节,具有自感知、自学习、自决策、自执行、自适应等功能的新型生产方式”。2018年工业和信息化部发布的《国家智能制造标准体系建设指南(2018年版)》[4]指出:“针对传统制造业关键工序自动化、数字化改造需求,推广应用数字化技术、系统集成技术、智能制造装备,提高设计、制造、工艺、管理水平,努力提升发展层次,迈向中高端”。
美国食品药品监督管理局(Food and Drug Administration,FDA)是美国卫生与公共服务部的一个机构,通过确保人用和兽用药物、疫苗和其他生物制品以及医疗器械的安全性、有效性和安全性来保护公众健康。该机构还负责国家食品、化妆品、膳食补充剂、释放电子辐射的产品以及管制烟草产品的安全。FDA在《2021年FDA推进监管科学:监管科学的重点领域》[5]中指出:“先进制造可以应用智能制造的概念,采用自动化、数字化和人工智能来简化生产方法,收集更多的过程控制数据,并最终使用智能算法来自适应地控制生产/产品放行,或做出生产/产品放行的决策”。先进制造是新医疗产品制造技术的统称,可以改善药品质量,解决药品短缺问题并加快产品上市时间,其示例包括连续制造和3D打印,其特点是整合新颖的技术方法;以新的方式使用已建立的技术;在没有充分经验的新领域应用生产方法[6]。智能制造是以网络、人为因素、物理空间等新兴信息技术为基础,整合智能决策、流程、操作、资源,提升性能和技术能力的一种方式[7]。FDA对连续制造的定义为由一系列2个或2个以上的单元操作(系统)组成的集成过程,在这一过程中,输入物料在过程中不断地被输入和转化,加工后的输出物料不断地从系统中被移出[8]。
先进制造、智能制造、连续制造3个概念的相关分析如下:先进制造的示例中包含连续制造;智能制造与连续制造存在共同之处,即均采用自动化、数字化和人工智能来简化生产方法,二者的不同之处在于连续制造强调了制造过程中生产物料的持续输入、加工和输出。目前应用了连续制造方式生产获批的小分子药物有7种[9-10],见表1。连续制造获批药品的剂型大多为片剂,也有颗粒剂。本文通过了解FDA发布的《连续制造的质量考虑指导原则》,结合片剂连续制造和中药智能制造的研究进展,以及智能制造相关的方法进展,探讨中药智能制造的分级研究思路。
1 《连续制造的质量考虑指导原则》概述
FDA认为连续制造是指不断地将输入物料进行输入并转化,以及加工后的输出物料不断地从系统中移除的过程。连续制造可以改善药品的制造,如使用一种步骤更少、加工时间更短的集成工艺;占用空间较小的设备;支持增强的开发方法[如质量源于设计(quality by design,QbD)]、过程分析技术(process analytical technology,PAT)和模型的使用;实时监控产品质量;并提供灵活的操作,允许规模扩大、规模缩小和规模外扩,以适应不断变化的供应需求。连续制造的注意事项包括工艺动态、批次定义、控制策略、药品质量体系、规模扩大、稳定性以及现有批生产与连续生产的衔接等。
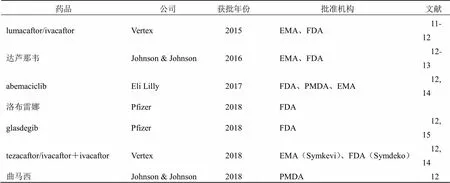
表1 以连续制造方式生产的获批药物
EMA-欧洲药品管理局 PMDA-日本医疗器械审评审批机构
EMA-European Medicines Agency PMDA-Pharmaceuticals and Medical Devices Agency
1.1 工艺动态
《连续制造的质量考虑指导原则》对连续生产中的工艺动态关注点进行了描述,重点强调了物料的可追溯性。工艺动态相关的内容为输入物料属性(如效价强度、物料流动特性)、工艺条件(如质量流量)或设备设计元素(如连续搅拌机的扇叶类型)。对工艺动态的理解有助于实现物料可追溯。由于连续生产的动态性质,对于连续制造过程的风险评估除考虑每个单元操作外,还应考虑对集成系统的工艺过程理解。
应使用适当的科学方法来表征物料在整个工艺过程中的流动方式。一种常见的方法是表征单个单元操作和集成系统的停留时间分布(residence time distribution,RTD)。RTD是一种概率分布,描述了质量或流体元素在工艺过程中保留的时间,可以通过示踪实验、适当产品属性的在线过程测量和/或过程建模进行测量。RTD的形状反映了该系统内的轴向分散或回混程度,这会影响干扰的传播、物料的可追溯性和控制策略(如物料转移和取样频率)。RTD取决于多种因素,如输入物料的属性、质量流量、工艺参数、设备设计与运行。除了在正常/目标工作条件下表征RTD的特性外,了解RTD在计划的工作条件范围内如何变化也很重要。这些信息作为物料追溯和确定适当取样计划的基础,对于设计连续制造过程的控制策略至关重要。
1.2 批次定义
该指导原则认为,美国联邦法规(21 Code of Federal Regulations 210.3,21 CFR 210.3)中的批次定义适用于连续制造。很多批次也可以视为子批次,应在每次生产运行开始之前确定实际的批次或批量大小。对于基于时间(如生产周期)定义的批次,必须建立物料可追溯性和批次之间的联系,以确定药品的具体数量(21 CFR 210.3)。
1.3 控制策略
通常,在制定控制策略时,生产企业应考虑意外的和预期的变化。对于连续制造过程,这一点更为关键,因为在正常运行期间,随着时间的推移,输入物料属性、工艺条件或环境因素可能会出现短暂的干扰。这种连续操作模式的有效控制策略应特别强调降低这些潜在干扰产品质量的风险。
1.3.1 输入物料控制 在连续生产过程中,输入物料通过给料系统(如用于固体粉末的失重式进料器或用于液体的泵)不断添加。不同批次的输入物料可以在不同的工艺时间点引入系统,并且输入物料属性的变化可能会影响进料,从而将可变性引入系统,影响RTD模型,并可能影响成品质量。此外,集成系统中的运输过程可能导致某种程度的转变(如粉末的分离或聚集)。因此,连续制造可能需要额外的特性描述,并对超出药典标准的输入物料属性进行控制。在产品的整个生命周期中(包括在药物开发过程中),都应考虑进行适当的风险分析、实验研究和/或建模和模拟,以评估物料属性(如原料药和辅料的粒度分布和密度)对成品的物料流动特性、工艺动态和质量的潜在影响。正式的监控程序有助于生产企业识别高风险原料特性的变化(如批间、批内和随时间推移的变化),并主动识别和减轻这些变化对生产工艺和成品的影响。
1.3.2 工艺监控 工艺监控方法应包括:(1)在工艺的适当位置监视变量,如工艺参数、输入和加工中的物料属性、成品属性;(2)取样方案,包括取样位置、取样或检测频率、取样和检测的样本量、适用于评价工艺监控数据的统计标准;(3)工艺监控数据的分析类型,如基于控制限度的单变量分析、多元或过程模型、批间和批内趋势分析(如移动平均值和方差分析);(4)工艺监控数据的预期用途,如支持其他控制策略元素,包括主动过程控制、物料转移、实时放行检测(real time release testing,RTRT)、批量放行;作为工艺开发的一部分,在制造过程中评估工艺和设备性能,并促进工艺的持续验证;对工艺进行持续监控,以确认其仍处于受控状态。
开发用于工艺监控的检测系统和取样计划需要考虑以下内容。为了确定需要监控哪些变量,应了解物料属性和工艺参数与产品关键质量属性(critical quality attribute,CQA)的相关性。取样计划应考虑工艺监控数据的预期用途以及工艺动态对检测频率的影响。应评估检测设备(如传感器的位置)以实现有代表性的取样并避免对过程的干扰。工艺监控方法的开发应包括风险评估,其中应考虑工艺监控数据收集中的失误(如重新校准近红外探头或给料机加料)如何影响产品质量。
主动过程控制要求系统中的某些参数具有实时调整的能力,以减少产生不合格物料的风险。在这种情况下,预定义的过程调整不一定代表偏离控制状态。实施主动过程控制的方法可以包括操作员操作、增加取样频率和自动前馈/反馈控制等策略。建立适当的限制(如警报或操作限制)对于工艺控制的稳健性也很重要。为确保监控的关键工艺参数和关键物料属性保持在所需范围内,监控的可接受限度应在提交的监管文件中予以明确。
1.3.3 物料转移 制造过程将包括产生不合格物料的时间段,如启动、关闭或临时过程干扰。如果已经建立了物料可追溯、工艺监控和物料移除的方法,则可以隔离和移除不合格的物料,而不会影响批次的其余部分。
在产生不合格物料的时间段,转移物料的数量应取决于干扰的持续时间和严重程度、系统工艺动态和转移点的位置。对工艺动态的研究,包括RTD和过程中的干扰传播,为确定适当的转移物料数量提供参考。
系统的设计应考虑在重要生产阶段的开始或完成时包括分流点。转移点位置的设计还应考虑移除物料的可行性,位置对受影响物料数量的影响(如在后续步骤中通过反向混合或物料转化分散不合格物料),以及不合格物料对下游加工的影响。建议建立安全边界以避免不合格物料与可接受物料一起收集。
生产企业应建立程序,说明何时将被识别为潜在不合格物料进行转移和收集。如果由于无法解释的差异而导致物料转移,则在处置批次之前必须调查差异的原因。根据21 CFR 211.192的规定,由于预期的系统操作条件而导致的转移可能不需要进行调查。如果在单个生产周期内发生频繁或周期性的工艺干扰,导致非典型的低产量,则根据调查结果,可能需要拒绝整个批次。在适当的情况下,调查必须扩展到其他可能受影响的批次和产品。
1.3.4 实时放行检测 利用PAT工具对连续生产过程进行监控,可以在生产过程中产生大量的实时工艺和质量数据,为实时生产过程监控提供支持。尽管RTRT不是实施连续生产工艺的法规要求,但它是被鼓励的。
当采用RTRT作为控制策略的一部分时,应特别考虑取样策略。RTRT的实现包括进程内在线、近线和/或在线取样。所选的样本量或频率应能代表批次,并且应使用适当的统计方法(如置信度和覆盖范围)。对于高频采集的数据,应采用大样本的统计方法来改善批次的表征。RTRT计算还应考虑在多批作业中观察到的CQA差异,以说明批次内和批次间的差异。此外,应制定程序来建立RTRT计划,以解决PAT数据中的潜在差距(如PAT设备故障)。
以下是RTRT实施的质量属性和注意事项的示例。
(1)成品的鉴别检测:①鉴别检测应能够区分在生产车间生产的其他产品;②应检查任何唯一标识,如压纹和样品方向对测试方法的影响;③如果鉴别检测是在中间体而不是成品上进行的,则应采取控制措施,以防止在后续处理步骤中出现潜在的人为和/或系统错误。
(2)近红外法测定片剂含量及含量均匀性:①近红外测量的样品量和取样频率在统计上应该是合理的,以提供足够的质量保证;②测量位置应代表成品片剂,并尽量减少发生偏析的可能性(如片剂压缩步骤或未包衣片剂的进料框);③用近红外法测定片剂的活性物质浓度时,应考虑到片剂的质量,以计算片剂总的活性物质浓度;④用于RTRT的PAT工具应与离线分析方法(如高效液相色谱法)进行验证;⑤与近红外方法相关的校准模型应该在商业生产的建议操作范围内充分开发和验证。
(3)模型作为放行检测的替代品:①模型的开发应该考虑所有可能影响质量属性的变量,通常是检测的物料属性和工艺参数相关组合的函数;②应开发模型,以考虑在商业生产过程中物料属性和工艺条件的潜在变化;③模型使用统计上合理的方法和相应的放行检测方法进行验证,并证明特异性(如检测不合格产品的能力)。如果进行了测试,则样品必须通过相应的放行检测方法。
1.3.5 质量标准 鼓励使用RTRT,因为它通常包含一个更能代表批次的增强取样计划,使生产企业能够使用更好的预测统计工具。如果采用RTRT代替离线的最终产品测试,则质量标准还应包括一个监管离线分析方法和相关的验收标准,用于评估保质期内的产品质量。
1.3.6 设备 使用连续制造工艺的生产企业可能需要长时间运行设备,以达到预定的批量大小。设备在同一次运行或多次重复运行时,由于污垢或正常磨损,设备性能会逐渐下降。在短期的开发运行中,可能不会观察到这样的性能下降。因此,用于连续生产的设备在确认、维护和清洁方面需要考虑以下额外因素。
设备确认应同时涉及单个单元操作和集成系统。集成连续设备的确认应证明该设备足以满足其预期用途。认证协议应代表预期的操作条件,包括流量、压力、速度和连续运行的持续时间。质量部门应建立设备性能和稳健性的验收标准(如参数可变性和偏差,以及无有害事件的发生),以支持持续制造工艺的开发和运行。在设备确认期间,设备组件的功能应评估特定事件,包括用于检测干扰和执行物料转移(如强制干扰)的事件。
在整个产品生命周期中,控制策略的制定和维护应考虑到设备故障模式,以确保检测和调查设备异常性能,包括适当的纠正措施。设备维护和校准程序应基于对设备性能的持续监控和其他可用信息(如设备经验、设备设计、在开发过程中获得的知识和确认结果)来制定和更新。过程监控策略应包括基于确认经验和对潜在故障模式的理解的设备性能指标。这也有助于确定在需要进行维护或清洁之前,集成生产线的最大运行时间。
清洁方法应根据开发和扩大规模研究(如增加生产运行时间)的理解来开发和定义,然后定期验证以确认持续有效性。清洁程序应在操作过程中和拆卸后对物料进行严格监控的基础上制定,应包括如检查设备、管道、过滤器和仪器(如在线分析仪和传感器)上物料是否滞留和堆积,以及在化学膜形成和微生物增长的过程中,生产线内物料的降解。在清洁验证期间评估的条件应根据产品质量风险或工厂生产的其他产品污染风险,在预期的最坏情况下(如延长生产运行时间)考虑潜在的故障模式(如结垢)。
一般来说,连续制造工艺的清洁频率应根据运行时间、所处理的物料数量、工艺条件或偏差历史和产品更换(如适用)来确定。作为生命周期管理的一部分,应定期评估和更新预防性维护时间表、设备监控以及清洁之间的时间和/或操作限制(如处理的物料数量)。
1.3.7 系统集成、数据处理和管理 适用于电子数据的注意事项可能包括(但不限于)以下各项:①准确复制适当的主生产或控制记录;②每个重要步骤已完成的文件,包括但不限于过程中的结果和检查人员(检查重要步骤的自动化设备执行情况)的身份证明;③网络安全、系统完整性/功能检查、单用户标识和审核跟踪;④软件版本控制、生产批记录版本控制,以及在启动时加载的生产过程的完整性;⑤计算速度和容量、本地和远程内存,以及通信保证;⑥数据存档和召回;⑦软件维护和变更控制。
自动控制系统可能是批处理记录的主要来源,用于连续工艺的批记录审查。自动控制系统生成的数据报告和审查注意事项应包括(但不限于)以下各项:①生产批记录:带有初始设定点、范围和模型版本的报告;②所执行的行动:审计跟踪报告(包括子系统)、工艺参数和过程中物料属性控制图、物料收集报告(记录物料收集、转移或开始收集时所达到的条件),以及任何其他工艺特定性能指标的报告;③偏差:报警报告、物料转移周期、纠正措施报告;④物料:对账及物料收集、隔离及转移报告,以及实际和理论产量百分比。
1.4 工艺验证
1.4.1 第1阶段——工艺设计 第1阶段工艺设计包括工艺设计和控制策略的制定。相应的研究和决策点,包括设备和自动化系统的设计,输入物料属性的评估,工艺动态和可变性,物料转移的策略或程序的开发,过程监控和控制,以及其他控制策略元素。这一阶段提供了对制备工艺和操作质量预期的理解,并且对于第2阶段的工艺稳健性验证至关重要。
1.4.2 第2阶段——工艺确认 集成设备和自动控制系统的确认对于确保连续工艺的执行至关重要。关于设备和自动化系统性能及其可变性的信息将为工艺性能确认(process performance qualification,PPQ)协议的设计提供依据。由于设备和自动化的可靠性能对PPQ至关重要,制造商应在启动PPQ之前评估他们是否有足够的经验来完全集成连续制造工艺。
PPQ第2阶段的第2部分展示了在工艺开发和集成设备自动化确认完成后,制备工艺的稳健性和控制策略的充分性。PPQ方案的设计应考虑到已知的可变性来源,包括那些连续制造工艺特有的可变性来源(如失重式进料机的质量流量波动),并应利用工艺设计和设备确认的相关知识。
PPQ还应证明生产工艺随时间的可重复性(从启动到关闭,从批次到批次),因此,生产企业应建立工艺稳健性措施和相关的验收标准,作为PPQ协议的一部分。可以建立设备性能标准,以识别会影响设备设计或资格验证的设备问题和偏差,而不是由常见原因引起的变化。应该建立度量标准来评估工艺的稳健性(如参数稳定性/方差和实际产量)。
用于检查运行时间或生产周期的初始PPQ研究的设计应代表初始产品发布时的预期商业运行时间。随着运行时间的延长,集成的连续制造工艺可能会遇到不可预见的变异性来源,如工艺漂移、设备疲劳和物料堆积。第1阶段的工艺理解和控制策略设计以及第2阶段的设备确认经验可以用来证明所建议的PPQ运行时间足以准确地捕捉预期的工艺可变性,从而证明批内工艺的稳健性。同样,对于计划进行的生产工艺(即连续批次),PPQ应设计捕获生产工艺相关的可变性,并根据需要利用第1和第2阶段生产工艺的相关知识。在产品生命周期的后期,可进行其他PPQ研究,以支持批次大小相关的更多灵活性,从而更有效地满足患者的需求。
在PPQ期间对关键中间体或成品质量属性的取样计划(在线或离线)应足以验证在整个生产过程中生产的物料质量一致。工艺参数和质量属性可变性的幅度和持续时间应作为PPQ协议的一部分进行评估,并应证明其合理性。与常规商业生产相比,对于批处理,PPQ通常会有更高水平的取样、附加检测和工艺性能审查。在PPQ期间,使用工艺参数和质量属性高频监控的连续制造过程可能不需要其他监控。
PPQ应包括通常在生产过程中发生的干预措施(如按预先设定的间隔更换PAT探头、补充进料或换挡)。如果在PPQ期间确实发生干扰,PPQ研究应确认自动化系统和操作,并确保质量部门有能力识别事件、转移物料和/或按照既定程序进行工艺纠正。
1.4.3 第3阶段——持续的工艺验证 持续的工艺验证(continued process verification,CPV)包括一个正在进行的程序,用于收集和分析与产品质量有关的产品和工艺数据。收集的数据应包括相关的工艺参数、设备性能指标以及输入物料、过程中物料和成品的质量属性。数据分析和趋势应该包括:①定量和统计方法,包括在适当和可行的情况下采用多元方法;②批内和批间变异的审查;③开发、实施、评估和改进计划,如有必要,包括分析频率、检查属性和预先确定的方差统计标准。
1.5 药品质量体系(pharmaceutical quality system,PQS)的其他考虑事项
为了在现有生产设施中实施连续制造,工厂应评估其PQS及其相关要素,以确定是否应修改PQS中的设计和程序。如可能需要修改或建立经修订的程序或其他程序,以支持连续制造工艺,包括以下几方面:①实时处理计划内和计划外的过程干扰,包括相关的调查;②原料和加工中物料的调查;③过程中物料转移策略,包括整个批次的拒绝标准;④变更管理和维护有效的纠正措施和预防措施(corrective action and preventive action,CAPA)系统;⑤PPQ方案和持续工艺验证方法,包括工艺稳健性、实际产量和多变量跟踪和趋势;⑥设备确认和维护;⑦在整个生产操作和质量决策过程中使用正式和非正式的质量风险管理原则。
1.6 规模扩大
1.6.1 规模扩大方法 连续制造的一个优点是用于工艺开发的设备可以用于商业制造。在使用相同设备的情况下,可以通过以下方法实现规模的扩大。
(1)在不改变质量流量的情况下增加运行时间:这通常是对连续工艺进行放大的最简单形式,因为它几乎无需对制造工艺进行更改。与此方法相关的风险通常与集成设备、分析仪器和计算机系统(如数据存储)在较长时间内的运行以及清洁有关。随着运行时间的增加,设备“死角”、物料堆积、设备漂移和瞬态干扰等在较短的运行时间内未被观测到的现象可能会变得明显。
(2)增加质量流量:质量流量的变化会导致工艺动态和停留时间分布的变化。因此,工艺的许多方面,如工艺参数和控制、采样频率和大小、物料可追溯性、干扰后指定的废品数量、特定批次的自动化指令文件和工艺限制因素,都应进行适当的评估和调整。
(3)同时增加运行时间和质量流量:与(1)和(2)相关的风险将适用。
(4)其他:规模的扩大还可以通过扩展方法实现,即2个或多个相同的设备单元并行运行。当需要大规模增加规模时,或当用于某些单元操作的设备由于相对较长的停留时间而趋于形成瓶颈时,这种按比例放大的方法可能是合适的。这种方法的挑战可能包括在并行单元(如反应器)之间保持均匀的流量分布,数据采集和存储,以及物料可追溯性。
一些连续工艺可以通过增加设备尺寸来扩大规模,如批量生产工艺。应谨慎应用放大的工程原理,如制造工艺控制、取样、可追溯性和大规模的物料转移缓冲。
1.6.2 PQS监督 有效的PQS可确保通过工厂的变更管理程序适当评估制造变更,如运行时间的增加或其他扩大规模的方法。在评估变更时应利用对现有产品和工艺的了解,以确定变更的适用性、控制策略、风险和相关的缓解策略,以及为支持变更而计划和执行何种类型的新的验证研究。这些更改可以在现场检查期间进行评估。
1.6.3 扩大规模的批准后备案策略 对于申请的产品,变更控制的一个要素是根据影响成品质量和变更复杂性的可能性,确定适当的批准后备案策略。提交的内容应包括如何评估扩大规模的详细信息,包括检测和取样、验收标准,以及支持变更的运行次数。可比性协议也可以用于按比例扩大规模(如流量变化)。
1.7 稳定性
在批生产和连续制造之间,证明在成品药品的保质期内具有足够稳定性的监管要求不会改变。然而,在制定稳定性计划时,应该考虑一些不同之处。
正如新原料药和制剂稳定性测试指南Q1A(R2)中所描述的,稳定性研究的数据应至少提供3个批次,如果可能,应使用不同批次的原料药来生产。申请人在使用连续制造工艺制备药品时,可以采用这种方法。主要的稳定批次可以从较短的生产运行中生产,前提是在较长运行时间内工艺运行时建立并保持控制状态。或稳定性样品可以从单个连续制造活动中获得,其中生产可变性被捕获(如通过以顺序的方式引入不同批次的输入物料)。如果采用后一种方法,则应收集稳定性样本来捕获这种可变性。
1.8 现有批量生产与连续生产的衔接
从批量生产到连续制造的评估应包括单个单元操作、工艺参数、设备、CQA和控制策略的比较。连续工艺基于与批量生产相同的单元操作和配方的情况下,产品质量属性(如多晶型、溶解度、杂质和稳定性)变化的风险可能较低,体外等效性的证明可能足以支持这种变化。比较批处理数据可支持体外等效性的证明,包括(不限于)理化性质(如多晶型和粒径)、杂质概况、药物释放概况和桥接稳定性数据。然而,在从批量生产到连续生产的转换中,也可能会出现重大变化或采用新方法的情况。如连续工艺可以包含一种新的结晶方法,改变晶体形式或配方变化。这些变化可能带来更高的风险,因此可能需要更多的体内生物等效性研究。
1.9 名词解释
主动过程控制系统:一种由硬件和软件体系结构、机制和算法组成的系统,可以自动调整过程以将过程输出保持在所需范围内。
自动化系统:监控产品生产和服务的广泛系统。自动化系统可以参考计算机硬件、软件、外围设备、网络、云基础设施、操作员及相关文档(如用户手册、标准操作规程等)。
控制策略:从对当前产品和工艺的理解得出一套有计划的控制措施,以确保工艺性能和产品质量。控制可以包括与原料药、制剂原料和成分相关的参数和属性、设施和设备运行条件、过程控制、成品质量标准以及相关的监控方法和监控频率[人用药品注册技术国际协调会议(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH Q10)]。
持续的工艺验证:保证在常规生产过程中工艺保持在受控状态。
干扰:有意或无意地引入系统的工艺输入(如工艺参数、物料属性、设备条件和/或环境)的变更。
实时放行检测:基于工艺数据评估和确保中间体和/或成品质量的能力,通常包括检测的物料属性和工艺控制的有效组合(ICH Q8)。
停留时间分布:描述质量或流体元素在过程中停留时间的概率分布。
1.10 小结
该部分内容可为智能制造质量控制方面提供参考,有助于厘清智能制造过程的控制关键环节和关键点。如生产过程的关注点、控制策略、工艺验证、扩大生产规模(如适用)、将已有生产工艺桥接到智能制造(如适用)。
2 片剂连续制造的研究进展
Vanhoorne等[10]概述了用于连续片剂生产线中不同单位操作(通过直接压片或包括中间制粒步骤)的关键质量属性检测的PAT应用,见表2。显然,几乎所有关键质量属性都可以通过近红外光谱法和/或拉曼光谱法进行监控。近红外光谱和拉曼光谱在连续片剂生产中的应用主要包括使用多点光谱分光光度计,使用同一光谱同时监测不同的CQAs,预测溶出行为,测定低剂量制剂的混合均匀性或含量均匀性。
Domokos等[58]提供了在概念验证水平上传统压片端到端连续制造的一个示例。Razavi等[59]在连续制造中对片剂重量变化进行了预测。Ganesh等[60]引入基于状态的维护(condition-based maintenance,CBM)作为持续验证和维持先进药品制造系统的一般策略,重点是口服固体制剂的持续生产。CBM等框架通过利用过程知识和实时数据,以实现持续验证和卓越操作。
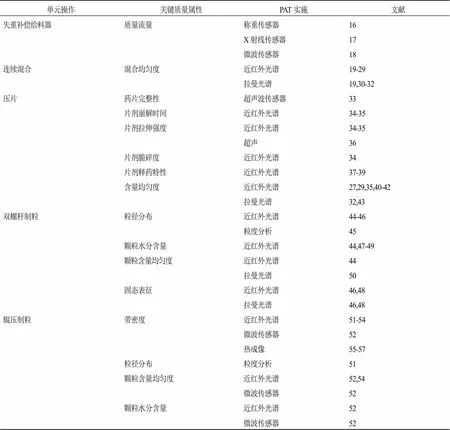
表2 关键质量属性及相应的PAT测量技术
该部分内容对于中药智能制造的过程分析技术研究有参考作用。
3 中药智能制造的研究进展
余雅婷等[61]将智能制造能力成熟度模型中5个等级分别对应为已规划级(规范化、信息化、基础化),规范级(标准化、数字化、规范化),集成级(集成、数据、共享),优化级(挖掘、应用、人工智能),引领级(预测、预警、自适应)。并在中药固体制剂智能制造方面,进行了以下几部分的研究:(1)数字化表征工艺参数。在中药智能制药过程数字化环节中,建立了吸湿性、软化点、黏性的表征参数,为智能制药提供参数表征方法。(2)工艺相关的模型建立。将中药制剂工艺参数、物理特性与制剂产品的质量联系起来,用模型进行表达,建立的模型包括中药物理属性与干法制粒相关性、中药吸湿性与制剂工艺相关性、片剂工艺相关模型等,为智能制药提供数据和模型基础。(3)质量控制相关的预测研究。建立处方和工艺的预测模型,包括以微晶纤维素为稀释剂的中药处方流动性、流化床制粒中相关的工艺、制剂原料-辅料-硬胶囊剂质量相关性、成分与喷雾干燥粘壁等预测模型,并通过实验验证了模型的可靠性。
熊皓舒等[62]对中药智能制造质量进行了数字化研究:(1)建立以质量数字化为核心的中药智能制造方法学,主要包括在工艺质量设计、生产过程控制、产品批次评价3个方面的数字化关键技术。(2)进行中药工厂智能制造系统的架构设计,对涵盖种苗、种植、饮片、制造、仓储、质量管理环节各系统的功能模块和数据互通关系进行了说明。(3)以复方丹参滴丸生产车间为例,介绍了数字化关键技术的研究情况,以及过程检测与分析系统、数据采集与监控系统(supervisory control and data acquisition,SCADA)、制造执行系统(manufacturing execution system,MES)、数据挖掘分析系统、企业资源计划(enterprise resource planning system,ERP)等主要系统的实际运行和生产应用情况。建议:(1)针对数据定义、数据采集、分析挖掘与大数据平台建立,提炼共性技术方法并建立行业标准;(2)构建基于模型的实时反馈控制、优化与决策方法;(3)加快实时测量与分析技术的突破;(4)与临床疗效目标相关联的新药开发虚拟仿真技术;(5)连续制造的法规监管,连续生产成套技术与装备解决方案。
仲怿等[63]通过对舒血宁注射液进行化学实体辨识、制药过程参数辨识、制药过程智能管理(电子批记录管理和质量溯源)、制药过程参数控制、制药工艺品质控制(包括数据抽取、质量一致性分析、构建过程性能预测模型、工艺品质调优),建立了中药制药知识图谱1.0平台用于舒血宁注射液的智能制造。
司梦兰等[64]综述了数据驱动的智能制造技术在各个行业中的应用情况。于洋等[65]以新型中药提取设备与中药丸剂干燥设备的数字孪生研究为实例,探讨了基于数字孪生的中药智能制药关键技术。刘红宁等[66]创新了中药大规格高速压片技术与装备、中药大容量包衣技术与装备、中药双向逆流干燥技术与装备等,并构建了以健胃消食咀嚼片、草珊瑚含片、金水宝胶囊等为代表的中药大品种集群。
该部分内容体现了中药智能制造的研究实践,可以看出目前已形成了一些有益的探索经验。
4 智能制造相关的方法进展
Narayanan等[67]综述了基于模型的方法在不同生物制药相关应用中的现状,所应用的工艺模型可将工艺数据转换为更有价值的信息,指导决策并支持数字和自动化技术的创建。包括工艺监控、工艺控制、基于模型的工艺优化和实验设计、基于模型的高通量生物制药开发、基于模型的规模放大和缩小。Wasalathanthri等[68]从振动光谱、多变量数据分析、多属性色谱、质谱、传感器和自动采样技术等方面对PAT技术进行了综述,并且在数据自动化、数据可视化和数据智能应用方面提供见解,用于PAT的高级分析。Sun等[69]提出了智能制造中生产计划的可视化分析方法PlanningVis。
Zhang等[70]提出了一种利用领域知识丰富分析模型的方法。结合实例展示了利用丰富的分析模型来支持贝叶斯网络模型的开发。首先,建议将领域知识形式化,以支持分析模型的开发。其次,为了允许领域知识与分析模型的交换,建议通过语义连接将形式化的领域知识与分析模型集成起来。James 等[71]基于元启发式进化算法,对解耦点位置进行优化,用于智能大规模定制制造。Guo等[72]提出了一种用于智能制造物流系统的自适应协同控制模式,以提高系统的智能性、灵活性和顺应性。
该部分内容为中药智能制造的关键共性技术研究提供了思路。
5 结语
《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》[1]指出:“深入实施增强制造业核心竞争力和技术改造专项,鼓励企业应用先进适用技术、加强设备更新和新产品规模化应用。建设智能制造示范工厂,完善智能制造标准体系。深入实施质量提升行动,推动制造业产品‘增品种、提品质、创品牌’”“加强中医药关键技术装备研发”“促进设备联网、生产环节数字化连接和供应链协同响应,推进生产数据贯通化、制造柔性化、产品个性化、管理智能化”。2020年国家药监局发布的《关于促进中药传承创新发展的实施意见》[73]指出:“推动中药制药技术升级,鼓励生产企业逐步实现智能制造”。
通过分析FDA《连续制造的质量考虑指导原则》以及连续制造和智能制造的国内外研究进展,尝试提出中药智能制造的研究思路,可考虑从以下几个层级分步骤进行研究,见图1。一是中药智能制造的总体研究思路,重点考虑药品的生产全过程质量控制;二是中药智能制造的关键共性技术方法研究;三是与剂型相关的中药固体口服制剂智能制造研究。
5.1 中药智能制造的总体研究思路
从中药智能制造的全过程质量控制角度,考虑其质量控制的注意事项。包括(不限于):(1)生产过程的关注点,如物料的可追溯性;(2)控制策略,如取样方案、实时放行检测(涉及近红外法检测方法、开发模型等)、设备集成(如适用)、设备维护和清洁、自动控制系统、数据处理;(3)工艺验证,如工艺设计、工艺确认、持续的工艺验证;(4)扩大生产规模(如适用);(5)将已有生产工艺桥接到智能制造(如适用),该部分研究内容较为复杂,需基于风险分情况讨论。
5.2 中药智能制造的关键共性技术方法研究
(1)过程分析技术研究。过程分析技术可包括(不限于):近红外光谱、拉曼光谱、超声波传感、微波传感、粒度分析、热成像等。可研究建立中药智能制造相关的检测方法和标准;(2)数字化研究。数字化研究包括工艺参数数字化、产品质量数字化等;(3)建模研究。建模研究包括工艺相关的模型、质量控制相关的预测模型、建立智能制造系统各环节的功能模块等。如新型中药提取或干燥设备的数字孪生研究;(4)基于模型的实时反馈研究。基于模型的实时反馈研究可包括数据自动化、数据可视化和数据智能应用等方面;(5)自适应控制研究。自适应控制研究可包括基于贝叶斯网络的自适应控制。
5.3 中药固体口服制剂的智能制造研究
中药固体口服制剂的智能制造研究可包括片剂、颗粒剂、丸剂、胶囊剂等。在对中药智能制造的总体质量控制要点有充分了解,并建立了剂型相关的智能制造共性技术方法的情况下,可形成剂型相关的智能制造研究要点。
我国在中药智能制造方面的研究实践还在起步阶段,尚需更多的专家学者关注并参与研究工作。本文提出了初步的研究思路作为研究素材供交流探讨,旨在响应政策,推动中药制药技术升级,鼓励生产企业逐步实现智能制造。

图1 中药智能制造研究思路
利益冲突 所有作者均声明不存在利益冲突
[1] 新华社. 中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要 [J]. 中国水利, 2021(6): 1-38.
[2] 国务院. 国务院关于印发《中国制造2025》的通知(国发〔2015〕28号)[EB/OL]. (2015-05-19) [2021-03-17]. http:// www.gov.cn/zhengce/content/2015-05/19/content_9784.htm.
[3] 工业和信息化部财政部. 工业和信息化部财政部关于印发智能制造发展规划(2016—2020年)的通知(工信部联规〔2016〕349号)[EB/OL]. (2016-12-08) [2021-03-17]. https://www.miit.gov.cn/zwgk/zcwj/wjfb/zbgy/art/ 2020/art_ef82844f3d864b44906f72bdd2eb14d8.html.
[4] 中华人民共和国工业和信息化部. 国家智能制造标准体系建设指南(2018年版)[EB/OL]. (2018-10-18) [2021-03-17]. https://www.miit.gov.cn/n1146285/n1146352/n3054355/ n3057585/n3057589/c6013753/part/6013772.pdf.
[5] U. S. Food & Drug Administration (FDA). 2021 Advancing regulatory science at FDA: Focus areas of regulatory science (FARS) [EB/OL]. (2021-01-11) [2021-03-17]. https://www.fda.gov/media/145001/download.
[6] U. S. Food & Drug Administration (FDA). Advanced manufacturing [EB/OL]. (2021-01-16) [2021-03-17]. https://www.fda.gov/emergency-preparedness-and-response/mcm- issues/advanced-manufacturing.
[7] Hu J Y, Gao S N. Research and application of capability maturity model for Chinese intelligent manufacturing [J]., 2019, 83: 794-799.
[8] US. Food & Drug Administration (FDA). Quality considerations for continuous manufacturing guidance for industry [EB/OL]. (2019-02-27) [2021-03-17]. https://www. fda. gov/media/121314/download.
[9] Badman C, Cooney C L, Florence A,. Why we need continuous pharmaceutical manufacturing and how to make it happen [J]., 2019, 108(11): 3521-3523.
[10] Vanhoorne V, Vervaet C. Recent progress in continuous manufacturing of oral solid dosage forms [J]., 2020, 579: 119194.
[11] Nasr M M, Krumme M, Matsuda Y,. Regulatory perspectives on continuous pharmaceutical manufacturing: Moving from theory to practice: September 26-27, 2016, international symposium on the continuous manufacturing of pharmaceuticals [J]., 2017, 106(11): 3199-3206.
[12] Badman C, Cooney C L, Florence A,. Why we need continuous pharmaceutical manufacturing and how to make it happen [J]., 2019, 108(11): 3521-3523.
[13] Yu L X, Kopcha M. The future of pharmaceutical quality and the path to get there [J]., 2017, 528(1/2): 354-359.
[14] Pagliarulo N. Pharma’s slow embrace of continuous manufacturing [EB/OL]. (2018-09-24) [2021-03-17]. https://www.biopharmadive.com/news/pharmas-slow-embrace-of-continuous-manufacturing/532811/.
[15] Lee S L. FDA Perspective on continuous manufacturing [EB/OL]. (2018-12-13) [2021-03-17]. http://ccpmj.org/ downloads/1_Dr. Lee_rev(en).pdf.
[16] Engisch W E, Muzzio F J. Method for characterization of loss-in-weight feeder equipment [J]., 2012, 228: 395-403.
[17] Ganesh S, Troscinski R, Schmall N,. Application of X-ray sensors for in-line and noninvasive monitoring of mass flow rate in continuous tablet manufacturing [J]., 2017, 106(12): 3591-3603.
[18] Meier R, Harting J, Happel J,, Implementation of microwave sensors in continuous powder feeding [J]., 2017, 79: 576-582.
[19] Harms Z D, Shi Z Q, Kulkarni R A,. Characterization of near-infrared and Raman spectroscopy for in-line monitoring of a low-drug load formulation in a continuous manufacturing process [J]., 2019, 91(13): 8045-8053.
[20] Scheibelhofer O, Balak N, Wahl P R,. Monitoring blending of pharmaceutical powders with multipoint NIR spectroscopy [J]., 2013, 14(1): 234-244.
[21] Singh R, Sahay A, Karry K M,. Implementation of an advanced hybrid MPC-PID control system using PAT tools into a direct compaction continuous pharmaceutical tablet manufacturing pilot plant [J]., 2014, 473(1/2): 38-54.
[22] Van Snick B, Holman J, Cunningham C,. Continuous direct compression as manufacturing platform for sustained release tablets [J]., 2017, 519(1/2): 390-407.
[23] van Snick B, Holman J, Vanhoorne V,. Development of a continuous direct compression platform for low-dose drug products [J]., 2017, 529(1/2): 329-346.
[24] Vanarase A U, Järvinen M, Paaso J,. Development of a methodology to estimate error in the on-line measurements of blend uniformity in a continuous powder mixing process [J]., 2013, 241: 263-271.
[25] De Leersnyder F, Peeters E, Djalabi H,. Development and validation of an in-line NIR spectroscopic method for continuous blend potency determination in the feed frame of a tablet press [J]., 2018, 151: 274-283.
[26] Martínez L, Peinado A, Liesum L,. Use of near-infrared spectroscopy to quantify drug content on a continuous blending process: Influence of mass flow and rotation speed variations [J]., 2013, 84(3): 606-615.
[27] Vargas J M, Nielsen S, Cárdenas V,. Process analytical technology in continuous manufacturing of a commercial pharmaceutical product [J]., 2018, 538(1/2): 167-178.
[28] Vanarase A U, Alcalà M, Jerez Rozo J I,. Real-time monitoring of drug concentration in a continuous powder mixing process using NIR spectroscopy [J]., 2010, 65(21): 5728-5733.
[29] Järvinen K, Hoehe W, Järvinen M,. In-line monitoring of the drug content of powder mixtures and tablets by near-infrared spectroscopy during the continuous direct compression tableting process [J]., 2013, 48(4/5): 680-688.
[30] Li Y, Anderson C A, Drennen J K,. Method development and validation of an inline process analytical technology method for blend monitoring in the tablet feed frame using Raman spectroscopy [J]., 2018, 90(14): 8436-8444.
[31] Pauli V, Elbaz F, Kleinebudde P,. Orthogonal redundant monitoring of a new continuous fluid-bed dryer for pharmaceutical processing by means of mass and energy balance calculations and spectroscopic techniques [J]., 2019, 108(6): 2041-2055.
[32] Nagy B, Farkas A, Gyürkés M,. In-line Raman spectroscopic monitoring and feedback control of a continuous twin-screw pharmaceutical powder blending and tableting process [J]., 2017, 530(1/2): 21-29.
[33] Leskinen J T, Simonaho S P, Hakulinen M,. In-line ultrasound measurement system for detecting tablet integrity [J]., 2010, 400(1/2): 104-113.
[34] Pestieau A, Krier F, Thoorens G,. Towards a real time release approach for manufacturing tablets using NIR spectroscopy [J]., 2014, 98: 60-67.
[35] Tomuta I, Rus L, Iovanov R,. High-throughput NIR-chemometric methods for determination of drug content and pharmaceutical properties of indapamide tablets [J]., 2013, 84: 285-292.
[36] Razavi S M, Callegari G, Drazer G,. Toward predicting tensile strength of pharmaceutical tablets by ultrasound measurement in continuous manufacturing [J]., 2016, 507(1/2): 83-89.
[37] Pawar P, Wang Y F, Keyvan G,. Enabling real time release testing by NIR prediction of dissolution of tablets made by continuous direct compression (CDC) [J]., 2016, 512(1): 96-107.
[38] Freitas M P, Sabadin A, Silva L M,. Prediction of drug dissolution profiles from tablets using NIR diffuse reflectance spectroscopy: A rapid and nondestructive method [J]., 2005, 39(1/2): 17-21.
[39] Otsuka M, Tanabe H, Osaki K,. Chemoinformetrical evaluation of dissolution property of indomethacin tablets by near-infrared spectroscopy [J]., 2007, 96(4): 788-801.
[40] Boiret M, Chauchard F. Use of near-infrared spectroscopy and multipoint measurements for quality control of pharmaceutical drug products [J]., 2017, 409(3): 683-691.
[41] Colón Y M, Vargas J, Sánchez E,. Assessment of robustness for a near-infrared concentration model for real-time release testing in a continuous manufacturing process [J]., 2017, 12(1): 14-25.
[42] Karande A D, Heng P W S, Liew C V. In-line quantification of micronized drug and excipients in tablets by near infrared (NIR) spectroscopy: Real time monitoring of tabletting process [J]., 2010, 396(1/2): 63-74.
[43] Griffen J A, Owen A W, Matousek P. Quantifying low levels (<0.5% w/w) of warfarin sodium salts in oral solid dose forms using Transmission Raman spectroscopy [J]., 2018, 155: 276-283.
[44] Pauli V, Roggo Y, Kleinebudde P,. Real-time monitoring of particle size distribution in a continuous granulation and drying process by near infrared spectroscopy [J]., 2019, 141: 90-99.
[45] Meng W, Román-Ospino A D, Panikar S S,. Advanced process design and understanding of continuous twin-screw granulation via implementation of in-line process analytical technologies [J]., 2019, 30(4): 879-894.
[46] Fonteyne M, Vercruysse J, Díaz D C,. Real-time assessment of critical quality attributes of a continuous granulation process [J]., 2013, 18(1): 85-97.
[47] Fonteyne M, Gildemyn D, Peeters E,. Moisture and drug solid-state monitoring during a continuous drying process using empirical and mass balance models [J]., 2014, 87(3): 616-628.
[48] Fonteyne M, Arruabarrena J, de Beer J,. NIR spectroscopic method for the in-line moisture assessment during drying in a six-segmented fluid bed dryer of a continuous tablet production line: Validation of quantifying abilities and uncertainty assessment [J]., 2014, 100: 21-27.
[49] Chablani L, Taylor M K, Mehrotra A,. Inline real-time near-infrared granule moisture measurements of a continuous granulation-drying-milling process [J]., 2011, 12(4): 1050-1055.
[50] Harting J, Kleinebudde P. Optimisation of an in-line Raman spectroscopic method for continuous API quantification during twin-screw wet granulation and its application for process characterisation [J]., 2019, 137: 77-85.
[51] McAuliffe M A P, O’Mahony G E, Blackshields C A,. The use of PAT and off-line methods for monitoring of roller compacted ribbon and granule properties with a view to continuous processing [J]., 2015, 19(1): 158-166.
[52] Gupta A, Austin J, Davis S,. A novel microwave sensor for real-time online monitoring of roll compacts of pharmaceutical powders online: A comparative case study with NIR [J]., 2015, 104(5): 1787-1794.
[53] Acevedo D, Muliadi A, Giridhar A,. Evaluation of three approaches for real-time monitoring of roller compaction with near-infrared spectroscopy [J]., 2012, 13(3): 1005-1012.
[54] Samanta A K, Karande A D, Ng K Y,. Application of near-infrared spectroscopy in real-time monitoring of product attributes of ribbed roller compacted flakes [J]., 2013, 14(1): 86-100.
[55] Wiedey R, Šibanc R, Kleinebudde P. Laser based thermo-conductometry as an approach to determine ribbon solid fraction off-line and in-line [J]., 2018, 547(1/2): 330-337.
[56] Wiedey R, Kleinebudde P. Infrared thermography—A new approach for in-line density measurement of ribbons produced from roll compaction [J]., 2018, 337: 17-24.
[57] Omar C S, Hounslow M J, Salman A D. Implementation of an online thermal imaging to study the effect of process parameters of roller compactor [J]., 2018, 8(6): 1604-1614.
[58] Domokos A, Nagy B, Gyürkés M,. End-to-end continuous manufacturing of conventional compressed tablets: From flow synthesis to tableting through integrated crystallization and filtration [J]., 2020, 581: 119297.
[59] Razavi S M, Scicolone J, Snee R D,. Prediction of tablet weight variability in continuous manufacturing [J]., 2020, 575: 118727.
[60] Ganesh S, Su Q, Vo L B D,. Design of condition-based maintenance framework for process operations management in pharmaceutical continuous manufacturing [J]., 2020, 587: 119621.
[61] 余雅婷, 赵立杰, 杜若飞, 等. 浅析专家系统在实现中药智能制造中的作用与地位 [J]. 世界科学技术—中医药现代化, 2020, 22(3): 843-849.
[62] 熊皓舒, 章顺楠, 朱永宏, 等. 中药智能制造质量数字化研究及复方丹参滴丸实践 [J]. 中国中药杂志, 2020, 45(7): 1698-1706.
[63] 仲怿, 茹晨雷, 张伯礼, 等. 基于知识图谱的中药制药过程质量控制方法学研究 [J]. 中国中药杂志, 2019, 44(24): 5269-5276.
[64] 司梦兰, 王鐾璇, 缪培琪, 等. 基于数据驱动的过程智能优化技术研究现状及其在中药先进制药中的应用展望 [J]. 天津中医药大学学报, 2020, 39(5): 485-492.
[65] 于洋, 苗坤宏, 李正. 基于数字孪生的中药智能制药关键技术 [J]. 中国中药杂志, 2021, 46(9): 2350-2355.
[66] 刘红宁, 杨世林, 杨明, 等. 中药制造现代化: 固体制剂产业化关键技术研究及应用 [J]. 中国现代中药, 2020, 22(2): 155-161.
[67] Narayanan H, Luna M F, von Stosch M,. Bioprocessing in the digital age: The role of process models [J]., 2020, 15(1): 1900172.
[68] Wasalathanthri D P, Rehmann M S, Song Y,. Technology outlook for real-time quality attribute and process parameter monitoring in biopharmaceutical development-A review [J]., 2020, 117(10): 3182-3198.
[69] Sun D, Huang R, Chen Y,. PlanningVis: A visual analytics approach to production planning in smart factories [J]., 2020, 26(1): 579-589.
[70] Zhang H, Roy U, Lee Y T T. Enriching analytics models with domain knowledge for smart manufacturing data analysis [J]., 2020, 58(20): 6399-6415.
[71] James C D, Mondal S. Optimization of decoupling point position using metaheuristic evolutionary algorithms for smart mass customization manufacturing [J]., 2021, 33(17): 11125-11155.
[72] Guo Z, Zhang Y, Zhao X,. CPS-based self-adaptive collaborative control for smart production-logistics systems [J]., 2021, 51(1): 188-198.
[73] 国家药品监督管理局. 国家药监局关于促进中药传承创新发展的实施意见[EB/OL]. (2020-12-25) [2021-03-17]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/2020 1225163906151.html.
Reference and consideration for smart manufacturing of traditional Chinese medicine by continuous manufacturing of FDA
SUN Yu1, XU Gan2, WEN Hai-ruo3
1. Center for Drug Evaluation, National Medical Products Administration, Beijing 100022, China 2. Beijing University of Chinese Medicine, Beijing 102248, China 3. National Institutes for Food and Drug Control, Beijing 100050, China
By understanding Food and Drug Administration (FDA)’s, combined with research progress on continuous manufacturing of tablets and smart manufacturing of traditional Chinese medicine (TCM), as well as research progress on related methods of smart manufacturing, the classification research ideas of smart manufacturing of TCM were considered. It is suggested that smart manufacturing of TCM can be studied from three levels: (1) The overall study of smart manufacturing of TCM: From the perspective of the whole process quality control of smart manufacturing of TCM, the points for attention in quality control were considered such as manufacturing process concerns, control strategies, process validation, scaling up production (if applicable), bridging existing manufacturing processes to smart manufacturing (if applicable); (2) Study on generic technology and method of smart manufacturing of TCM such as process analytical technology research, digitization research, modeling research, model-based real-time feedback research, adaptive control research; (3) Smart manufacturing of solid oral preparations.
smart manufacturing; continuous manufacturing; process analytical technology; digitization; modeling; adaptive control
R288
A
0253 - 2670(2021)21 - 6755 - 13
10.7501/j.issn.0253-2670.2021.21.034
2021-05-21
国家自然科学基金资助项目(81503347);北京中医药大学中央高校基本科研业务费项目(2021-JYB-XJSJJ037)
孙 昱,女,博士,研究方向为药品政策与技术评价研究。E-mail: sunyu_amber@126.com
徐 敢,男,副主任药师,从事药事监管科学和药物经济学研究。E-mail: xgcg@163.com
文海若,女,研究员,博士,研究方向为药理毒理。Tel: (010)67876252 E-mail: hairuowen@163.com
[责任编辑 崔艳丽]

