大蓟抗结核杆菌的活性成分及作用机制研究
万成杰,张春菁,谢宗会,杨再昌, 2*
大蓟抗结核杆菌的活性成分及作用机制研究
万成杰1,张春菁1,谢宗会1,杨再昌1, 2*
1. 贵州大学药学院,贵州 贵阳 550025 2. 贵州医科大学,省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014
从大蓟根中分离抗结核杆菌活性成分,并初步探讨其抗结核杆菌的作用机制。采用活性跟踪分离方法,从大蓟根中分离抗结核杆菌活性成分,运用棋盘试验法研究大蓟活性成分与异烟肼、利福平和吡嗪酰胺的联合抗菌作用,运用分子对接软件初步探讨活性单体成分与KatG酶的亲和力,采用qRT-PCR法考察活性化合物干预结核分枝杆菌后KatG酶基因的相对转录量,采用紫外分光光度法测定KatG酶的活力,采用扫描电镜观察结核杆菌的形态。从大蓟根分离得到具有抗结核杆菌活性的化合物HP01,鉴定为槲皮素。槲皮素抑制结核杆菌的最低抑菌浓度(minimum inhibitory concentration,MIC)值为160 μg/mL。槲皮素与吡嗪酰胺存在相加作用,与异烟肼、利福平无拮抗作用。分子对接显示,槲皮素与KatG酶具有较强的亲和力。酶活力测试结果表明槲皮素对结核杆菌KatG酶具有抑制作用。结核杆菌被槲皮素处理后其基因转录出现明显的补偿上调。扫描电镜结果显示,槲皮素能破坏结核杆菌细胞壁。大蓟抗结核杆菌的活性成分为槲皮素,槲皮素能够抑制结核杆菌KatG酶活性,导致结核杆菌结构破坏,从而杀死结核杆菌。在设计新的抗结核组合用药方案时,可以考虑加入槲皮素。
大蓟;结核杆菌;活性成分;作用机制;KatG酶;槲皮素
结核病是由结核分枝杆菌引起的重大传染病之一,以潜伏期长、易复发为主要特征,主要通过呼吸道进行传播,可侵犯全身各器官,以肺结核最为常见。据2020年WHO《全球结核病报告》数据显示,2019年全球结核潜伏感染人群约为20亿,约有1000万人罹患结核病。中国是结核病高负担国家之一,耐利福平结核病患者数量居全球第2位(6.5万,占全球14%),耐药菌流行使我国结核病的防控变得更为复杂。发现新药是控制结核病的有效手段之一。
大蓟为菊科植物大蓟Fisch. DC.的干燥地上部分或根,在我国大部分地区均有分布[1-2]。据报道,大蓟具有抗菌、降血压、抗肿瘤、抗糖尿病、抗骨质疏松、杀线虫等多种药理活性[3-8],在《唐本草》《本草新编》《滇南本草》《本草通玄》等中医药古籍中均有记载。《十药神书》是我国现存最早的结核病治疗专著,作者为元代的葛可久,结核在中国古代称为痨瘵、鬼疰、尸疰、痨病等。《十药神书》介绍了10个治疗结核的方剂,第1个叫“十灰散”,该方由大蓟、小蓟、荷叶、扁柏叶、茅根、茜草根、山栀、大黄、牡丹皮、棕榈皮10味药组成。此外《滇南本草》记载,大蓟“散瘰疬结核,治结核于项左右”。基于古代典籍、现代研究报道[9]和本课题组的前期研究结果[10],对大蓟根的抗结核杆菌活性进行了体外研究。
采用活性跟踪分离法,从大蓟根分离纯化活性化合物,并鉴定活性单体成分的结构为槲皮素;研究活性单体成分与异烟肼、利福平和吡嗪酰胺的联合抗菌作用;通过扫描电镜、分子对接、qRT-PCR、酶活力测定等,初步揭示活性单体成分的抗结核杆菌机制。本研究为大蓟的临床应用提供了科学依据,为研发新型抗结核杆菌药物提供了新的思路。
1 材料
1.1 药材
大蓟根挖采自贵阳市南明区永乐乡鱼梁河谷,经贵州大学药学院杨再昌教授鉴定为菊科植物大蓟Fisch. DC.的根。
1.2 药品与试剂
Middle brook 7H9培养基购自美国Sigma公司;薄层硅胶板GF254和200~300目硅胶购自青岛海洋化工集团公司;改良罗氏培养基基础够自上海博微生物科技有限公司;甲醇、二氯甲烷、醋酸乙酯、石油醚等均为国产分析纯。
1.3 仪器
StepOne型qRT-PCR仪(美国ABI公司);微量分光光度计(美林恒通仪器有限公司);凝胶成像系统(上海复日科技有限公司);电泳仪(北京六一生物科技有限公司);紫外可见分光光度计(上海菁华科技仪器有限公司)。
2 方法
2.1 大蓟根抗结核杆菌成分的活性跟踪分离
2.1.1 大蓟根的提取与萃取分段 将大蓟根(10 kg)洗净切碎后,自然晾干,粉碎。分批用80%乙醇回流提取3次,每次1 h,滤过,合并提取液,用旋转蒸发仪进行减压浓缩,将浓缩液水浴蒸干,得到乙醇提取物浸膏。将乙醇提取物浸膏溶于适量10%乙醇溶液中,依次用石油醚、醋酸乙酯反复萃取至无色,浓缩得到石油醚萃取物(92 g)、醋酸乙酯萃取物(110 g)和水相剩余部分(245 g)。采用刃天青显色法[11],对大蓟提取物的不同萃取部位进行活性跟踪,发现醋酸乙酯萃取物抗结核杆菌活性最强,因此将醋酸乙酯萃取部位视为有效部位。
2.1.2 大蓟醋酸乙酯部位抗结核杆菌的活性跟踪分离 采用正相硅胶柱色谱对醋酸乙酯萃取物进行分离,流动相为石油醚-醋酸乙酯(10∶1、8∶1、6∶1、4∶1、2∶1、1∶1),梯度洗脱,得到6个组分,分别为F1(3.5 g)、F2(4.6 g)、F3(7.2 g)、F4(8.6 g)、F5(7.4 g)和F6(12.2 g),活性跟踪发现有效组分为F5。将F5经硅胶柱色谱继续梯度洗脱,洗脱剂为石油醚-醋酸乙酯,洗脱液按薄层色谱结果进行合并,最终共得到4个亚组分,分别为Fr1(1.4 g)、Fr2(1.7 g)、Fr3(1.2 g)、Fr4(0.7 g)。活性跟踪表明有效组分为Fr2,Fr2经硅胶柱色谱及制备薄层色谱分离纯化,得到单体化合物HP01(200 mg)。
2.2 抗结核杆菌活性测试
2.2.1 H37Rv菌悬液的制备 从改良罗氏培养基中取新鲜分枝杆菌(H37Rv)培养物约10 mg,加入到4 mL 7H9培养基中研磨,菌悬液调整至麦氏管1.0的浊度,于4 ℃保存备用。
2.2.2 Middle brook 7H9培养基的制备 精确称定Middle brook 7H9培养基4.7 g,加入1 L水、2 mL甘油,搅拌溶解,混合均匀,分装于150 mm×15 mm的玻璃试管中,每管总体积2 mL。
2.2.3 样本溶液的制备 样本均用二甲基亚砜(DMSO)制成母液,采用二倍稀释法,用Middle brook 7H9培养基配制成系列浓度(DMSO的终浓度<5%),每个浓度平行制备3管,阳性对照组为含有1 μg/mL异烟肼的培养基,阴性对照组为不加药物但含5% DMSO的培养基。
2.2.4 活性测试 将制备好的含药试管置于121 ℃高压灭菌锅灭菌30 min,冷却至25 ℃,每管分别接种20 μL H37Rv菌悬液,置于37 ℃的恒温培养箱中培养7 d,然后加入15 μL 0.01%刃天青染色液,摇匀后将其置于37 ℃的恒温培养箱中,培养期间每半小时观察1次,并做好相应的记录,当发现阴性对照组溶液变红,而阳性对照组未变色时,培养结束,观察并记录实验结果。样本的最低抑菌浓度(minimum inhibitory concentration,MIC)值定义为培养基保持蓝色的最小浓度。
2.3 HP01与异烟肼、利福平、吡嗪酰胺联合抗菌实验
采用棋盘试验法,按照文献方法[12]操作,采用联合抑菌指数(fractional inhibitory concentration index,FICI)判断结果:FICI≤0.5,协同作用;0.5<FICI≤1,相加作用;1<FICI≤2,无关作用;FICI>2,拮抗作用。
2.4 HP01与结核杆菌KatG酶的分子对接
2.4.1 小分子配体的准备 预试验时,发现HP01对结核杆菌KatG具有抑制作用,因此,进行分子对接研究。使用ChemDraw Professional 15.0软件绘制配体小分子HP01的结构式,然后将其二维结构转化为三维结构,将三维结构拷贝到Discovery Studio 2016软件中,通过该软件进行加氢、去除重复链、产生异构体、互变异构体和三维构象,最后加CHARMm力场进行能量最优化。
2.4.2 KatG蛋白的准备 从RCSB PDB数据库(http://www.rcsb.org/)中检索并下载结核杆菌KatG蛋白晶体结构,并对其进行删除水分子、去除原配体、加氢等预处理。
2.4.3 分子对接 将准备好的受体蛋白与小分子配体导入到Discovery Studio 2016软件中,点击Receptor-Ligand Interaction/Dock Ligands,点击Lib Dock进行分子对接,设置对接参数为Conformation Method:BEST,Docking Preferences:High Quality,其余参数均为默认值,参数设置完成后点击Run进行分子对接,对接完成后,LibDock Score由高到低依次排列,对打分结果进行分析。
2.5 HP01对结核杆菌KatG酶的抑制活性
取新鲜培养的结核杆菌约100 mg加入离心管中,向其中加入4 mL溶菌酶溶液(用0.05 mol/L PBS液配制,pH 7.2),混匀,多次搅拌后离心,上清液即为粗酶液。实验在试管中进行,调整酶液吸光度(240)至0.5,用酶液调零。对照组:酶液3 mL,PBS溶液1 mL;加药组:酶液3 mL,含药(HP01)PBS溶液1 mL,HP01的终质量浓度为160 μg/mL(MIC)。对照组、加药组均放置于25 ℃水浴中,2 h后,同时加入过氧化氢溶液(终浓度为20 μmol/L),2 min后,立即测定240值,计算抑制率。
抑制率=(加药-对照)/对照
2.6 HP01对KatG基因转录的影响
2.6.1 样品制备 分别用80、160 μg/mL HP01处理结核杆菌,阴性对照组为不含药的7H9培养基,相同条件下培养48 h,离心后取沉淀部分提取RNA。
2.6.2 设计与合成引物 在NCBI GenBank数据库中查找有关结核杆菌H37Rv菌株中基因序列,使用Primer Premier 5.0软件设计实验所需要的引物,并由生工生物工程(上海)股份有限公司合成,内参基因为。引物序列:上游引物338F-5’ACTCCTACGGGAGGCAGCAG-3’,下游引物518R-5’ATTACCGCGGCTGCTGG-3’;上游引物5’-GAGCAACACCCACCCATTACA-3’,下游引物5’-GTTTTGGTGCAGTACCTTCAGATT-3’。
2.6.3 RNA抽取及检测 按UNIQ-10柱式Trizol总RNA抽提试剂盒(B511321)说明书提取总RNA,用微量分光光度计检测RNA浓度。
2.6.4 cDNA模板的合成 按照RevertAid First Strand cDNA Synthesis Kit试剂盒(6210A)进行第一链cDNA的合成,−20 ℃保存。
2.6.5 qRT-PCR检测 qRT-PCR反应按照UNlQ-10柱式Trizol总RNA抽提试剂盒(B511321)说明书进行。采用2−ΔΔCt法计算基因相对表达量。
2.7 HP01对结核杆菌的形态学干预
结核杆菌分别培养在HP01质量浓度为160、320、640 μg/mL的7H9培养基中,并设置阴性对照组,37 ℃培养48 h后离心,取沉渣制样,用扫描电子显微镜(SEM)观察。
3 结果
3.1 不同萃取部位的活性跟踪
采用刃天青显色法,对大蓟乙醇提取物的不同萃取部位进行活性测试,醋酸乙酯萃取物的MIC值为320 μg/mL,其余部位MIC值应大于640 μg/mL(表1)。可见醋酸乙酯萃取物是抗结核杆菌的有效部位。醋酸乙酯萃取部位通过硅胶柱色谱分离,得到6个组分F1~F6,活性测试结果见表2,可以确定F5为有效组分。对F5的4个亚组分Fr1~Fr4进行活性跟踪,确定Fr2为活性亚组分,对Fr2进一步纯化,得到化合物HP01,化合物HP01抗结核杆菌的MIC值为160 μg/mL。

表1 大蓟不同萃取部位的抗结核杆菌活性
“+”表示有活性,“—”表示无活性,表2同
“+” means active, “—” means inactive, same as table 2

表2 大蓟醋酸乙酯萃取部位的活性跟踪
3.2 结构鉴定
化合物HP01:黄色粉末。1H-NMR (400 MHz,MeOD): 6.89 (1H, s, H-2′), 7.62 (1H, d,= 44 Hz, H-6′), 7.73 (1H, d,= 44 Hz, H-5′), 6.38 (1H, s, H-8), 6.18 (1H, s, H-6), 12.26 (1H, s, OH-5), 10.26 (1H, s, OH-7), 9.32 (1H, s, OH-3), 9.09 (1H, s, OH-4′), 8.63 (1H, s, OH-3′);13C-NMR (100 MHz, MeOD): 175.9 (C-4), 164.2 (C-7), 161.1 (C-5), 156.8 (C-9), 147.4 (C-2), 146.6 (C-4′), 144.8 (C-3′), 135.8 (C-3), 122.8 (C-1′), 120.3 (C-6′), 114.8 (C-5′), 114.6 (C-2′), 103.1 (C-10), 97.8 (C-6), 93.0 (C-8)。以上数据与文献报道一致[13],故鉴定HP01为槲皮素(图1)。
3.3 HP01与异烟肼、利福平、吡嗪酰胺联合抗菌实验结果
按照棋盘实验方法,评价HP01与一线抗结核药物的协同作用,结果见表3。HP01与吡嗪酰胺存在相加作用,可以降低吡嗪酰胺的MIC值4倍,HP01不影响异烟肼、利福平的抗结核杆菌活性。可见HP01与异烟肼、利福平不存在拮抗作用,能增强吡嗪酰胺的抗结核杆菌作用,具有与一线药物组合治疗结核病的潜质。

图1 HP01的结构
3.4 分子对接结果
从化合物HP01与受体蛋白KatG对接后的二维图(图2)可以看到,化合物HP01能够与KatG很好地结合,化合物HP01与KatG的氨基酸残基GLY32、GLU195、GLN36形成氢键,与LYS46形成Pi-Cation相互作用,与GLN36形成1个Pi-Sigma吸引作用(图3),打分结果为107.93,这些作用力稳定了复合物构象,推测受体蛋白KatG可能是化合物HP01的作用靶点。
3.5 化合物HP01对结核杆菌KatG酶的干预作用
对照组240为0.517±0.014,HP01组240为0.554±0.012,表明化合物HP01对结核杆菌KatG酶存在抑制作用。尽管抑制率仅为7.2%,但是足以导致结核杆菌内的H2O2大量累积,从而对结核杆菌生命力产生影响,并最终导致结核杆菌死亡。
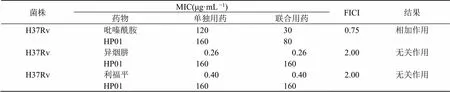
表3 HP01与异烟肼、利福平、吡嗪酰胺的联合抗菌试验
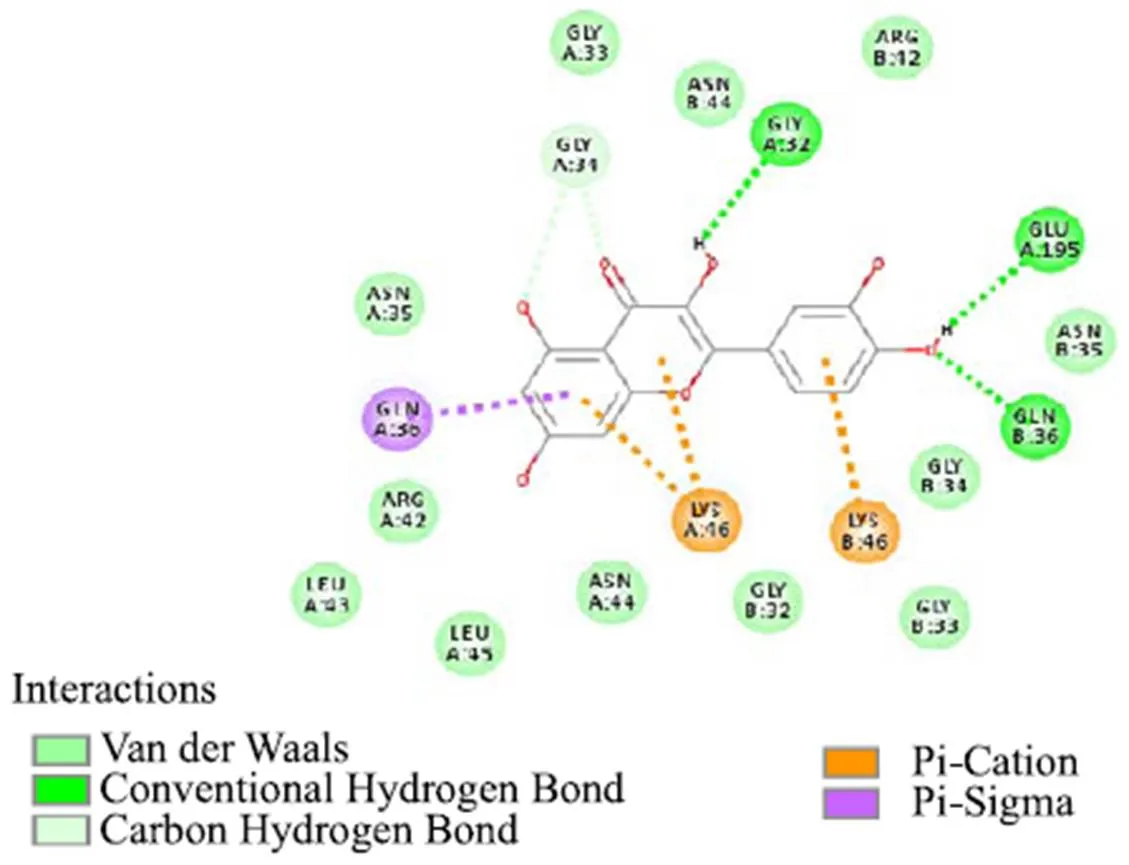
图2 化合物HP01与KatG的相互作用二维图
3.6 KatG基因相对定量结果
如图4所示,与对照组相比,经化合物HP01(160 μg/mL)处理后基因相对表达量明显上调(<0.01),呈剂量相关性。可见HP01抑制结核杆菌KatG后,结核杆菌基因出现明显的补偿表达。
3.7 HP01对结核杆菌形态学的影响
如图5所示,阴性对照组结核杆菌形态结构完整、轮廓清晰,呈短棒状、细长略带弯曲。经HP01处理后,结核杆菌菌体变成球状、变形、菌体破裂。可见化合物HP01能破坏结核杆菌的细胞壁或细胞膜结构,从而导致结核杆菌死亡。

图3 化合物HP01与KatG的相互作用三维图

与对照组比较:**P<0.01
4 讨论
结核病至今仍是全球十大致死原因之一,尤其是耐药结核杆菌逐渐增多,使结核病的防控形势更加严峻。吡嗪酰胺是缩短结核治疗时间、降低结核病复发率的关键药物,但是吡嗪酰胺肝毒性大,由于耐吡嗪酰胺菌株较多,临床上普遍大剂量使用吡嗪酰胺,这使得吡嗪酰胺的毒性问题更加突出[14-15]。因此,寻找能增强吡嗪酰胺药效、减少其用量的药物对结核病治疗具有重大意义[16]。
本研究从大蓟跟踪分离出抗结核杆菌活性分子,鉴定为槲皮素,槲皮素单独使用,在体外抑制结核杆菌的MIC值较高(160 μg/mL),但是联合抗菌实验证实,槲皮素能增强吡嗪酰胺的抗结核杆菌作用,并且与异烟肼、利福平无拮抗作用,槲皮素的这一特征为设计新型抗结核联合用药方案提供了参考。

图5 结核杆菌的扫描电镜结果
槲皮素能够抑制结核杆菌KatG酶,该酶主要负责清除菌体内的H2O2,H2O2是重要的氧自由基,可破坏结核杆菌的大分子[17],抑制KatG酶将导致结核杆菌细胞内H2O2过度累积,使结核杆菌的重要结构比如细胞壁被破坏,产生杀菌作用。为了进一步证实槲皮素的抗菌机制,采用分子对接模拟发现槲皮素与KatG酶存在较强的亲和力。用槲皮素处理结核杆菌后,基因转录出现补偿性上调,呈剂量相关性。这些结果提示,槲皮素通过抑制结核杆菌KatG酶,造成细胞内H2O2累积,产生结构破坏,从而杀死结核杆菌。扫描电镜结果显示,经槲皮素处理后,结核杆菌出现体积膨大、形状变化和菌体破裂等变化,表明细胞壁被破坏,这些变化可能是由于细胞内H2O2过度累积引起。有待采用X射线衍射技术,证实槲皮素与KatG酶形成复合物。
大蓟是常用中草药,《十药神书》明确大蓟可用于痨病治疗,本研究证实,大蓟的槲皮素成分具有抗结核杆菌活性。槲皮素是存在于多种植物中的一种黄酮类化合物,具有广泛的生物学活性[18-20],本研究提示槲皮素抗结核杆菌的活性不算很强,使用槲皮素分子原型用于结核病治疗缺乏临床可行性,但是槲皮素可能是通过抑制KatG酶而发挥抗结核杆菌作用,其作用机制较为新颖,因此,下一步拟对槲皮素进行结构修饰,合成抗结核杆菌活性更强、具有成药性的分子,并结合动物感染模型进行体内药效验证。
利益冲突 所有作者均声明不存在利益冲突
[1] 植飞, 孔令义, 彭司勋. 中药大蓟的化学及药理研究进展 [J]. 中草药, 2001, 32(7): 664-667.
[2] 符玲, 龚千锋, 钟凌云. 大蓟的研究进展综述 [J]. 江西中医药, 2003, 34(10): 42-43.
[3] 叶莉, 杨凤琴, 梁军, 等. 宁夏大蓟提取物不同极性部位对4种念珠菌的体外抑菌活性 [J]. 中国实验方剂学杂志, 2011, 17(19): 222-223.
[4] 王振平, 毕佳, 陈忠科. 大蓟水煎剂治疗小鼠高血压的研究 [J]. 山东大学学报: 理学版, 2011, 46(7): 7-10.
[5] 王振飞, 李煜, 戴宝贞, 等. 大蓟对5种癌细胞抑制作用的研究 [J]. 中华中医药学刊, 2008, 26(4): 761-762.
[6] Yin J, Heo S I, Wang M H. Antioxidant and antidiabetic activities of extracts fromroots [J]., 2008, 2(4): 247-251.
[7] Kim Y O, Jin S K, Sang W L,. Osteoprotective effect of extract fromvar.in ovariectomized rats [J]., 2015, 23(1): 1-7.
[8] Kawazu K, Nishii Y, Nakajima S. Studies on naturally occurring nematicidal substances. 2. Two nematicidal substances from roots of[J]., 1980, 44(4): 903-906.
[9] 李武, 汪燕, 艾雪峰. 大蓟提取物联合抗生素对分枝杆菌的协同抗菌作用 [J]. 天然产物研究与开发, 2017, 29(12): 2087-2091.
[10] 韩立芬, 宋善敏, 邓伟, 等. 体外评价29种中药的抗结核分枝杆菌活性[J]. 药物化学, 2017, 5(3): 39-44.
[11] Palomino J C, Martin A, Camacho M,. Resazurin microtiter assay plate: Simple and inexpensive method for detection of drug resistance in[J]., 2002, 46(8): 2720-2722.
[12] Caleffi-Ferracioli K R, Maltempe F G, Siqueira V L,. Fast detection of drug interaction inby a checkerboard resazurin method [J].(Edinb), 2013, 93(6): 660-663.
[13] Ternai B, Markham K R, Stanley R,. Carbon-13 NMR studies of flavonoids [J]., 1978, 32(5): 565-569.
[14] Whitfield M G, Soeters H M, Warren R M,. A global perspective on pyrazinamide resistance: Systematic review and meta-analysis [J]., 2015, 10(7): e0133869.
[15] Robinson H J, Siegel H, Pietrowski J J. Toxicity of pyrazinamide [J]., 1954, 70(3): 423-429.
[16] Zhang Y, Mitchison D. The curious characteristics of pyrazinamide: A review [J]., 2003, 7(1): 6-21.
[17] Ng V H, Cox J S, Sousa A O,. Role of KatG catalase-peroxidase in mycobacterial pathogenesis: Countering the phagocyte oxidative burst [J]., 2004, 52(5): 1291-1302.
[18] 杨扬, 郭举. 具有抗肿瘤活性的槲皮素衍生物研究进展 [J]. 中草药, 2018, 49(6): 1468-1475.
[19] Wang S, Yao J, Zhou B,. Bacteriostatic effect of quercetin as an antibiotic alternativeand its antibacterial mechanism[J]., 2018, 81(1): 68-78.
[20] 崔山风. 槲皮素的研究进展 [J]. 西北药学杂志, 2006, 21(6): 279-281.
Component with activity againstfromand its anti-mechanism
WAN Cheng-jie1, ZHANG Chun-jing1, XIE Zong-hui1, YANG Zai-chang1, 2
1. School of Pharmaceutical Science, Guizhou University, Guiyang 550025, China 2. State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550014, China
To isolate the anti-active components from roots of,and preliminarily explore the anti-mechanism.Using bioassay-guided isolation method to isolate active molecules againstfrom roots ofThe checkerboard test was used to study the synergic effects of active ingredients with isoniazid, rifampicin and pyrazinamide. Using molecular docking software to preliminarily explore the affinity between active monomer and KatG. qRT-PCR was used to study the relative transcription ofgene after the active compound interfered with. KatG activity was determined by ultraviolet spectrophotometry. Scanning electron microscope was used to observe the morphology of.Compound HP01 with anti-activity was isolated from roots of,and was identified as quercetin. Quercetin inhibitedwith a MIC value of 160 μg/mL. Quercetin had an additive effect with pyrazinamide, but had no antagonistic effect with isoniazid and rifampicin. Molecular docking showed that quercetin had a strong affinity with KatG. The enzyme activity test showed that quercetin had an inhibitory effect on KatG of. Afterwas treated with quercetin, the transcription ofgene showed a compensatory up-regulation. Scanning electron microscopy showed that quercetin could destroy the cell wall oftuberculosis.The active component ofagainstwas quercetin. Quercetin could killby inhibiting KatG ofand causing structural damage. When designing a new anti-tuberculosis combination regimen, quercetin can be considered.
DC.;; active component; mechanism of action; KatG; quercetin
R285.5
A
0253 - 2670(2021)21 - 6561 - 07
10.7501/j.issn.0253-2670.2021.21.014
2021-05-25
国家自然科学基金资助项目(82060635);国家自然科学基金资助项目(81760629);贵州省社会发展科技攻关项目(SY字[2013]3058号);“国重室开放课题”及“黔科合平台人才”([2017]5101)
万成杰(1994—),男,硕士研究生,研究方向为抗结核分枝杆菌化合物。E-mail: 1536590611@qq.com
杨再昌,男,教授,博士,硕士生导师。Tel: (0851)8308717 E-mail: yangzaichangzm@163.com
[责任编辑 李亚楠]

