氢碘酸还原山梨醇合成2-己烯及碘己烷的机理研究
司亚威,王智超,叶跃元*,张朝霞,王 夺,李水荣,刘运权,郑志锋
(1.厦门大学能源学院,福建省生物质清洁高值化技术工程研究中心,福建 厦门 361102;2.厦门大学化学化工学院,醇醚酯化工清洁生产国家工程实验室,福建 厦门 361005)
自19世纪以来,石油和天然气等不可再生的化石资源一直是生产燃料和化工用品的重要资源[1].但随着化石资源日渐枯竭,环境问题日渐严重,人们急需找到化石资源的替代品[2-4].生物质是世界上存在的唯一的可再生有机碳资源,且生物质在转化利用过程中是碳中性的[5],它的高效利用对于解决世界范围内的能源危机与环境污染具有重要意义.生物质主要由纤维素、半纤维素和木质素组成[6-7],通过转化可以得到糖、有机酸(如己二酸等)[8]、多元醇、醛类化合物等多种平台化合物.生物质基多元醇如山梨醇和木糖醇就是典型的平台分子,均可由纤维素和半纤维素转化生成[9-12];甘油又是生产生物柴油的主要副产物,因此生物质基多元醇来源广泛,使得生物质基多元醇的转化利用研究受到人们越来越多的关注.
氢卤酸(如盐酸)[13]在生物质去官能化制备高附加值化学品中具有广泛应用,氢碘酸是所有氢卤酸中还原性最强的,它经常应用于生物质的还原过程.1938年,Mitchell等[14]提出了一种利用氢碘酸定量羟基的方法,利用过量的氢碘酸与醇反应生成烃类和碘单质,通过定量碘单质来对醇分子上的羟基进行定量.Konieczny等[15]使用氢碘酸还原多环醌类、对二苯酚和苯酚类化合物,使其转化为相应的烃类.Liu等[16]提出使用氢碘酸将含有4~8个碳的内脂和相关的单羟基正烷酸转化为单碘代正烷酸和正烷酸的反应机理为:氢碘酸提供的碘离子首先取代羟基生成碘代烷,然后一分子的氢碘酸再与碘代烷反应生成碘单质和烃.Robinson等[17]使用氢碘酸还原多元醇制备碘代烷烃及C12、C18的高碳烷烃作为生物燃油,并用亚磷酸或次磷酸为还原剂将反应过程中产生的碘单质原位还原成氢碘酸;Lv等[18-19]对上述过程进行了系统研究.Yang等[20-23]采用氢碘酸还原葡萄糖、果糖和纤维素制备5-甲基糠醛和2,5-二甲基四氢呋喃,并在金属催化剂和氢气共同作用下将碘单质原位还原成氢碘酸.
本研究以山梨醇为底物,在氢碘酸、金属催化剂和氢气共同作用下,还原生成碘己烷和少量的己烯.碘己烷是有机合成的重要原料,也是生产医药化学品的重要中间体;而己烯是制备聚合物的重要原料,也可用作溶剂或医药中间体.以生物质基多元醇为原料制备碘己烷和己烯为生物质的高效应用提供了更多的途径,这对于可再生资源的应用具有重要意义.此外本研究以多种模型化合物作为底物,考察其与氢碘酸反应后的产物分布,以推断氢碘酸还原山梨醇合成碘己烷和己烯的可行反应路径,为调控产物组成和提高产率提供一定的理论依据.
1 实验部分
1.1 原料与试剂
山梨醇(98%)、PdCl2(99%)、甘油(99%)、氢碘酸(57%)、2-己醇(98%)、3-己醇(98%)、1,2-己二醇(98%)、1-己烯(99%)、2-己烯(85%)、3-己烯-1-醇(97%)、2-己烯-1-醇(97%)、环己烷(99.9%)、1-碘丙烷(99%)、烯丙基碘(97%)和1,3-二碘丙烷(98%)均购自阿拉丁试剂公司,1,2-丙二醇(99%)、2-碘丙烷(99%)、异丙醇(99%)、1,3-丙二醇(98%)和正丙醇(99.5%)均购自麦克林试剂公司,3-己烯(99%)购自九鼎化学试剂公司,括号中均为质量分数.所有试剂均直接使用,未经过纯化处理.
1.2 实验方法
将一定量的底物、氢碘酸、PdCl2、环己烷加入到包裹聚四氟乙烯内衬的高压反应釜中,关闭反应釜,用1 MPa的氢气换气3次,然后通入一定压力的氢气,开启搅拌并加热反应釜,当温度达到设定温度后开始计时;反应持续一定时间后,取出反应釜放在冷水中降温,待温度降至室温后,打开反应釜,排出气体;反应液分为有机相和水相,有机相经分液并用环己烷多次萃取后定容到25 mL,取1 mL用于气相色谱-质谱(GC-MS)和气相色谱-火焰离子检测(GC-FID),其他有机相经旋转蒸发去除有机溶剂后用于核磁共振(NMR)检测,所得谱图与标准谱图进行对比.
1.3 分析方法
产物的定性分析通过NMR(Bruker AV600)和GC-MS(QP2010SE)进行测定.NMR分析前,通过旋转蒸发去除环己烷,取20 mg样品溶于0.6 mL氘代三氯甲烷(CDCl3)中,放入5 mm核磁管中检测. GC分析条件:使用Rtx-5MS毛细管柱(30 m×0.25 mm×0.25 μm),载气为纯度99.9999%的氦气,载气流量1 mL/min,进样量1 μL,分流比50∶1;烘箱初始温度30 ℃,并保持4 min,然后以10 ℃/min的速度升温至270 ℃,并保持5 min,总耗时为33 min.MS分析条件:使用电子轰击离子源(EI),电子能量70 eV,离子源温度200 ℃,接口温度270 ℃.通过GC-FID(Agilent 7890A)对产物进行定量分析,分析条件:使用聚乙二醇(PEG)毛细管柱(30 m×0.25 mm×0.25 μm),柱箱初始温度40 ℃,并保持2 min,然后以10 ℃/min的速度升温至240 ℃,并保持5 min,总耗时27 min;进样器温度为250 ℃,每次进样1 μL.利用外标法对产物进行定量,产物的产率可由下式计算:
2 结果与讨论
2.1 反应体系的建立
氢碘酸作为还原剂用于还原反应时,在反应过程中会生成碘单质,这不仅会阻碍还原反应的继续进行,而且会造成反应产物的污染导致产物难于分离,因此必需将生成的碘单质原位还原为氢碘酸.Yang等[21]提出了将金属催化剂和氢气共同作用于碘单质原位再生的方法.本研究选用PdCl2作为加氢催化剂,加入环己烷用于萃取有机产物.表1为不同反应体系中氢碘酸还原山梨醇的产物分布.在由氢碘酸、PdCl2、氢气和环己烷共同组成的反应体系下,山梨醇可转化得到4.74%的2-己烯、15.91%的2-碘己烷和23.87%的3-碘己烷,总产率可达44.52%;当反应体系中没有氢气或PdCl2催化剂时,反应结束后有机相和水相都呈深红褐色,无法进行分液操作,通过淀粉试纸检测,反应体系中有大量碘单质生成;当反应体系中不加氢碘酸水溶液,而以10.89 mL的去离子水代替时,反应结束后有机相中无任何产物生成,如表1中序号5实验所示.该结果表明:PdCl2和氢气对山梨醇的转化反应没有影响,只对碘单质的原位再生起作用,而这正符合本研究的预期.当反应前不加环己烷时,2-己烯产率变化不大,而2-碘己烷和3-碘己烷的产率大幅降低,说明提前加入有机萃取溶剂对提高2-碘己烷和3-碘己烷的产率有利,这可能是因为有机溶剂将反应产物聚集到有机相中,促进了烯烃与氢碘酸的反应从而提高总产率.因此,选用由氢碘酸、PdCl2催化剂、环己烷和氢气共同组成的反应体系用于氢碘酸还原山梨醇的反应.
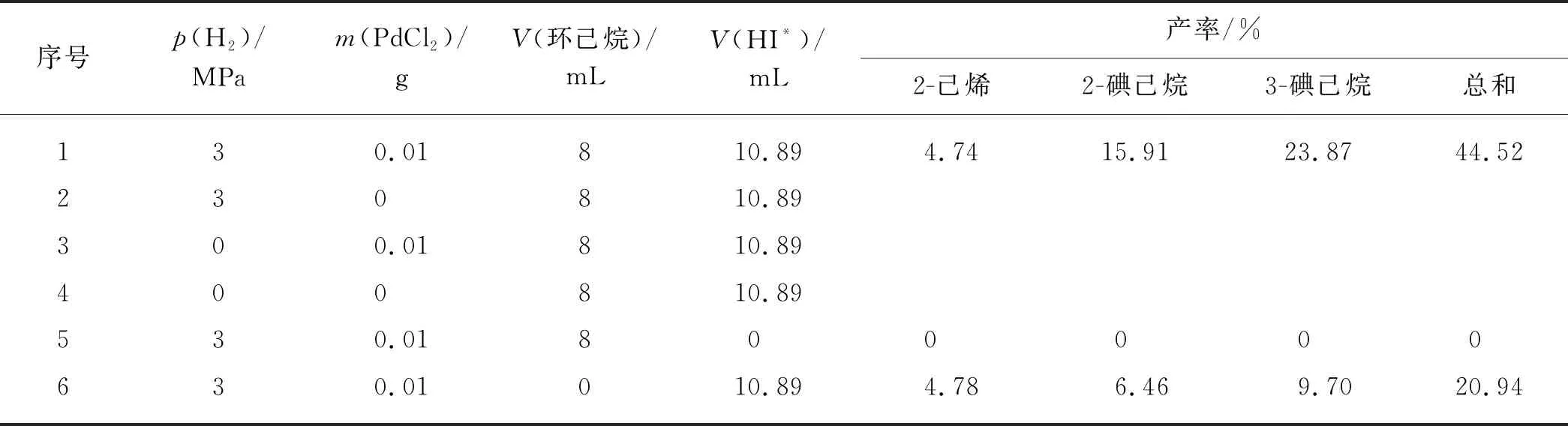
表1 不同反应体系下氢碘酸还原山梨醇的产物分布
2.2 反应参数对产物分布的影响
首先利用单因素试验研究山梨醇在不同条件下被氢碘酸还原合成2-己烯和碘己烷的产物分布,实验结果如表2所示.山梨醇在氢碘酸的作用下可脱去羟基,还原产物为2-碘己烷、3-碘己烷及少量的2-己烯,其中3-碘己烷的产率最高.使用47%(质量分数,下同)的氢碘酸,在温度较低(80 ℃)时,山梨醇在氢碘酸作用下,只有少量的2-己烯生成,无碘己烷生成;而温度过高(170 ℃)时,产物产率降低,说明氢碘酸还原山梨醇需要在一定的温度下才能发生,然而过高的温度并不利于目标反应的进行.当反应温度110 ℃、氢气压力3 MPa、47%氢碘酸(0.06 mmol)反应时间仅为1 h时,2-己烯、2-碘己烷和3-碘己烷的产率分别为8.40%,11.22%和16.84%;当反应时间延长到3 h时,3种产物的产率分别为4.74%,15.91%和23.87%,2-己烯产率降低,而两种碘己烷产率都有一定程度升高;继续延长反应时间到6 h,2-己烯产率继续降低至4.12%,同时2-碘己烷和3-碘己烷产率也稍有降低,说明为保证反应进行完全,一定的反应时间是必要的,但过长的反应时间则不利于产率的升高,3 h的反应时间是较合适的.为将还原过程中产生的碘单质还原成氢碘酸,在反应体系中通入一定压力的氢气,对产物的产率也有一定的影响.与反应时间相似,随着氢气压力的增大两种碘己烷的产率都呈现先升高后降低的趋势,而2-己烯产率则随之不断降低,这是因为随氢气压力的增大,烯烃的分压减小,在液相中更容易转化为碘代烷烃.氢碘酸浓度对产物分布有很大的影响,当氢碘酸的浓度较低(质量分数≤31.33%)时,无任何产物生成,说明较低浓度的氢碘酸不能还原山梨醇;当使用57%的氢碘酸时,两种碘己烷的产率都大幅升高,而2-己烯产率很低,仅为1.03%,说明氢碘酸浓度对氢碘酸还原山梨醇合成碘己烷的影响很大,高浓度的氢碘酸对合成碘己烷有利.增加氢碘酸的用量时,两种碘己烷的产率都有所增加,而2-己烯产率略有降低,总产率增加,因此增加氢碘酸的用量对合成碘己烷也有利.在表2的序号12实验中,反应结束后氢气几乎耗尽,为继续提高产率,适当增大氢气压力,结果显示:当氢气压力增大到4 MPa 时,两种碘己烷的产率都有所升高,且无2-己烯生成.在此基础上继续增加氢碘酸的用量,两种碘己烷的产率继续升高,两者总产率可达93.92%.
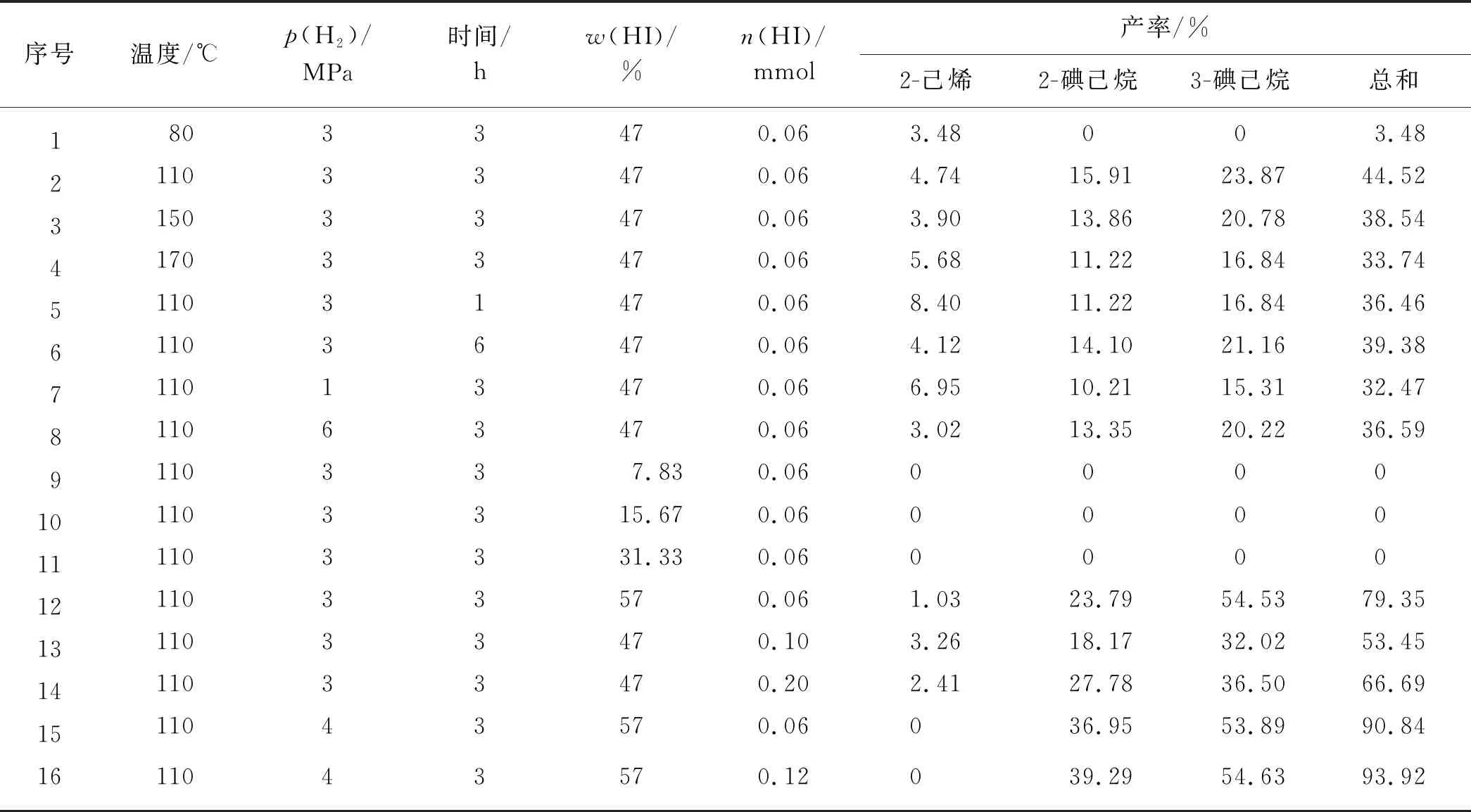
表2 氢碘酸还原山梨醇合成2-己烯与碘己烷的结果
为研究氢碘酸还原山梨醇的反应路径,缩短反应时间以期获得可能涉及的中间产物,结果显示:除反应时间外,其他条件与表2的序号2实验相同,当反应时间缩短到10和30 min时,有机相中的产物类型与反应3 h时一致,这可能是因为反应中涉及的中间产物并不稳定,在氢碘酸的环境中很快转化为最终产物.当反应时间为10 min时,2-己烯、2-碘己烷和3-碘己烷的产率分别为3.79%,5.85%和8.23%;反应时间为30 min时,三者的产率分别为7.74%,8.35%和12.78%.随着反应时间延长,2-己烯产率先增加后减少,而两种碘己烷产率均增加,因此,2-己烯可能是山梨醇转化为碘己烷过程中的中间产物.当以2-己烯为反应底物与氢碘酸反应后,得到22.60%的2-碘己烷、50.12%的3-碘己烷和极少量的己烷,并有6.16%的2-己烯残留.可见两种碘己烷是由氢碘酸与2-己烯发生2位和3位加成反应得到的,极少量己烷的生成可能是由2-己烯在金属催化剂作用下与氢气发生加成反应得到的.
2.3 碳平衡计算
在最佳反应条件下,有机相中2-己烯、2-碘己烷和3-碘己烷的总产率可达93.92%;此外有机相中还存在极少量的C12化合物,含量很低且结构复杂,没有市售的标准品,无法对它们进行定量.收集的气相中,除氢气外未检测到其他有机产物.取2 mL反应后分离出的水相,用1 mol/L的NaOH水溶液中和后再用去离子水定容到50 mL,用于有机碳检测.结果显示,在水相中存在4.7%的有机碳,这些有机碳可能是未反应的山梨醇,也有可能是水溶性中间产物.可检测到的有机碳可达98.62%,其余未检测到的有机碳可能在分离过程中损失,也有一部分是难以被GC-FID检测到的其他产物.
2.4 C3模型化合物的转化

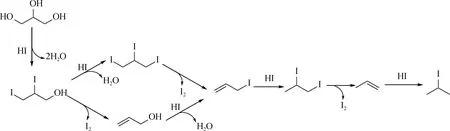
图1 甘油与氢碘酸反应生成2-碘丙烷的反应机理[24]
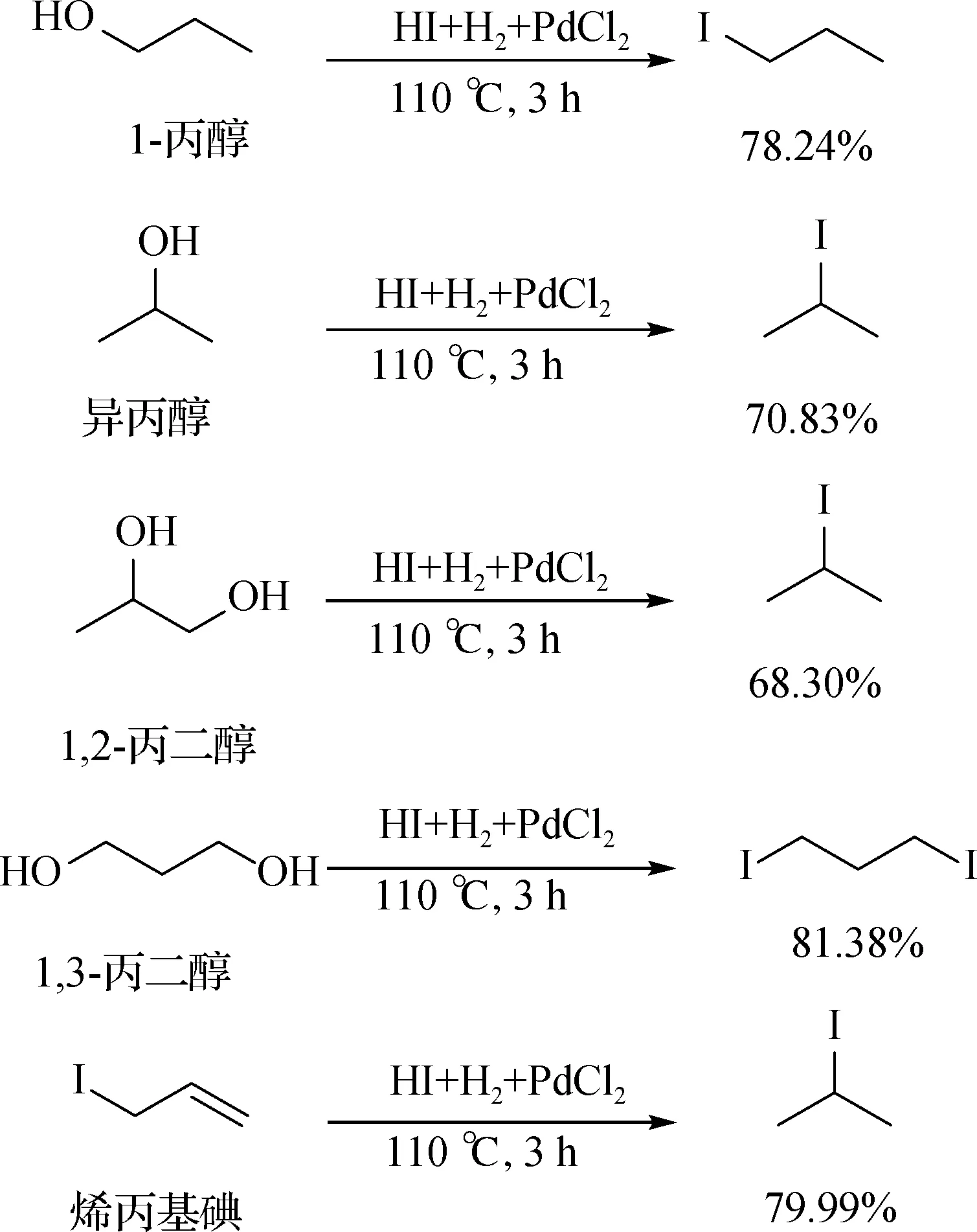
图2 甘油类模型化合物与氢碘酸的反应
2.5 C6模型化合物的转化
与甘油相似,氢碘酸还原山梨醇很有可能也涉及取代、消去和加成反应,为验证此假设,以多种C6模型化合物为反应底物进行实验.首先是一元醇模型化合物实验,结果如图3所示:1-己醇与氢碘酸反应只发生取代反应生成1-碘己烷,2-己醇与氢碘酸反应后得到2-碘己烷和3-碘己烷.这可能是因为2-己醇与氢碘酸反应过程中,不仅发生了取代反应,还发生了消去反应,2-己醇在酸性条件下脱水生成2-己烯,然后2-己烯与氢碘酸发生加成反应生成2-碘己烷和3-碘己烷.反应产物中的2-碘己烷是2-己醇取代和2-己烯加成两种反应的共同产物.3-己醇与氢碘酸反应后也得到了2-碘己烷和3-碘己烷两种产物.与2-己醇一样,反应过程中发生了己醇的消去和己烯的加成反应.醇的消去和取代反应均为单分子一级反应,醇首先被质子化,然后脱去H2O后形成碳正离子.由于碘离子半径较大,与1位碳正离子相比,碘离子与2位和3位碳正离子结合时具有更大的空间位阻,并且2-己醇和3-己醇均为二级醇,所以与1-己醇相比,2-己醇和3-己醇更易发生消去反应生成己烯,己烯加成后生成2-碘己烷和3-碘己烷.

图3 一元醇模型化合物与氢碘酸的反应

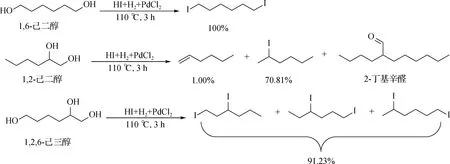
图4 二元醇和三元醇模型化合物与氢碘酸的反应

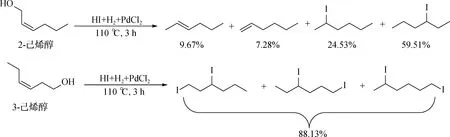
图5 己烯醇类模型化合物与氢碘酸的反应
此外,当以1-碘己烷为反应底物与氢碘酸反应后,有机相中仅检测到1-碘己烷,无2-己烯、2-碘己烷和3-碘己烷生成,因此,在氢碘酸还原山梨醇的过程中2-碘己烷和3-碘己烷的生成并不是通过1-碘己烷异构化完成的.同样地,当以1,6-二碘己烷为反应底物时,反应结束后有机相中仍然只有1,6-二碘己烷,无其他产物生成,这再次说明当两个碘离子处于不相邻碳原子上时无法发生消去反应.根据空间位阻效应,当碘离子攻击羟基时,处于端位的羟基更容易被攻击从而被碘离子取代,实验结果表明:氢碘酸还原山梨醇反应生成己烯和碘己烷是从山梨醇分子的两端开始进行的.
2.6 可能反应路径

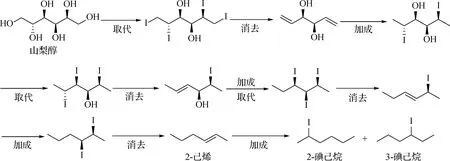
图6 氢碘酸还原山梨醇生成己烯和碘己烷可能的反应机理
当然,由于有些推断的中间化合物目前尚无市售的产品,所以山梨醇的部分反应历程是结合模型化合物反应产物的特点推断的,有待进一步的研究.
3 结 论
山梨醇在氢碘酸作用下可被还原为2-己烯、2-碘己烷和3-碘己烷,且反应温度、时间和氢气压力对产率均有一定的影响,提高氢碘酸浓度对合成碘己烷有利,在最佳条件下3种产物的总产率可达93.92%.通过多种模型化合物实验可得氢碘酸还原山梨醇过程的可能反应路径:反应从两端向中间依次进行,通过多次的取代、消去和加成反应,山梨醇被还原为2-己烯,然后2-己烯与氢碘酸进一步发生加成反应生成2-碘己烷和3-碘己烷.

