CEA、VEGF、nm-23-H1蛋白在乳腺癌患者中的表达及临床意义
黄 波
西安高新医院检验科,陕西西安 710075
乳腺癌是女性常见恶性肿瘤之一,其发病率及病死率较高,在我国乳腺癌患者呈年轻化趋势,且大多数患者在就诊时已发展至中晚期,严重危害妇女身心健康[1]。血清肿瘤标志物可用于乳腺癌的早期诊断,其中癌胚抗原(CEA)是由肿瘤细胞产生的一种蛋白质,当细胞恶变时会产生并分泌CEA,使癌组织中CEA水平升高[2]。血管内皮生长因子(VEGF)则是较强的血管生成因子,在健康人组织中VEGF呈低表达,而在肿瘤患者中其表达异常升高[3]。因此,考虑CEA、VEGF在乳腺癌诊断中有辅助应用价值。nm-23-H1为新发现的一种重要肿瘤转移抑制基因,研究显示其在多种肿瘤中表达异常,并与肿瘤转移潜能存在密切关系[4]。本文主要分析CEA、VEGF、nm-23-H1蛋白在乳腺癌癌组织、癌旁组织、癌旁远端正常组织中的表达差异及其对乳腺癌的诊断价值,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2014年1月至2020年9月在本院行手术切除的乳腺癌患者1 100例,均为女性,符合《中国抗癌协会乳腺癌诊治指南与规范(2013版)》[5]中相关诊断标准。1 100例乳腺癌患者年龄35~65岁,平均(45.10±4.63)岁;浸润性导管癌825例,浸润性小叶癌110例,导管内癌伴浸润性癌104例,导管内癌61例;肿瘤分期:Ⅰ~Ⅱ期510例,Ⅲ~Ⅳ期660例;发生淋巴结转移648例,无淋巴结转移452例。入组患者术前均未行任何放化疗、内分泌治疗,排除妇科、肝脏、肾脏及心血管系统疾病患者和免疫功能缺陷者。取乳腺癌患者组织标本中癌组织、癌旁2 cm组织、癌旁5 cm以外组织(病理检查均确认为正常乳腺组织),分别作为癌组织组、癌旁组、正常组。本研究经医院伦理委员会批准,患者与家属均对本研究知情同意并签署知情同意书。
1.2仪器与试剂 Bench Mark-GX全自动免疫组织化学仪购自Roche公司。CEA酶联免疫吸附试验(ELISA)试剂盒购自美国R&D公司,VEGF多克隆抗体购自Cell Signaling公司,辣根过氧化物酶标记的羊抗兔二抗、SP超敏免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司,nm-23-H1单抗购自Oncogene Science公司,ABC复合物购自DAKO公司。
1.3方法 采用ELISA法进行CEA检测:将血清样品与标准品100 μL加入96孔板,以封板膜封住反应孔,37 ℃孵育90 min,每孔加入250 μL洗涤液,振荡(1次/分)洗板,共4次;然后每孔加入生物素化抗体工作液100 μL,37 ℃孵育60 min,洗板4次后,每孔加入酶结合物工作液100 μL,37 ℃孵育30 min;洗板,加入显色剂,每孔100 μL,避光,37 ℃孵育10~15 min,加入终止液,每孔100 μL,短暂振荡混匀后测定450 nm处吸光度值(A值),计算CEA表达水平。采用免疫组织化学法进行VEGF、nm-23-H1蛋白阳性率检测:以10%甲醛液将组织标本固定24 h,常规石蜡切片脱蜡、水化,应用磷酸盐缓冲液(PBS)冲洗5 min,高温高压抗原修复后,加3% H2O2溶液,室温下孵育10 min,分别滴加VEGF、nm-23-H1抗体工作液,37 ℃孵育1 h,PBS冲洗3次,每次5 min,加生物素标记的二抗,室温下孵育60 min;PBS冲洗3次,每次5 min,加辣根酶标记链酶卵白素,室温下孵育20 min;PBS冲洗3次,每次3 min,加新配制的DAB显色液,于显微镜下观察。然后用自来水冲洗2 min,苏木素复染,采用0.1%盐酸-乙醇分化,以自来水冲洗后,PBS冲洗返蓝,梯度乙醇脱水干燥,然后以中性树脂封片。每张切片随机选取3个高倍视野,将组织细胞显色为棕黄色或褐色定义为阳性。阳性率=阳性例数/总例数×100%。
1.4观察指标 (1)比较3组CEA表达水平及VEGF、nm-23-H1蛋白阳性率;(2)分析CEA表达水平及VEGF阳性率与乳腺癌患者临床参数的关系。(3)采用受试者工作特征(ROC)曲线分析CEA、VEGF、nm-23-H1蛋白对乳腺癌的诊断效能。

2 结 果
2.13组CEA表达水平及VEGF、nm-23-H1蛋白阳性率比较 癌组织组CEA表达水平及VEGF阳性率高于癌旁组、正常组,而nm-23-H1蛋白阳性率低于癌旁组、正常组,癌旁组CEA表达水平及VEGF阳性率高于正常组,而nm-23-H1蛋白阳性率低于正常组,差异均有统计学意义(P<0.05)。见表1及图1。
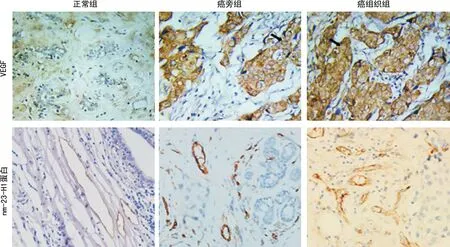
图1 3组VEGF、nm-23-H1蛋白阳性表达情况(×400、×200)

表1 3组CEA、VEGF、nm-23-H1蛋白表达情况比较
2.2CEA表达水平及VEGF、nm-23-H1蛋白阳性率与乳腺癌患者临床参数的关系 在1 100例乳腺癌患者中,随肿瘤分期、肿瘤大小增加及分化程度下降,CEA表达水平、VEGF阳性率升高,而nm-23-H1蛋白阳性率下降,差异有统计学意义(P<0.05);发生肿瘤转移患者的CEA表达水平、VEGF阳性率高于未转移患者,nm-23-H1蛋白阳性率低于未转移患者,差异有统计学意义(P<0.05)。见表2。
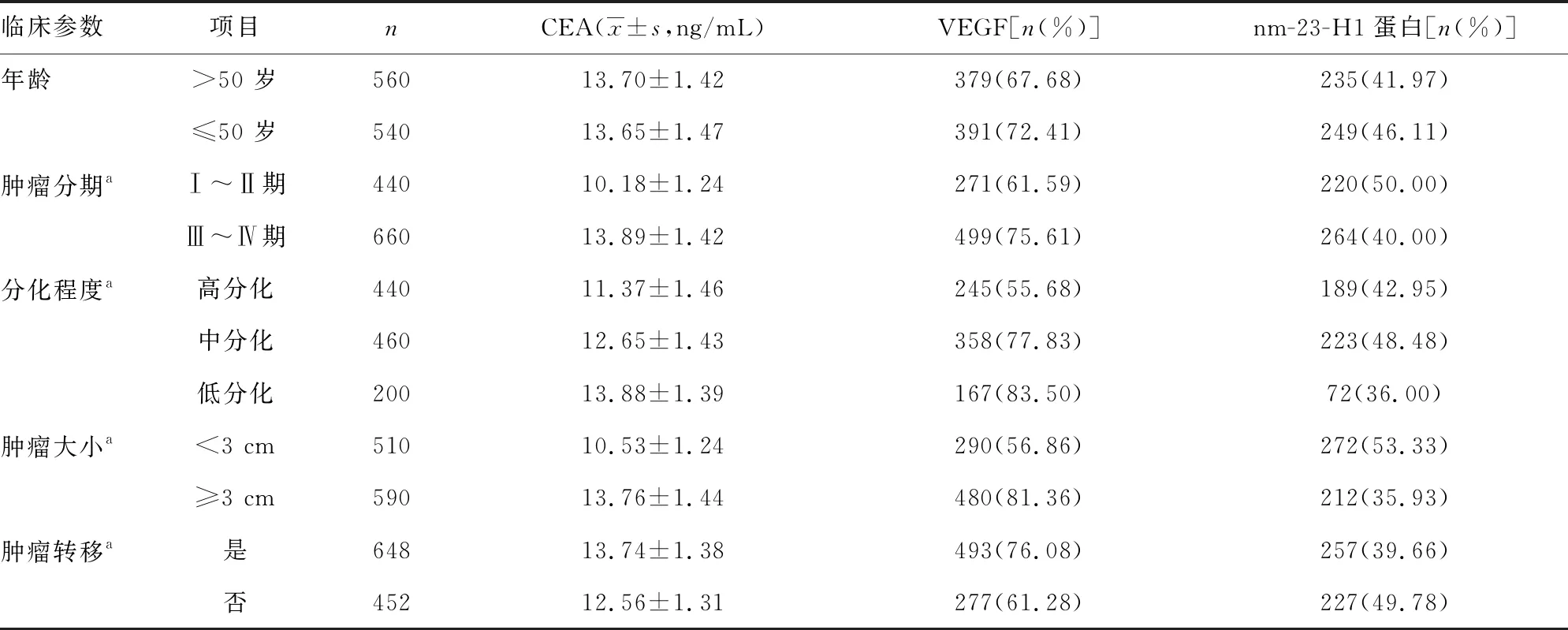
表2 CEA表达水平及VEGF、nm-23-H1蛋白阳性率与乳腺癌患者临床参数的关系
2.3CEA、VEGF、nm-23-H1蛋白对乳腺癌的诊断效能分析 CEA、VEGF、nm-23-H1蛋白联合检测诊断乳腺癌的灵敏度、特异度、准确度分别为0.79、0.88、0.87,均高于单独检测。见表3。
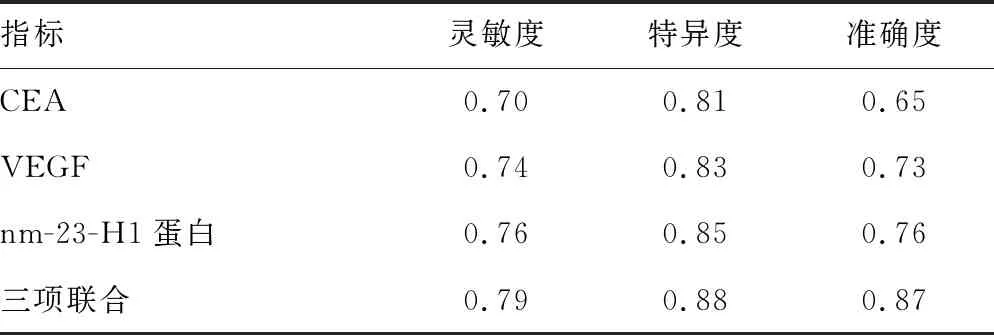
表3 CEA、VEGF、nm-23-H1蛋白对乳腺癌的诊断效能分析
3 讨 论
乳腺癌是一种发生于乳腺上皮组织的恶性肿瘤,在乳腺癌早期患者不具备典型症状与体征,难以引起人们重视,因此大多数患者在确诊时已达晚期,虽然目前临床诊断乳腺癌的肿瘤标志物较多,但单独检测时,其灵敏度较低,漏检率较高。CEA为1965年GOLD及REEDMAN首先从胎儿及结肠组织中发现的,其高水平表达常提示肿瘤患者预后较差及有远处转移,但CEA不是乳腺癌早期诊断的确切指标[6]。VEGF作为血管生成的主要调控因子,在多种肿瘤的发生、发展及转移、复发过程中发挥重要作用[7]。有研究显示,nm-23-H1蛋白可能是急性淋巴细胞白血病患者预后的危险因素[8]。但目前关于CEA、VEGF、nm-23-H1蛋白在乳腺癌中的表达及其临床意义的研究较少。
本研究结果显示,癌组织组CEA表达水平、VEGF阳性率高于癌旁组、正常组,而nm-23-H1蛋白阳性率低于癌旁组、正常组,癌旁组CEA表达水平及VEGF阳性率高于正常组,癌旁组nm-23-H1蛋白阳性率低于正常组,这与刘玉忠等[9]报道的48.2%乳腺癌患者伴有nm-23-H1 mRNA或nm-23-H1蛋白低表达的结果相近。本研究也显示,随肿瘤分期、肿瘤大小增加及分化程度下降,CEA表达水平、VEGF阳性率升高,而nm-23-H1蛋白阳性率下降,且发生肿瘤转移者CEA表达水平、VEGF阳性率高于未转移者,nm-23-H1蛋白阳性率低于未转移者,提示CEA、VEGF、nm-23-H1蛋白在乳腺癌患者癌组织中表达水平与肿瘤分期、分化程度、肿瘤大小、转移有关,其机制可能是肿瘤细胞通过自分泌或旁分泌CEA、VEGF,提高肿瘤细胞向远处组织侵袭、转移的能力,而nm-23-H1蛋白阳性率降低常提示患者预后较差、有远处器官转移。本研究结果还显示,CEA、VEGF、nm-23-H1蛋白联合检测诊断乳腺癌的准确度高于单项检测,提示联合检测可提高对乳腺癌的诊断效能。
综上所述,乳腺癌癌组织中CEA表达水平及VEGF阳性率高于癌旁组织及癌旁正常组织,而nm-23-H1蛋白阳性率低于癌旁组织及癌旁正常组织,且CEA、VEGF、nm-23-H1蛋白与乳腺癌患者肿瘤分期、分化程度、肿瘤大小、肿瘤转移有关,三者联合检测可提高乳腺癌的诊断准确度。