基于感兴趣区的广泛性焦虑障碍功能连接的研究
帅亦斌,沈仲夏,朱建英,章晓梅,蔡敏,任列,沈鑫华
广泛性焦虑障碍(generalized anxiety disorder,GAD)的特征被认为是过度和无法控制的焦虑和担忧,对威胁存在反应过度的情况。该病通常起病于青年时期,在成年人群中约为2%;其终身患病率约为4.7%[1]。迄今为止,关于GAD的影像学研究主要集中在前额叶-边缘脑网络,其中包括的脑区为背外侧前额叶皮质(DLPFC)、腹内侧前额叶皮质(VLPFC)、前扣带回(ACC)、杏仁核、脑岛及颞极等[2]。主要的结论是可能存在一种以前额叶和杏仁核为核心脑网络的自上而下的对焦虑情绪失调的病理机制,直接从脑影像学上的异常这一视角来理解GAD患者行为症状学的表现;但这些结果缺乏一致性。目前在静息态功能磁共振(rs-fMRI)研究中反复验证及丰富这一研究结论的方法主要是基于感应区(ROI)的功能连接(FC)。本研究基于我们团队先前关于GAD脑灰质体积的研究结论,以右侧眶部额下回及左侧颞中回为ROI做全脑FC分析[3],假设GAD患者脑灰质结构改变的脑区同样存在FC异常,并与临床症状做关联分析,进一步探究GAD的病理基础。
1 对象和方法
1.1 对象 病例组:选择2015年6月至2017年6月在我院心身科门诊和住院患者。纳入标准:①符合美国《精神障碍诊断与统计手册》第5版(DSM-5)GAD诊断标准;②未接受治疗或至少停药≥4周;③年龄18~50岁;④汉族,右利手;⑤受教育年限≥9年;⑥汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)总分≥18分,汉密尔顿抑郁量表17项(17-item Hamilton depression scale,HAMD-17)总分≤12分;⑦自愿参加,签署知情同意书。
选择2016年6月至12月社区招募的健康人群38名作为对照组。纳入标准:①性别、年龄及受教育程度与研究组匹配的健康人群;②汉族,右利手;③HAMA总分<7分,HAMD-17总分<7分。两组均排除严重自杀倾向、其他精神障碍共病、严重躯体疾病、不能配合者。本研究经我院伦理委员会批准,所有研究对象均签署书面知情同意书。
1.2 方法
1.2.1 研究方法 收集入组者一般情况,如年龄、性别、受教育程度、总病程(月)等。使用HAMA、HAMD-17评估焦虑、抑郁症状严重程度。
1.2.2 磁共振数据采集 对病例组治疗前及对照组进行MRI扫描,均在我院放射科Signa HDxt MRI1.5 T磁共振扫描仪上完成。扫描参数:3DT1矩阵=250×250,视野(FOV)=250 mm×250 mm,层厚3.12 mm,层间距0 mm,翻转角90°,激发次数=1,连续扫描128层,扫描时常4 min 4 s。扫描过程中要求保持放松,并用泡沫板填塞头部减少头动;扫描过程尽量保持睁眼,不能长时间闭眼。扫描均由同一名操作熟练的放射科医生进行。
1.2.3 磁共振数据预处理 rs-fMRI数据的预处理采用:MATLAB2013b平台下基于使用DEPASF (http://rfmri.org/DPARSF_V2.3)及REST(http://www.restfmri.net/forum/REST_V1.8)处理BOLD及T1数据。
预处理步骤简述如下:①去除前10个时间点;②时间层校正;③头动校正;④图像配准;⑤空间标准化,先将每个人的功能像匹配到其结构像中,再进行标准化;⑥空间平滑;⑦对平滑后滤波数据,去线性漂移,提取并去除协变量(头动参数、全脑信号、白质信号、脑脊液信号);⑧根据先前的研究结果,选取右侧眶部额下回及左侧颞中回为ROI(分别定义为ROI1及ROI2),并分别以在标准MNI空间坐标(51,21,-6)和(-66,-36,-27)为中心做直径为6 mm的球体感兴趣区域[3],并对去除协变量后数据提取种子区的平均时间序列,计算种子脑区同全脑各体素的线性相关系数,再进行Fisher-Z变换;⑨头动校正,剔除头动在任意方向>2 mm或旋转角度>2°。所有指标使用DEPASF及REST软件包进行计算。
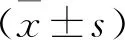
2 结果
2.1 两组一般情况比较 使用简明国际神经精神访谈(中文版)工具筛查患者220例,最终纳入研究48例。病例组剔除头动过大、空间标准化较差以及年龄过大者10例,共纳入研究38例,男9例,女29例;平均年龄(41.8±11.0)岁;平均受教育年限(12.1±4.4)年;病程中位数28个月;HAMA(21.9±3.4)分;HAMD-17(10.1±3.7)分;按同样标准对照组剔除8名,共纳入分析30名,男10名,女20名;平均年龄(40.0±5.3)岁;平均受教育年限(13.5±4.6)年。两组性别、年龄、受教育程度等差异无统计学意义(P均>0.05)。
2.2 两组FC比较
2.2.1 病例组种子点ROI1与全脑体素FC同对照组比较 与对照组相比,病例组种子点ROI1与右侧颞中回、右侧内侧额上回、左侧楔前叶、左侧角回及左侧额中回的FC减少,而与左侧颞上回的FC增加(k≥24,P<0.001,AlphaSim校正)。见表1,见图1。
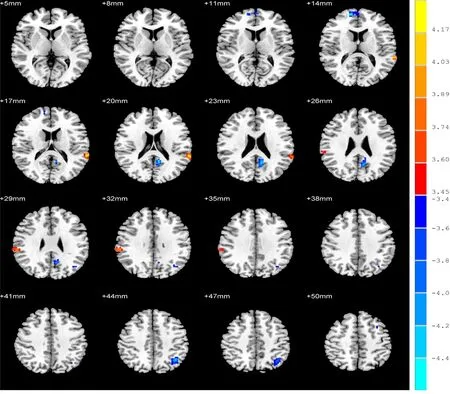
图1 病例组与对照组基于种子点ROI1的全脑体素FC差异的脑区图
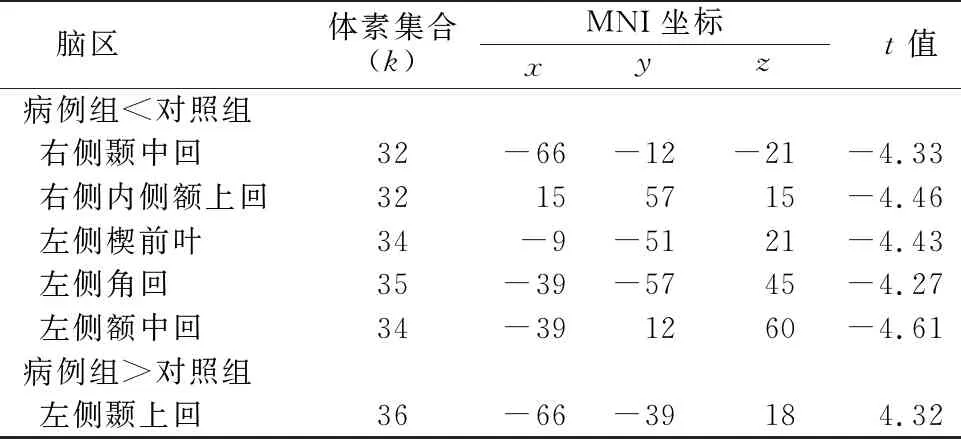
表1 两组基于种子点ROI1的全脑体素FC差异的脑区
2.2.2 病例组种子点ROI2与全脑体素FC同对照组比较 与对照组相比,病例组种子点ROI2与右侧舌回FC减少,而与左侧楔前叶的FC增加(k≥24,P<0.001,AlphaSim校正)。见表2,见图2。
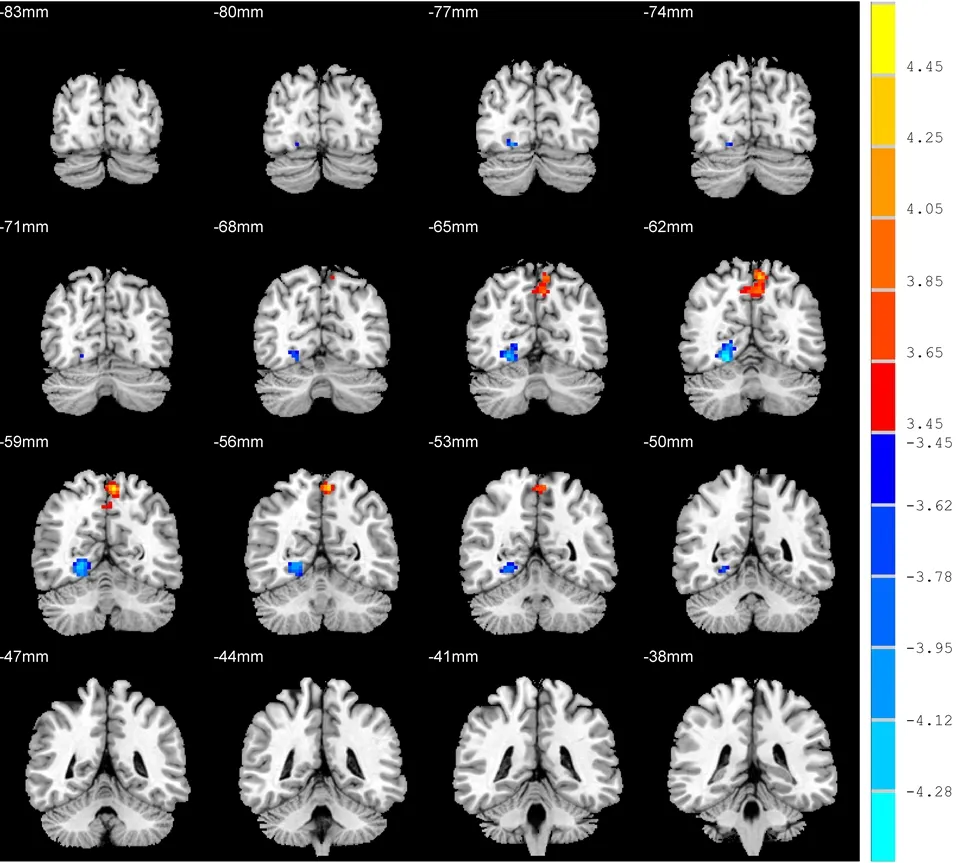
图2 病例组与对照组基于种子点ROI2的全脑体素FC差异的脑区图

表2 病例组与对照组基于种子点ROI2的全脑体素FC差异的脑区
2.3 病例组全脑FC与HAMA评分的相关性分析
2.3.1 病例组种子点ROI1与全脑体素FC强度与HAMA评分的相关性分析 统计结果未能通过多重比较矫正,表明病例组ROI1与全脑体素FC强度与HAMA评分无相关(k≥24,P<0.001,AlphaSim校正)。
2.3.2 病例组种子点ROI2与全脑体素FC强度与HAMA评分的相关性分析 病例组ROI2脑区与全脑体素的FC强度与HAMA评分存在正相关,分别是右侧缘上回(r=0.58)、右侧顶下小叶(r=0.59)及右侧额上回(r=0.66);表明病例组症状越重,其种子点ROI2同以上脑区的FC越强(k≥24,P<0.001,AlphaSim校正)。
3 讨论
目前关于焦虑情绪的脑网络节点大部分都集中在杏仁核及额叶皮质区域。基于本团队先前的GAD患者脑灰质体积研究结果,选择以眶额叶皮质及颞中回为ROI[3],进行全脑体素的FC分析。既往研究发现外侧眶额叶皮质一般参与情感评估和调节[4],额叶与控制功能相关。与低焦虑状态组相比,高焦虑状态组在面对威胁相关的刺激时,前额叶控制功能表现较弱[5]。而颞叶融合多种社会知觉参与介导认知[6]。有研究发现颞叶的功能还与语言的表达和记忆相关[7],任务态fMRI相关研究在处理面部情绪识别任务时,GAD患者的颞叶和顶叶皮质比健康对照组表现更为活跃[8]。这表明GAD患者存在情绪工作记忆能力方面的不足。
Menon[9]提出了“三重网络模型”理论,认为默认模式网络(DMN)、中央执行网络(CEN)、显著网络(SN)的FC异常与GAD及抑郁症等多种精神疾病密切相关。DMN主要由内侧前额叶皮质、顶下小叶和后扣带皮质/楔前叶组成,此外,颞叶皮质和海马结构也与此网络密切相关[10]。CEN又称执行控制网络,主要由DLPFC、背侧前扣带皮质、后顶叶皮质和额叶眼区组成,在工作记忆、解决问题、目标导向行为和决策过程中起作用。SN由岛叶皮质、背前扣带皮质、颞极和杏仁核组成,负责检测和过滤刺激,并招募相关功能网络[11],完成各种复杂的功能,包括沟通、社会行为和自我意识。本研究结果显示,与对照组比较,GAD患者右侧眶部额下回与右侧颞中回、右侧内侧额上回、左侧楔前叶、左侧角回及左侧额中回的FC减少,而与左侧颞上回的FC增加;左侧颞中回与右侧舌回FC减少,而与左侧楔前叶的FC增加。这些结果涉及以上三重网络模型,提示GAD患者的DMN网络内部FC异常,同样也与CEN和SN网络之间存在FC异常;这与以往的研究结果一致[12]。某种程度上可以解释GAD患者一些行为症状特点。先前已有研究表明角回与DMN网络节点之间的FC参与工作记忆任务,并可能参与全脑信息的整合[12],舌回属于视觉识别网络(视觉识别网络包括楔叶、舌回、梭状回和枕外侧皮质)[13];与本研究结果一致。视觉识别网络涉及到情绪面部处理,这对社会功能至关重要。由此来看,这些FC异常可能与GAD患者的负性情绪偏倚相关。
本研究发现关于GAD患者左侧眶额叶皮质区域同全脑体素FC与焦虑的症状严重程度未发现相关性,一方面可能提示额叶皮质网络的高度复杂性,另一方面也不排除眶额叶皮质在GAD群体中可能并非情绪调节的关键节点。另外还发现左侧颞中回同右侧缘上回、右侧顶下小叶及右侧额上回的FC强度与HAMA评分呈正相关,表明以上脑区的FC异常与焦虑症状的严重程度相关。既往研究发现左侧颞中回涉及许多功能,例如语言处理、运动观察、演绎推理以及动态面部表情等[14-15]。rs-fMRI关于GAD的相关研究也发现左侧颞中回的局部一致性(ReHo)值与HAMA评分存在正相关[16]。关于缘上回的功能,既往研究表明其参与整合多个感官信号,克服情感的自我中心性及处理交际意图[17]。而顶下小叶与自上而下的注意力和认知控制相关[18],之前的研究发现青少年GAD患者顶下小叶与其他脑网络的FC强度降低[19],这似乎与本研究结果不一致。由于顶下小叶与额叶同属DMN区域,颞叶同这些区域的FC增强可能反映了GAD患者的一种代偿激活方式。
综上所述,本研究在GAD患者脑灰质体积形态学改变的基础上进行基于ROI的FC分析。同对照组相比,基于种子点的FC异常,其相关区域包含在DMN、CEN及SN等脑网络中,提示GAD患者可能存在多重功能网络失调。而颞中回同缘上回、顶下小叶及额上回的FC强度与临床症状呈正相关。
本研究的局限性:研究方法缺乏创新性;未能对后期疗效做相关分析,并比较痊愈组与非痊愈组的差异;数据质量有待提高,经预处理后排除的样本较多;硬件设备较差,仍采用1.5 T MRI,对细小结果分辨率低,这种先天局限性也导致无法对与GAD密切相关的脑区进行研究,如杏仁核、尾状体床核;统计不够严谨,采用AlphaSim校正,可能存在假阳性结果可能。
今后研究方向:学习更为先进的研究方法;进一步分析治疗效果与GAD脑功能连接异常的相关性,寻找预示疗效的生物标记物;与影像科室密切配合,确保数据采集过程更加规范;与其他综合医院合作解决医院设备问题;采用更为严谨的多重比较方法。

