1例13号染色体复杂嵌合型结构畸变的细胞遗传学分析
李显筝 许玲 蔡婵慧 胡晶晶
(广东省妇幼保健院医学遗传中心,广东 广州 511442)
绒毛染色体核型分析是孕早期常见的产前诊断方法之一。相对于羊水染色体核型分析,绒毛核型分析更容易出现嵌合体,而这些嵌合体有些是真性嵌合,有些是假性嵌合,如何鉴别和预测这些嵌合体对胎儿的风险,是产前诊断中的一大难题[1]。目前,临床上绒毛嵌合体多数为非整倍体数目异常嵌合,染色体结构重排畸变嵌合比较少见(79.3%vs 20.7%)[2]。本文将探讨1例13号染色体复杂结构畸变的嵌合体病例,并深入探讨其可能发生的机制。
1 对象与方法
1.1 对象 孕妇,43岁,2019年3月27日来本院就诊。末次月经为2018年12月19日,于2018年12月23日通过体外受精-胚胎移植(in vitro fertilization/intracytoplasmic sperm injection-embryo transfer,IVF/ICSI-ET)手段植入2枚冷冻胚胎,早期超声提示存活1枚。2009年顺产一女,现体健,平素月经规则,无特殊,夫妻双方外周血染色体核型均正常。孕12+周左右,超声提示宫腔内单活胎,胎儿颈项透明层厚度(nuchal translucency,NT)4.7mm。就诊完善相关检查,孕妇及家属签署知情同意书,于孕14+周,经腹B超行绒毛膜穿刺术,同时送检绒毛染色体核型分析及染色体微阵列分析(chromosomal microarray analysis,CMA)检测。因绒毛染色体结果提示嵌合体,孕妇于孕18+周,经腹B超行羊膜腔穿刺术,再次送检羊水核型分析及CMA检测。
1.2 方法
1.2.1 绒毛染色体核型分析孕11~15周孕妇在B超介导下经腹穿刺绒毛20~30mg,用无菌生理盐水清洗干净后,送至无菌培养室,于解剖显微镜下挑选出绒毛组织,经无菌手术刀剁碎和酶消化后,接种到3个培养瓶中,培养观察,1瓶进行原位收获、制片,1瓶传代、收获和制片,另1瓶留作备份继续培养,于显微镜下分析计数核型,若出现嵌合现象时加大计数量并对备份培养瓶中的细胞进行传代、收获和制片,加数尽量多的核型进行分析。
1.2.2 羊水染色体核型分析本中心采用原位羊水细胞培养法,孕妇于孕18~24周在B超介导下经腹穿刺羊水30ml,双人双线操作,接种2个培养瓶和2个培养皿,常规羊水培养,将2个培养瓶进行原位收获和制片,显微镜下计数15个细胞克隆,分析5个核型,若出现嵌合现象时加大计数量并对2个备份培养皿中的细胞进行传代、收获和制片,加数尽量多的核型进行分析。
1.2.3 CMA检测签署知情同意书后,采集孕妇绒毛或羊水。使用Agilent公司生产的8×60K芯片进行全基因组范围的不平衡现象检测。整个过程严格按照标准化操作进行,包括DNA的提取、酶切、连接、PCR、纯化、片段化、标记、杂交、扫描和分析。最终以正常男性DNA作为对照标准,利用Ch AS软件进行分析。
2 结果
2.1 经腹超声结果经腹部超声扫查提示:子宫增大,宫腔内见一胎儿回声,头臀径63mm,可见胎心搏动,胎儿NT4.7mm,胎盘位于子宫前壁,厚16mm,胎盘成熟度0度,羊水暗区31mm,子宫宫底壁见1个低回声团,大小约23mm×12mm,边界清,内部回声分布均匀,图1。
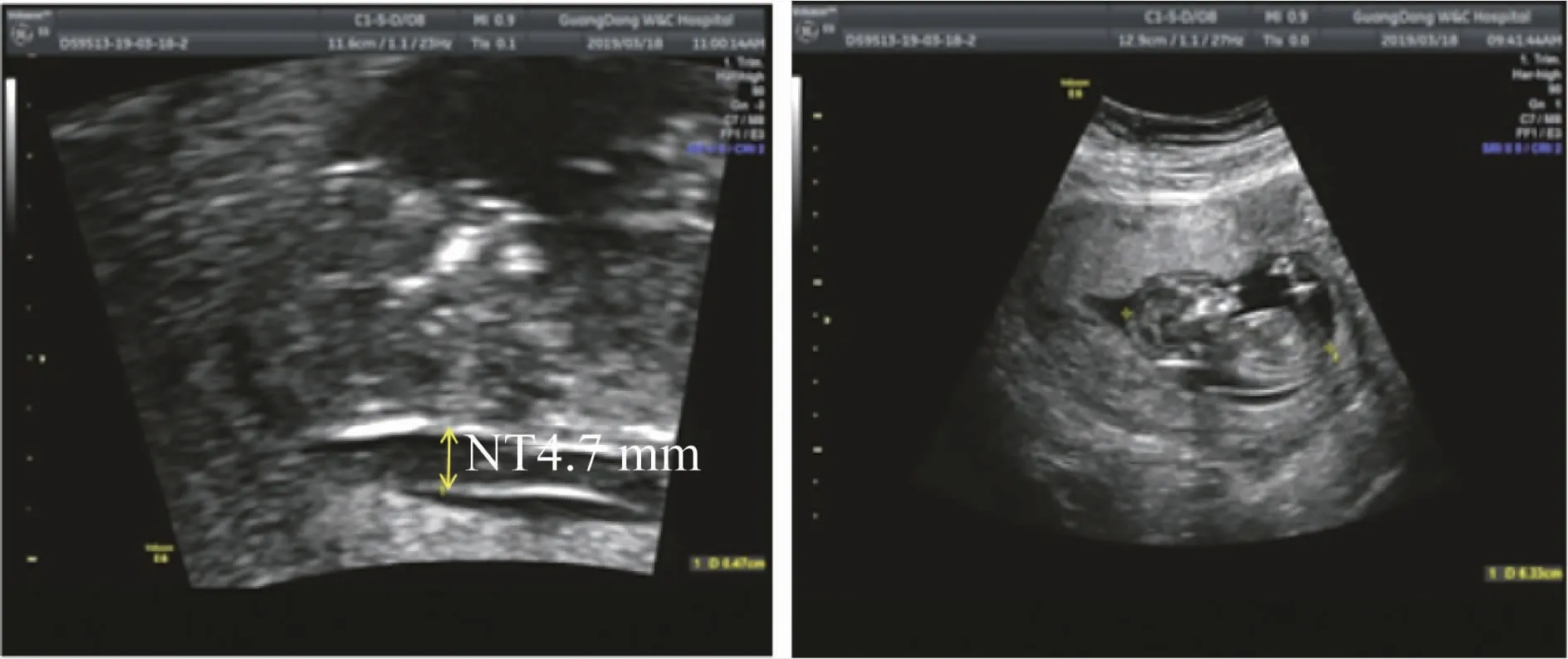
图1 超声结果:NT4.7mm
2.2 染色体G显带核型结果绒毛染色体核型分析共发现3种异常核型:①46,XX,del(13)(q22);②46,XX,-13,+mar;③46,XX,add(13)(q22),均涉及13号染色体,嵌合比例分别为50%、30%和20%,图2A-C,羊水染色体核型分析结果为46,XX,del(13)(q31.1),胎儿仅存在一种异常核型,图2D。

图2 染色体核型结果
2.3 染色体微阵列检测结果绒毛染色体微阵列结果提示:arr[hg19]10q22.1q26.3(70,857,961-135,426,386)x2-3,13q22.1q34(74,346,851-115,107,733)x1-2,发现胎儿存在两种基因拷贝数的变化:①10号染色体10q22.1-q26.3位置发生嵌合重复(比例约23%),片段大小约64.6Mb,包含616个基因;②13号染色体13q22.1-q34位置发生嵌合缺失(比例约40%),片段大小约40.7Mb,涉及251个基因,图3A。
羊水染色体微阵列结果提示:arr[hg19]13q31.1q34(84,336,388-115,107,733)x1,发现胎儿13号染色体13q31.1-qter位置发生缺失,片段大小约40.7Mb,涉及251个基因,其中97个为OMIM基因,图3B。
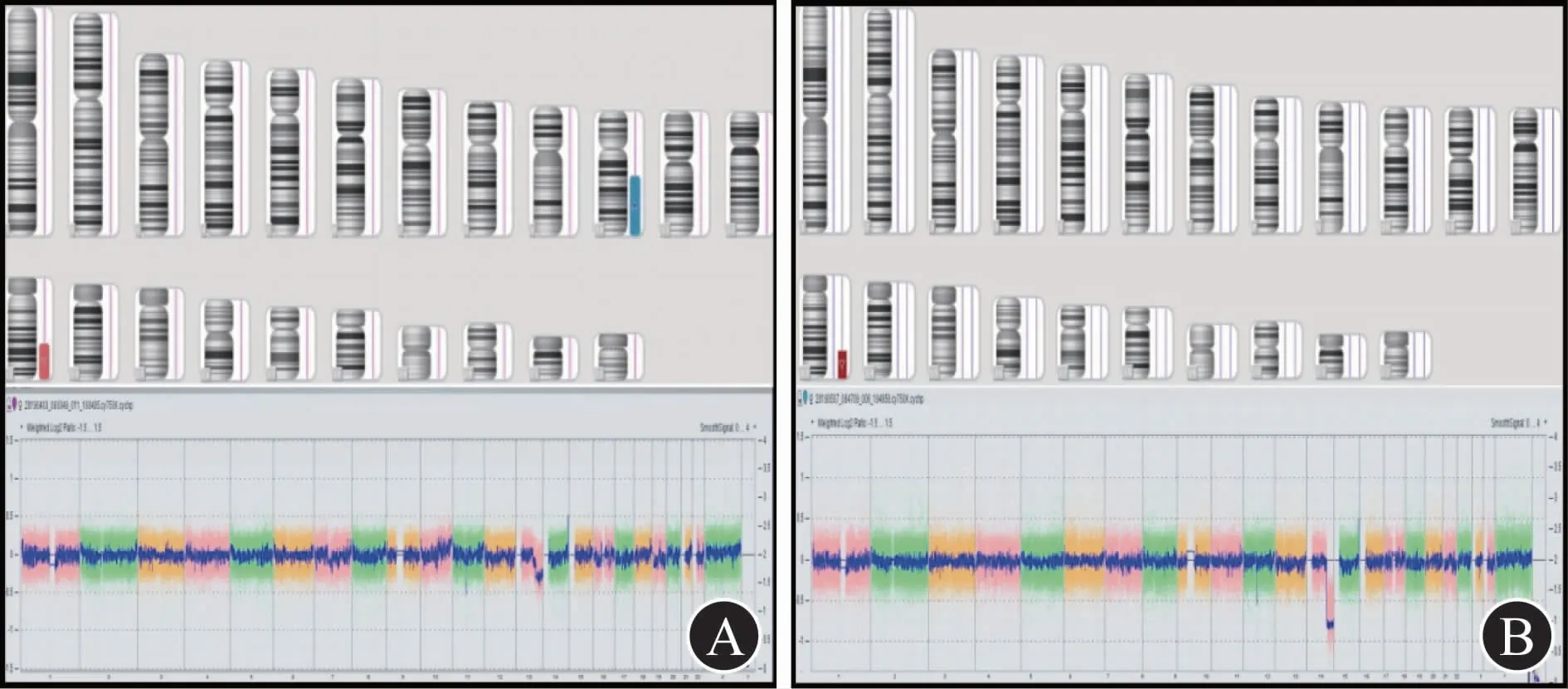
图3 染色体微阵列结果
3 讨论
绒毛是胚胎和母体进行物质交换的重要组成部分[3]。绒毛染色体核型G显带分析技术在临床中具有早发现、早干预、降低孕妇心理及身体创伤等优点,但其技术手段仍存在一定的弊端[4]。众所周知,胎盘由羊膜、叶状绒毛膜和底蜕膜构成,羊膜和叶状绒毛膜构成胎盘的胎儿部分,叶状绒毛膜是绒毛穿刺的目标物[5];底蜕膜构成胎盘的母体部分,绒毛穿刺时不慎抽到底蜕膜是造成母体组织污染的主要原因[6]。同时,由于绒毛取材过程中易污染、取材难度大、绒毛量多少不同、孕周不同、培养时间长短等因素,对最终绒毛染色体结果都会造成不同程度的影响[7]。
绒毛检查所取标本主要为滋养细胞及绒毛间质细胞,虽然与胎儿来源于同一个受精卵,属于胎盘的一部分,但其并非真正的胎儿组织。在胚胎发育至64个细胞胚泡阶段,4个细胞发育成胎儿,12个细胞发育成胚外中胚层,其余48个细胞发育成滋养层,在胚胎发育早期,理论上非胎儿结构比胎儿更容易发生有丝分裂错误[8]。一般情况下绒毛核型能代表胎儿核型,但也可能由于母体组织污染或者限制性胎盘嵌合体(CPM)的存在,不能真实反映胎儿情况。当绒毛染色体嵌合现象发生时,应首先鉴别胎儿真性嵌合的可能性。如果在胚胎时期,细胞融合或分裂错误形成嵌合体,一般是真性嵌合体[9]。所以,准确分析判断绒毛染色体嵌合体的真假性,排除CPM的可能,对胎儿及妊娠结局的影响是非常重要的。
在孕早期绒毛活检中,CPM的发生率大约在1%~2%[10]。当发生CPM时,绒毛核型与胎儿核型结果可能出现不一致,出现绒毛嵌合现象。目前,CPM根据发生机制,可分为减数分裂型以及有丝分裂型:减数分裂型指受精卵染色体异常,在之后的分裂中,由于“错误”导致囊胚内细胞团中形成胚胎的细胞丢失异常染色体,而其余异常细胞被“驱赶”至滋养细胞层,这个过程被称为“胎儿自救”(fetal rescue);有丝分裂型指受精卵染色体正常,异常分裂发生在胎盘细胞的前体中[11]。对于绒毛染色体发现异常核型嵌合现象时,不能盲目认定胎儿染色体存在异常,需进一步复查羊水,但即使后续羊水诊断核型结果正常,胎儿仍可能存在低水平的嵌合,并且有1/3的机会是单亲二体(uniparental disomy,UPD),对于某些可能存在印记基因的染色体,例如5、6、7、9、11、14、15、16号染色体,诊断CPM的同时还要除外UPD的存在[5]。
本病例绒毛核型与CMA结果均提示13号染色体存在异常。由于CMA的结果提示10号染色体存在嵌合重复,且重复片段断裂位点位于10q22,结合第三种异常核型,与10号染色体带纹进行比对,我们认定第三种异常核型中的未知13号染色体为一条衍生染色体,其未知附加片段来源为10号染色体的部分三体,同时伴随13号q22位置至末端的部分单体,其核型描述修正为:46,XX,der(13)t(10;13)(q22;q22)。CMA提示10号染色体嵌合重复的比例为23%,而13号染色体嵌合缺失的比例为40%,除了10号与13号染色体易位重排的衍生染色体外,还存在13号q22至末端缺失的情况,即第一种异常核型46,XX,del(13)(q22)。由于核型分析与CMA技术均存在局限性,不能排除绒毛CPM的存在,同时CMA技术对低比例的嵌合不能准确检出,所以第二种异常核型仍不能确认其来源及异常类型,需进一步复查羊水。经检测,羊水染色体核型分析以及CMA结果均提示胎儿为纯合状态的13号染色体q31至末端的缺失,“13p缺失综合征”主要临床表现为严重的智力障碍、特殊面容、中枢神经系统异常、肌张力低下等,孕妇及家属选择终止妊娠。
该病例绒毛与羊水检测出现了不同的结果,经分析发现,绒毛核型与绒毛CMA结果基本一致,羊水核型与羊水CMA结果一致,从而排除由于细胞体外培养、收获等操作造成的假性嵌合现象,可以确定该病例CPM的存在,推测13号染色体的畸变细胞异常分裂可能发生在减数分裂期,由于胎儿复杂的自救过程,导致胎盘存在三种不同形式的异常核型的嵌合,而胎儿由一种异常核型发育而来。遗憾的是本病例外院引产,未能留取胎盘组织进一步印证。
综上所述,绒毛核型分析的嵌合现象仍然是产前诊断和咨询中的难点。虽然CPM的发生率较低,当绒毛核型分析发现嵌合体时仍应充分考虑CPM的可能性,复查羊水或脐带血进一步确诊。临床上应重视CPM的存在,加强对CPM的遗传咨询。对于存在CPM且胎儿核型正常的妊娠,孕期应加强对胎儿生长发育的监测,分娩时留取胎盘多点取材,分别检测染色体核型进一步印证。

