水溶性烯丙孕素-磺丁基-β-环糊精包合物的制备及表征
杨玉帅,李 泽,金天明,杨 升
(天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300384)
烯丙孕素又名四烯雌酮(altrenogest,ALT),是一种人工合成的脂溶性甾体类孕激素[1-2],化学性质不稳定,它与黄体酮、乙炔诺酮和氟孕酮等的作用相似,可单独使用或与促性腺激素联合使用[3-4],均能抑制促性腺激素的释放,抑制卵泡的生长发育和成熟[5-6],作为同期发情的药物,用药结束后,母猪、母马等动物可同期发情和排卵[7,8],有利于养殖场批次化和规模化的进行人工授精和管理[9-11]。又由于烯丙孕素原药不溶于水,进入动物体内不能很好得吸收利用,导致其生物利用度大大降低,不能很好地达到生产预期,也造成了药物的浪费[11]。如今,市场上的烯丙孕素应用剂型以口服液为主[12-17],因为其药效时间短且经口服给药后易产生首过效应,进而导致其有效浓度降低,不能很好的达到预期效果,且需要数日连续饲喂,连用18 d。该口服制剂需与饲料混合食用,在一定程度上很难保证用药剂量的准确性,且该口服剂型的溶剂为有机植物油,适口性差,不易被动物接受,使用起来较为麻烦。
磺丁基-β-环糊精(SBE-β-CD)是对β-环糊精进行修饰后得到的β-环糊精衍生物,具有很好的水溶性,可与一些难溶性药物进行包合,被包合的水难溶性药物进入β-环糊精衍生物的空腔后,可有效提高原有药物的稳定性,增加其水溶性[18-20],还具有一定的药物缓释作用[21],对碱、热和光稳定,且本身无毒,安全性高[22]。
因此,通过使用SBE-β-CD对水难溶性药物烯丙孕素进行包合,来提高烯丙孕素的溶解度;并对包合物进行了表征分析和相关性质的考察以及溶解度的测定,得到的包合物载药体系可满足多种剂型的要求,配制出不同的临床使用剂型,为烯丙孕素的新药开发以及临床应用研究提供依据。
1 材料与方法
1.1 试验材料及仪器
烯丙孕素(含量99%,宁波三生药业有限公司)、磺丁基-β-环糊精(上海旭硕生物科技有限公司)、氢氧化钠(天津市风船化学试剂科技有限公司)、无水乙醇(天津市百世化工有限公司)、去离子水和试剂均为分析纯。
DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)、HS-1DN磁力搅拌器[MAGNETIC STIRRER 株式会社(中国制造)]、电子分析天平(Mettler Toledo Newclassic MF MS204S Switzerland)、FTIR傅里叶红外光谱仪(lambda scientific 天津港东科技发展股份有限公司)、TG209F3热重分析仪(德国耐驰公司)、T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司)、Coolsafe 100-9 pro真空冷冻干燥机(丹麦 Labogene)、-80 ℃超低温冰箱(Panasonic 冰山松洋生物科技(大连)有限公司)、Echo Revolve正置倒置一体荧光显微镜(美国Echo公司)。
1.2 方法
1.2.1 烯丙孕素标准曲线建立 精密称取ALT原药12.5 mg于50 mL棕色容量瓶中,用适量的50%乙醇溶液摇晃溶解并定容至刻度,配制成浓度为0.25 mg·mL-1的标准溶液;取上述溶液稀释,配制成浓度为1、2、4、6、8、12 μg·mL-1的工作液,依照紫外分光光度法,在352 nm波长处测定其吸光度,以工作液中ALT的浓度(μg·mL-1)为横坐标,吸光度A为纵坐标,根据不同浓度ALT标准溶液的吸光度A,绘制标准曲线图1。
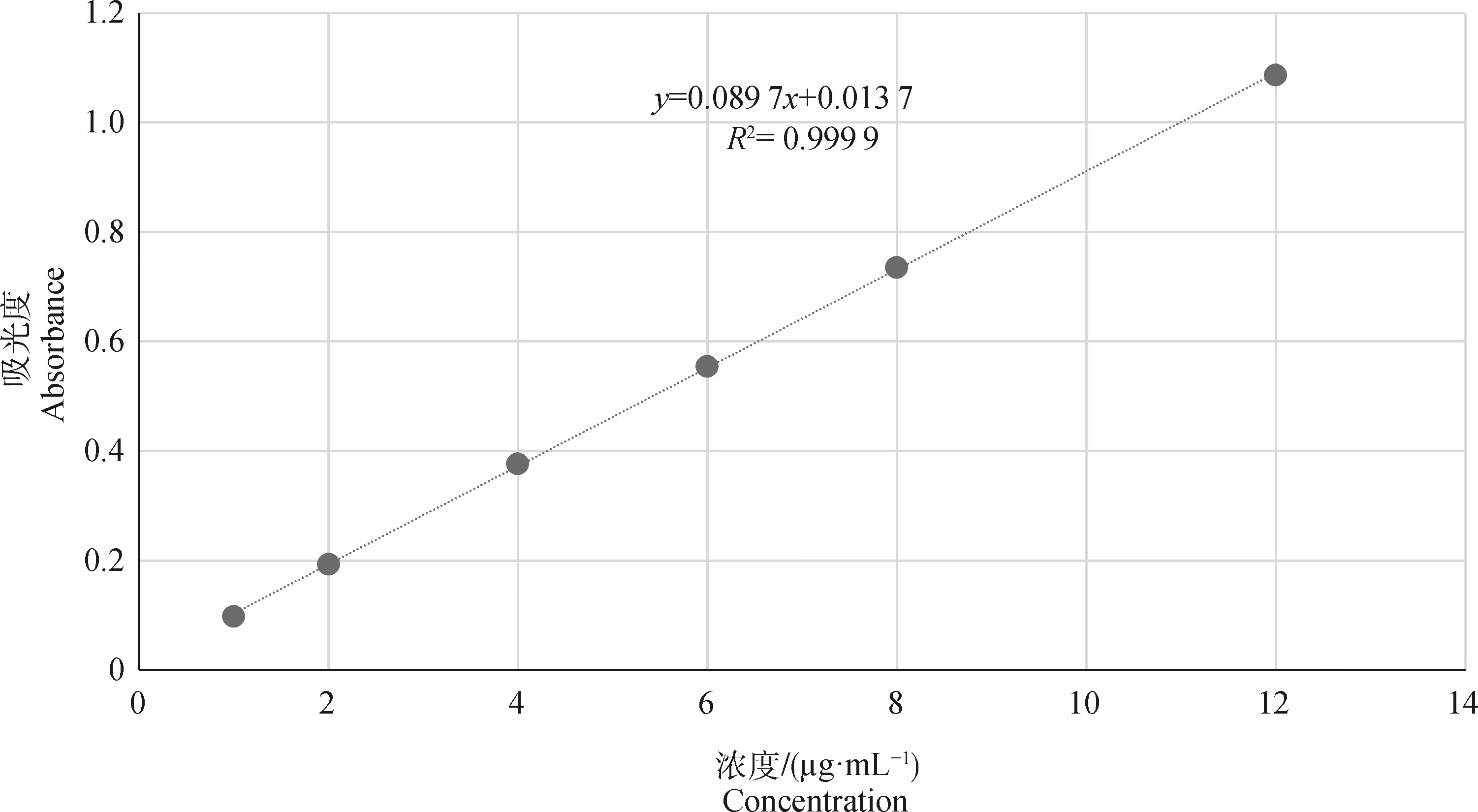
图1 烯丙孕素标准曲线Fig.1 Standard curve of altrenogest
由图1可知,在浓度为1~12 μg·mL-1,吸光度A与浓度的线性回归方程:y=0.089 7x+0.013 7,R2= 0.999 9。结果表明,烯丙孕素在该浓度范围内具有良好的线性关系。
1.2.2 烯丙孕素-β-环糊精衍生物包合物的制备 参考相关文献、根据烯丙孕素药物及SBE-β-CD的理化性质,采用冷冻干燥法制备烯丙孕素-β-环糊精衍生物的包合物。
精密称取适量的烯丙孕素原药溶解于无水乙醇溶液中,摇晃使其充分溶解,避光静置备用;按相应摩尔比称取SBE-β-CD于烧杯中,加入一定量的去离子水在恒温磁力搅拌器上搅拌使其完全溶解,并逐渐升温至55 ℃,向其中缓慢加入上述所制得的烯丙孕素无水乙醇溶液,维持温度搅拌反应4 h,之后转至室温避光条件下搅拌6 h,将制得的烯丙孕素包合物溶液用0.45 μm微孔滤膜过滤,滤液于-80 ℃ 超低温冰箱中预冻24~48 h,真空冷冻干燥后研磨过筛即得。
1.2.3 正交试验 以ALT与SBE-β-CD投料摩尔比(A)、包合时间(B)、溶液pH(C)以及溶剂的体积(D)为影响因素,每个因素3个水平,采用L9(34)正交试验法进行试验,选择包合物的包合率和收率为评价最优工艺指标。影响因素及水平见表1,综合评分按收率∶包合率=0.3∶0.7的权重计算。

表1 包合物影响因素及水平
1.2.4 含量测定 准确称取ALT-SBE-β-CD包合物12.5 mg于50 mL棕色容量瓶中,用适量50%乙醇溶液超声溶解并定容至刻度;从中取其1 mL置于10 mL棕色容量瓶中,50%乙醇溶液定容,震荡摇匀;以50%乙醇溶液做对照,测定吸光度A,将吸光度A代入线性回归方程计算出包合物中ALT的含量,计算包合率和载药量,每组做3个平行。
包合率%=包合物中烯丙孕素的质量(g)/投药量(g)×100%;
收率%=所得包合物实际质量(g)/(SBE-β-CD加入量(g)+加药量(g))×100%;
载药量%=包合物中烯丙孕素含量(g)/所制得的包合物质量(g)×100%。
1.2.5 最优组合包合物的制备及含量测定 按下得到的最优制备条件(“2.1”)制备包合物并测定包合物的收率,包合物中ALT的包合率以及载药量。
1.2.6 回收率试验 烯丙孕素标准溶液:使用1.2.1项下的0.25 mg·mL-1烯丙孕素标准溶液。
包合物样品溶液的配制:准确称取ALT-SBE-β-CD包合物12.5 mg于50 mL棕色容量瓶中,用适量50%乙醇溶液超声溶解并定容至刻度,摇匀,备用。
回收率测定:分别取0.1 mL上述ALT-SBE-β-CD包合物样品溶液置于9个10 mL棕色容量瓶中,编号1、2、3……9,向编号1~3、4~6、7~9容量瓶中分别加入0.1、0.2、0.3 mL烯丙孕素标准溶液,用50%乙醇溶液稀释并定容至刻度。以50%乙醇溶液为空白对照,测定吸光度A,将吸光度A带入线性回归方程计算出包合物中ALT的含量,计算回收率。
1.2.7 专属性试验 精密称取ALT原药、SBE-β-CD12.5 mg置于50 mL棕色容量瓶中,用50%乙醇溶液溶解并定容;分别取其溶液1 mL置于10 mL棕色容量瓶中,50%乙醇溶液稀释定容,用紫外分光光度计在352 nm处测定吸光度A。
1.2.8 稳定性试验 精密称取ALT-SBE-β-CD包合物12.5 mg置于50 mL棕色容量瓶中,用适量50%乙醇溶液溶解并定容至刻度,摇匀,静置备用;每隔2 h取样测定其吸光度A,连续测定12个时间点,即分别在0、2、4、6、8、10、12、24、48、72、96、120 h时取样测定吸光度A。
1.2.9 精密度试验 准确吸取上述“1.2.1”项下0.25 mg·mL-1ALT标准溶液6份,测定吸光度A。
1.3 包合物表征
1.3.1 傅里叶变换红外光谱法 分别取适量ALT原药,SBE-β-CD,ALT/SBE-β-CD物理混合物,ALT-SBE-β-CD包合物,采用KBr压片法,在红外光谱仪上检测,表征,如图2。
1.3.2 热重分析法 取适量ALT、SBE-β-CD、ALT/SBE-β-CD物理混合物、ALT-SBE-β-CD包合物,在热重分析仪上进行测试,测试条件:N2为保护气,升温速率10 ℃·min-1,测试范围为35~800 ℃,氧化铝坩埚,记录TG图谱,见图3。
1.3.3 显微镜成像法 分别取ALT、SBE-β-CD、ALT/SBE-β-CD物理混合物、ALT-SBE-β-CD包合物少量于载玻片上,用药匙将其均匀摊开,置于100倍显微镜下观察,见图4。
1.3.4 溶解度法 称取过量的ALT原料药、ALT-SBE-β-CD包合物于试管中,加适量的超纯水制成过饱和溶液,室温静置24~36 h,过滤,取一定量的续滤液用超纯水稀释成适宜浓度,于352 nm处测定吸光度A,计算ALT的溶解度。
2 结 果
2.1 ALT-SBE-β-CD包合物制备的正交试验
根据表2正交试验结果和表3方差分析结果可得知,各因素对ALT-SBE-β-CD包合物形成的影响大小为ALT与SBE-β-CD的投料摩尔比(A)>溶剂的体积(D)>包合时间(B)>溶液pH(C),各因素水平对试验结果均无显著影响,故不必再进行各因素水平间的多重比较。直观分析表明,ALT-SBE-β-CD包合物的最佳制备工艺为A2B3C2D2,即在55 ℃条件下,ALT与SBE-β-CD的投料摩尔比为1∶6,包合时间为5 h,溶液pH为8,溶剂的量为15 mL(当以ALT投药量为0.1 g时计)。
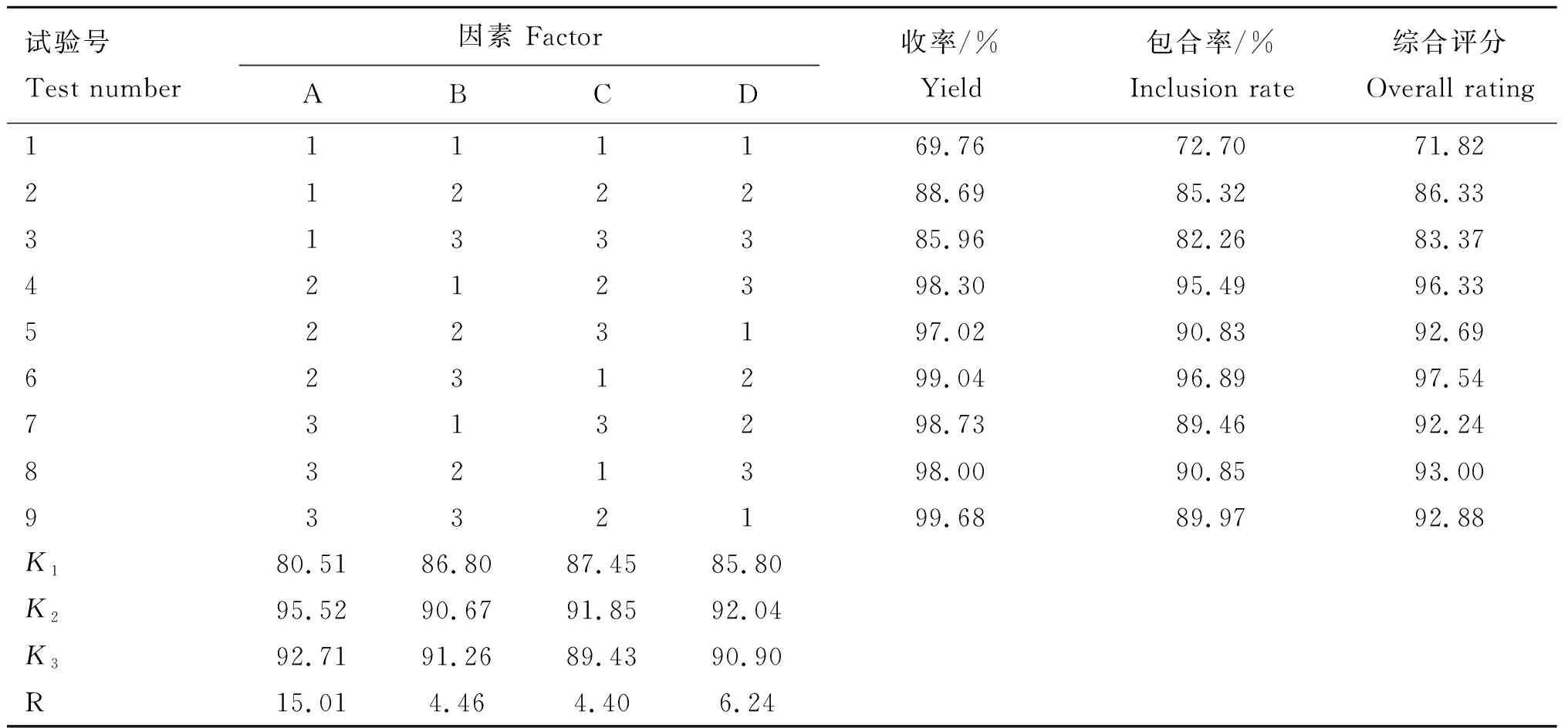
表2 ALT-SBE-β-CD L9(34)正交试验结果

表3 方差分析
2.2 最优组合包合物的制备及含量测定
经测定,ALT-SBE-β-CD包合物中ALT的平均包合率为(90.90±1.80)%(n=3,),平均载药量为(4.30±2.30)%(n=3,4.40%、4.20%、4.31%),包合物的收率为(93.19±1.67)%。
2.3 回收率试验
计算测得结果ALT-SBE-β-CD包合物的平均回收率为92.75%、95.31%和97.33%,RSD分别为1.21%、0.46%和1.05%(n=3,91.23%、93.10%、93.92%;94.69%、95.68%、95.56%;95.89%、98.11%、97.99%)。
2.4 专属性试验
准确称取ALT原药固体粉末、SBE-β-CD 12.5 mg 置于50 mL棕色容量瓶中,用50%乙醇溶液溶解并定容;分别取其溶液1 mL置于10 mL棕色容量瓶中,50%乙醇溶液稀释定容,用紫外分光光度计在352 nm处测定吸光度,ALT溶液在此波长处有很强的吸收(A=0.562),而SBE-β-CD在此波长处吸收很小(A=0.004),可忽略不计,故专属性很好。
2.5 稳定性试验
精密称取ALT-SBE-β-CD包合物体系12.5 mg于50 mL棕色容量瓶中,用适量50%乙醇溶液超声溶解并定容至刻度,摇匀,在室温避光条件下静置备用;每隔2 h取样测定其吸光度A,连续测定12个时间点,即分别在0、2、4、6、8、10、12、24、48、72、96、120 h取样,测定吸光度A(A=0.386、0.389、0.388、0.391、0.390、0.395、0.389、0.384、0.381、0.383、0.384、0.380)。计算结果得出,ALT-SBE-β-CD包合物RSD=1.14%(n=12),表明ALT包合物载药体系稳定性较好。
2.6 精密度试验
准确吸取上述“1.2.1”项下0.25 mg·mL-1ALT标准溶液6份,测定其吸光度A(A=0.554、0.552、0.549、0.557、0.556、0.550),RSD=0.58%,由此可表明仪器精密度良好。
2.7 包合物表征
2.7.1 傅里叶变换红外光谱法 由于傅里叶变换红外光谱能对分子的化学键及官能团组成进行分析,且β-环糊精衍生物在400~4 000 cm-1吸收峰很强,故易掩盖客体分子烯丙孕素的吸收峰,因此,可通过客体烯丙孕素、主体β-环糊精衍生物、烯丙孕素与β-环糊精物理混合物、包合物的红外光谱吸收峰的变化来确定包合物的形成。如图2,在客体ALT分子中,在1 700~1 800 cm-1内有脂环酮(四元环)羰基特征基团的微弱伸缩振动吸收,1 620~1 680和1 570 cm-1处均为碳碳双键-C=C-的伸缩振动吸收,波数1 225 cm-1左右为ALT分子中叔羟基的振动吸收,而SBE-β-CD衍生物的图谱在此波数范围内没有相关伸缩振动吸收;ALT/SBE-β-CD物理混合物的红外图谱类似于客体ALT与主体β-CD衍生物的单体图谱的叠加;而ALT-SBE-β-CD包合物载药体系中ALT在1 700~1 800 cm-1有脂环酮(四元环)羰基特征基团的伸缩振动吸收,1 620~1 680 和1 570 cm-1处均为-C=C-的伸缩振动吸收以及1 225 cm-1左右为ALT分子中叔羟基的振动吸收发生显著变化,单体中峰强度较高,包合物载药体系中该峰强度大幅度减弱或者被SBE-β-CD的图谱掩盖而消失;包合物中SBE-β-CD的羟基伸缩振动由3 370 cm-1左右位移到3 316 cm-1左右,且包合物载药体系中这些峰型也发生了变化,由以上变化可知,客体分子ALT进入了主体分子β-CD衍生物的空腔中,而不是简单的物理吸附,说明ALT与β-CD衍生物形成了包合物载药体系。
2.7.2 热重分析法 由图3可知,ALT原药在200 ℃左右和340 ℃左右分别进行了第一阶段和第二阶段的失重,在530 ℃左右失重完全至0;SBE-β-CD在270、320和440 ℃左右分别进行了第一阶段、第二阶段和第三阶段的失重;ALT/SBE-β-CD物理混合物的失重曲线为ALT原药与SBE-β-CD两者曲线的简单叠加,失重温度在220 ℃左右、320 ℃ 左右和440 ℃左右;而包合物ALT-SBE-β-CD的失重曲线与SBE-β-CD的失重曲线相似,原因可能为在表征过程中取样量较少,且载体SBE-β-CD与ALT的摩尔比较大,进而导致在图谱中的一些峰被掩盖,该包合物失重温度在270 ℃左右、320 ℃左右和420 ℃左右,较ALT原药和物理混合物的失重温度有所提高,说明包合物ALT-SBE-β-CD的稳定性得到一定的提高,由此可进一步说明ALT-SBE-β-CD包合物的形成。

1.ALT;2.SBE-β-CD;3.ALT/SBE-β-CD物理混合物;4.ALT-SBE-β-CD包合物1.ALT; 2.SBE-β-CD; 3.ALT/SBE-β-CD physical mixture; 4.ALT-SBE-β-CD inclusion complex图2 SBE-β-CD系统红外扫描图谱Fig.2 Infrared scanning atlas of SBE-β-CD system
2.7.3 显微镜成像法 结果分析发现,ALT原药的显微镜像清晰,呈块状菱形结晶;SBE-β-CD均呈圆球状,物理混合物可明显观察到ALT原药晶体以及SBE-β-CD的显微镜像特征;而包合物的镜像观察不到ALT原药和SBE-β-CD的镜像,仅可观察到黑色的团状物,无明显的块状结晶或圆球状物,由此可说明包合物已经生成。

1.ALT;2.SBE-β-CD;3.ALT/SBE-β-CD物理混合物;4. ALT-SBE-β-CD包合物1. ALT;2. SBE-β-CD; 3.ALT/SBE-β-CD physical mixture; 4. ALT-SBE-β-CD inclusion complex图3 SBE-β-CD系统热重分析图Fig.3 Thermogravimetric analysis diagram of SBE-β-CD system
2.7.4 溶解度法 由测得结果可知,ALT原料药、ALT-SBE-β-CD包合物得溶解度分别为0.015 2、15.030 7 mg·mL-1,由此可见,包合物的溶解度分别为ALT原药的988.86倍,说明原料药ALT与SBE-β-CD形成了包合物,并且此包合物还极大地提高了原料药ALT的溶解度。
3 讨 论
SBE-β-CD是β-环糊精的多取代衍生物,本身无毒性,具有很好的水溶性[23],可以与各种大小相符合,可与进入自身空腔的化合物分子进行包合[24]。因主体分子SBE-β-CD的空腔具有疏水性质,故客体分子的非极性越高越容易被包合,SBE-β-CD本身带有负电荷,所以,对那些带有正电荷或中性的客体分子较容易包合,且形成的包合物溶解度就越大[25]。难溶性药物可以与其内部的疏水基团通过氢键、范德华力等结合形成稳定的包合物[26],通过外部亲水基团与水分子结合来提高水难溶性药物的溶解度,从而增加了药物的疗效和效力(即最佳治疗活性所需的剂量减少),可使药物在较低剂量下有效,从而降低药物毒性[27];此外被包合物质进入SBE-β-CD的空腔后原有的稳定性被有效提高,改变药物固有的理化性质,可增加水难溶性药物的生物相容性,提高药物的水溶性[28-29]。
由试验结果可知,ALT-SBE-β-CD包合物的最佳制备工艺:ALT与载体SBE-β-CD的投料摩尔比为1∶6,包合时间为5 h,溶液pH为8,溶剂量为15 mL (当以ALT投药量为0.1 g计),以此最优条件制备得到的包合物收率为(93.19±1.67)%,包合物中ALT的平均包合率为(90.90±1.80)%,ALT的平均载药量为(4.30±2.30)%,平均回收率为(99.90±0.79)%,稳定性试验测得RSD为0.82%(n=6)。与其他同为SBE-β-CD载体的药物包合相关文献相比[30-31],该试验中ALT包合率较高,原因其一可能与ALT本身理化性质为偏中性相关,进而有利于药物包合的完成,提高了药物的包合率以及载药量;其二可能为在制备包合物过程中加入一定量的氢氧化钠溶液,使体系带有更多的负电荷,更有利于偏中性的ALT包合。

a.ALT; b.SBE-β-CD; c.ALT/SBE-β-CD物理混合物; d.ALT-SBE-β-CD包合物a.ALT; b. SBE-β-CD; c.ALT/ SBE-β-CD physical mixture; d. ALT-SBE-β-CD inclusion complex图4 SBE-β-CD系统显微镜成像图Fig.4 Microscopic image of the SBE-β-CD system
本试验所得的包合物载药体系通过红外光谱法、热重分析法和显微镜成像法对其进行了表征,由表征结果可知,ALT与SBE-β-CD发生了包合作用,可证明包合成功,并用溶解度法对原料药ALT和包合物ALT-SBE-β-CD进行了溶解度测定,由结果可知,相对原药ALT来说,ALT-SBE-β-CD包合物载药体系极大的提高了原药ALT在水中的溶解度,为ALT的开发利用拓宽了思路。
4 结 论
筛选出了ALT-SBE-β-CD包合物的最佳制备工艺,并验证了ALT-SBE-β-CD包合物的形成,通过溶解度法比较了ALT原药与包合物的溶解度,结果包合物中ALT溶解度大大提高,证明SBE-β-CD对ALT原药具有良好的增溶作用,进一步表明了包合物的形成,且该制备工艺方法简单,条件温和,为烯丙孕素的进一步开发利用提供了一定的理论基础。

