外源氨基酸对侧孢短芽孢杆菌S62-9产Brevilaterin的影响
王星星, 陈 洲, 韩盼盼, 刘杨柳, 李思霆, 贾英民
(北京工商大学 食品与健康学院, 北京 100048)
食源性腐败微生物是引起食品变质的重要因素之一,而抗菌肽(antimicrobial peptides, AMPs)被认为是极具应用潜力的新型生物防腐剂[1-2],能抑制或杀死常见的食品腐败菌和部分耐药细菌等[3],同时具有在生物体内不易残留、无免疫原性等特点。研究表明:同种生物机体中具有抗菌活性的AMPs通常是由多种肽混合而成,组成AMPs的组分不同,其抗菌特性及抗菌效果也不同[4]。因此,改变AMPs的组分构成,对推广AMPs的生产和应用具有深远意义。
微生物源抗菌肽凭借发酵周期短、成本低廉、易于实现工业化等优势而备受关注,其中,氨基酸残基数少于18个的小分子肽通常是由非核糖体肽合成酶催化形成[5],该酶的A结构域具有特异性识别氨基酸或其衍生物(如L-苯丙氨酸[6]、L-缬氨酸[7]、L-苏氨酸[8])的独特功能,可以在一定程度上“掌控”微生物AMPs的氨基酸种类甚至组分结构。直接操纵A结构域以改变微生物分泌AMPs的种类还难以实现,但可通过添加外源氨基酸等特异性氨基酸或其衍生物来人工扩大A结构域的底物识别范围,进而改变AMPs的组分构成。Isabelle等[9]在培养基中添加L-异亮氨酸,产生2种新的表面活性素;Iwase等[10]在培养基中添加氨基酸改变了伊枯草菌素A中同系物的比例;孙力军等[11]在培养基中添加谷氨酸,选择性促进了脂肽中芬介素组分的分泌。本研究以一株高产AMPs的优良菌株——侧孢短芽孢杆菌S62- 9(BrevibacilluslaterosporusS62- 9, BL)为研究对象[12-13],该菌株能够同时分泌5种不同结构的AMPs(分别命名为Brevilaterin A、B、C、D、E),且各组分的抗菌特性也存在差异。通过前期探索发现,该菌分泌AMPs的组分会受到外源氨基酸很大的影响。目前,研究主要集中在探究添加一种或分别添加几种氨基酸对AMPs组分合成的影响,而少有系统大量研究其对AMPs组分合成的影响。为此,本研究将系统探究外源氨基酸的存在对BL分泌AMPs组分产生的影响,希望为未来实现人工改变微生物合成新型、高效的AMPs奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
实验菌株:酶与蛋白质工程实验室筛选的侧孢短芽孢杆菌。
抗菌活性实验用指示菌:金黄色葡萄球菌(Staphylococcusaureus, ATCC 25923),中国工业微生物菌种保藏管理中心。
主要试剂:分析纯氨基酸(D/L-色氨酸、D/L-甲硫氨酸、D/L-缬氨酸、L-丙氨酸、L-甘氨酸、D-组氨酸、D/L-丝氨酸、L-羟脯氨酸、D/L-异亮氨酸、D/L-亮氨酸、L-谷氨酸、L-酪氨酸、L-胱氨酸、L-脯氨酸、L-天冬酰胺、L-苏氨酸、L-谷氨酰胺、D-天冬氨酸、D/L-苯丙氨酸、L-鸟氨酸盐酸盐)及色谱纯三氟乙酸,上海麦克林生化科技有限公司;分析纯氨基酸衍生物(3-氨基丁酸、L-蛋氨酸亚砜、S-甲基-L-半胱氨酸、2-氨基丁酸、2-羟基-4-甲基戊酸、2-氧代-3-甲基丁酸、2-羟基-3-甲基丁酸、α-酮戊二酸),上海源叶生物科技有限公司;色谱纯乙腈,北京迈瑞达科技有限公司。
1.2 仪器与设备
TGL- 20bR型离心机,上海飞鸽股份有限公司;Scan 4000型全自动菌落计数仪,法国Interscience公司;IF 260型培养箱,德国Memmert 公司;T6型新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;1260型高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1培养基配制
营养肉汤(NB)培养基(g/L):蛋白胨10,牛肉膏3,氯化钠5。pH值7.2,121 ℃灭菌20 min。
营养肉汤琼脂(NA)培养基(g/L):蛋白胨10,牛肉膏3,氯化钠5,琼脂15。pH值7.2,121 ℃灭菌20 min。
发酵培养基(g/L):葡萄糖15,蛋白胨12,氯化锌0.008 6,氯化钙1.38,吐温20 1.0。pH值7.0,121 ℃灭菌20 min。
1.3.2种子液制备
从斜面培养基中挑取适量BL划线接种到NA培养基上,在37 ℃条件下培养24 h。再挑取适量活化好的BL于50 mL NB培养基中,32 ℃、240 r/min摇床培养12 h,进行活化。
1.3.3摇瓶发酵培养
将活化好的种子液混匀,按体积分数4%的量分别接种于添加5 g/L不同氨基酸或其衍生物的发酵培养基中,32 ℃、240 r/min发酵培养24 h,以未添加氨基酸或其衍生物的为空白对照组。
1.3.4BL菌体量的测定
发酵完成后,分别取摇匀的发酵液2 mL,适当稀释,采用紫外分光光度计测定600 nm波长下样品的OD值,即为菌体量。
1.3.5发酵液抗菌活性及Brevilaterin组分的测定
样品前处理:分别取添加不同氨基酸或其衍生物发酵的发酵液1.5 mL,8 000 r/min离心5 min(4 ℃),取上清液用0.22 μm的无菌滤膜过滤备用。
发酵液抗菌活性的测定:采用琼脂扩散法[14],以金黄色葡萄球菌为指示菌,将活化至对数期的指示菌液稀释至OD600为0.7~0.8,取稀释后的菌液,以体积分数3%的量接种于45 ℃左右的NA培养基中,混匀,倒平板,待冷却凝固,将无菌牛津杯置于平板上,分别加入50 μL上清液,于37 ℃培养12~16 h,全自动菌落计数仪测定抑菌直径。将添加不同氨基酸或其衍生物的上清液的抑菌直径记为A1,对照组抑菌直径记为A0,抑菌直径增长率计算见式(1)。

(1)
Brevilaterin组分的测定:采用高效液相色谱法[15],色谱柱为InfinityLab Poroshell 120 EC- C18(4.6 mm×150 mm,4 μm)、XBridge®Peptide BEH C18(4.6 mm×150 mm,5 μm)、XSelect®Peptide CSHTMC18(4.6 mm×150 mm,5 μm),流动相A为体积分数0.1%的TFA水溶液,流动相B为体积分数0.1%的TFA乙腈溶液,检测波长为220 nm,柱温为30 ℃,流速为1 mL/min,进样量20 μL,洗脱流程见表1。
1.4 数据处理
实验均重复3次,采用Excel 2019和Origin 8.1软件进行数据处理。

表1 洗脱流程Tab.1 Elution process
2 结果与讨论
2.1 L-氨基酸对发酵液抗菌活性及Brevilaterin组分构成的影响
2.1.1L-氨基酸对发酵液抗菌活性的影响
以菌体量为指标,考察了不同L-氨基酸对菌体生长情况的影响(表2)。结果显示:18种L-氨基酸的添加在不同程度上影响了菌体生长。其中,与对照组相比,L-鸟氨酸盐酸盐的促进作用最明显,其菌体量增加了54.97%,L-异亮氨酸和L-亮氨酸次之,分别为27.81%和26.49%;而L-甘氨酸对菌体生长呈明显的抑制作用,其菌体量下降了39.07%。
同时,以抑菌直径增长率为指标,考察了不同L-氨基酸对发酵液抗菌活性的影响(表2)。结果显示:18种L-氨基酸对发酵液抗菌活性具有不同程度的影响。L-缬氨酸、L-鸟氨酸盐酸盐、L-甲硫氨酸的添加均能明显提高发酵液抗菌活性,其中以L-缬氨酸的促进作用最强,其抑菌直径的增长率达18.08%,L-鸟氨酸盐酸盐次之;而L-异亮氨酸和L-亮氨酸却表现出较强的抑制作用,其抑菌直径分别降低了13.52%和13.28%。

表2 不同L-氨基酸对发酵液抗菌活性的影响Tab.2 Effects of different L-amino acids on antibacterial activity of fermentation broth
2.1.2L-氨基酸对Brevilaterin组分构成的影响
外源添加L-氨基酸能够显著影响发酵液抗菌活性,而发酵液中AMPs的组分构成不同,表现出的抗菌活性也不同[11],因此,本研究进一步通过HPLC分析了添加L-氨基酸后发酵液中Brevilaterin 组分构成的变化情况,见图1(由于Brevilaterin A的含量很低,在文中不予以比较)。当未添加L-氨基酸发酵时,BL分泌的AMPs以Brevilaterin B、C和E为主。相比而言,添加L-鸟氨酸盐酸盐能选择性提高Brevilaterin B、C和E的含量[图1(a)];而L-亮氨酸或L-异亮氨酸的添加却使得Brevilaterin B、C、D和E的含量均显著降低[以图1(b)为例];添加L-缬氨酸发酵后,Brevilaterin B、C、D和E之间的相对比例发生很大变化,Brevilaterin B的含量显著降低,而Brevilaterin E未检测出,同时还出现了多种未知组分[图1(c)];添加L-甲硫氨酸后,HPLC只能检测到Brevilaterin B和C,二者间相对比例发生了反转[图1(d)];而添加其余L-氨基酸对Brevilaterin的组分构成几乎无影响。
小分子AMPs通常是由非核糖体肽合成酶催化形成,该酶是一个庞大的酶组体系,由多种具备不同催化功能的催化蛋白按特定空间顺序排列而成,各模块专一性催化对应单元并组装到新生肽链当中[16]。其中,腺苷酰化酶主要负责特异性识别氨基酸底物,它可直接参与调控小分子肽结构中的氨基酸种类和数量[17]。从本研究结果来看,外源添加的氨基酸确实能显著影响AMPs的分泌,推测原因是外源添加的氨基酸能为该酶组体系的催化合成提供更多的底物选择,进而改变AMPs的组分构成。
氨基酸作为重要的生物小分子,在微生物发酵过程中对菌体生长及其次级代谢物的合成起着关键性作用[18]。董难等[19]发现:在培养基中添加L-谷氨酸不仅能促进Streptomycessp. M- Z18的生长,还能促进ε-聚赖氨酸的分泌。结合2.1.1节中添加L-氨基酸对菌体生长情况的影响,本研究发现:添加L-鸟氨酸盐酸盐不仅能促进菌体生长,还能选择性促进Brevilaterin B、C和E的分泌。Wu等[20]报道,在培养基中添加L-酪氨酸会抑制伊枯草菌素A的分泌。本研究也发现,添加L-异亮氨酸或L-亮氨酸显著抑制了Brevilaterin B、C、D和E的分泌。此外,Yulia[21]发现,培养基中添加L-缬氨酸能明显改变伊枯草菌素A中各组分间的相对比例。朱玲燕等[22]发现,在培养基中添加L-谷氨酸、L-亮氨酸、L-天冬氨酸和L-缬氨酸均能选择性提高表面活性素中C15组分的分泌量。孙力军等[11]也发现添加L-谷氨酸发酵后,可产生3种新的表面活性素组分。同样,本研究发现:添加L-缬氨酸或L-甲硫氨酸能改变Brevilaterin初始组分间的相对比例;而添加L-甲硫氨酸能显著促进Brevilaterin B的分泌,添加L-缬氨酸则产生了新的AMPs组分。添加L-鸟氨酸盐酸盐、L-异亮氨酸、L-亮氨酸、L-缬氨酸或L-甲硫氨酸影响了发酵液中Brevilaterin的组分构成,进而表现出不同的抗菌活性。

图1 不同L-氨基酸对Brevilaterin组分构成的影响Fig.1 Effects of different L-amino acids on component constitution of Brevilaterin
2.2 D-氨基酸对发酵液抗菌活性及Brevilaterin组分构成的影响
2.2.1D-氨基酸对发酵液抗菌活性的影响
考察了不同D-氨基酸对菌体生长情况的影响(表3)。结果显示:D-组氨酸的促进作用最明显,菌体量增加了46.56%,D-甲硫氨酸次之;但D-苯丙氨酸、D-丝氨酸和D-缬氨酸对菌体生长具有一定的抑制作用,其菌体量分别下降了30.53%、29.77%、11.45%。
D-氨基酸对发酵液抗菌活性影响的实验结果显示:添加D-组氨酸能明显提高发酵液抗菌活性,抑菌直径增长率为7.04%;而添加D-异亮氨酸、D-亮氨酸、D-缬氨酸、D-甲硫氨酸则表现出抑制作用,其中D-异亮氨酸、D-亮氨酸和D-缬氨酸的抑制作用最强,抑菌直径分别降低了33.61%、23.14%、23.13%。
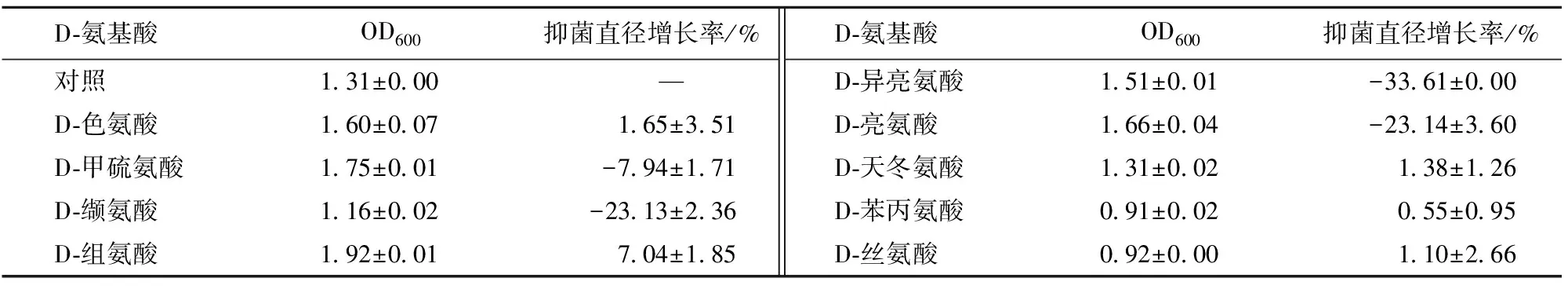
表3 不同D-氨基酸对发酵液抗菌活性的影响Tab.3 Effects of different D-amino acids on antibacterial activity of fermentation broth
2.2.2D-氨基酸对Brevilaterin组分构成的影响

图2 不同D-氨基酸对Brevilaterin组分构成的影响Fig.2 Effects of different D-amino acids on component constitution of Brevilaterin
本研究进一步通过HPLC分析了添加D-氨基酸后Brevilaterin组分构成的变化情况(图2)。添加D-组氨酸能选择性提高Brevilaterin B、C和E的含量[图2(a)];添加D-缬氨酸后,HPLC只能检测出Brevilaterin C和E,其含量均显著降低[图2(b)];添加D-甲硫氨酸后,HPLC只能检测出Brevilaterin B和C,其含量也显著降低[图2(c)];添加D-亮氨酸和D-异亮氨酸后则均只检测出一个新组分[以图2(d)为例];而添加其余D-氨基酸对Brevilaterin的组分构成几乎无影响。添加D-组氨酸、D-异亮氨酸或D-亮氨酸、D-缬氨酸或D-甲硫氨酸影响了发酵液中Brevilaterin的组分构成,进而表现出不同的抗菌活性。此外,结合2.2.1节中添加D-氨基酸对菌体生长情况的影响,发现添加D-组氨酸不仅能够促进菌体生长,还能选择性促进Brevilaterin B、C和E的分泌。
廖福荣[23]发现在半合成培养基中添加L-缬氨酸可促进环孢菌素A的合成;相反,添加D-缬氨酸却抑制了环孢菌素A的形成。Wu等[24]发现添加D-甲硫氨酸和D-苯丙氨酸能促进乳酸链球菌素的产生,但添加L型的氨基酸却不产生任何影响。本研究同样也发现:添加L-氨基酸对Brevilaterin组分的影响不同于D-氨基酸。
2.3 氨基酸衍生物对发酵液抗菌活性及Brevilaterin组分构成的影响
2.3.1氨基酸衍生物对发酵液抗菌活性的影响
不同氨基酸衍生物对菌体生长情况的影响见表4。结果显示:3-氨基丁酸的促进作用最明显,菌体量增加了42.86%,2-氧代-3-甲基丁酸次之;而添加2-氨基丁酸、2-羟基-3-甲基丁酸或2-羟基-4-甲基戊酸却表现出一定的抑制作用,菌体量分别下降了21.80%、12.78%、11.28%。
氨基酸衍生物对发酵液抗菌活性影响的实验结果显示:2-氧代-3-甲基丁酸的添加能显著提高BL发酵液抗菌活性,其抑菌直径增长率达8.83%;添加2-氨基丁酸则表现出显著的抑制作用,其抑菌直径降低了8.39%。
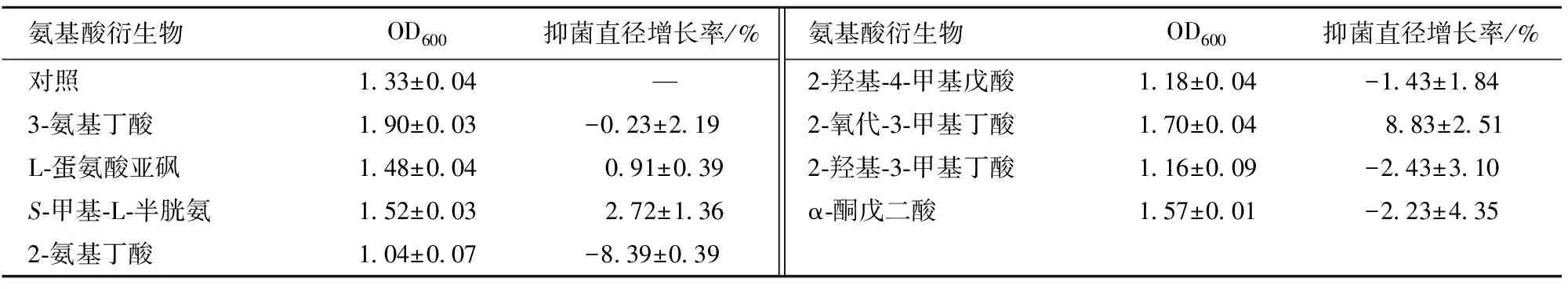
表4 不同氨基酸衍生物对发酵液抗菌活性的影响Tab.4 Effects of different amino acid derivatives on antibacterial activity of fermentation broth
2.3.2氨基酸衍生物对Brevilaterin组分构成的影响
本研究通过HPLC进一步分析了添加氨基酸衍生物后Brevilaterin组分构成的变化情况(图3)。添加2-氧代-3-甲基丁酸后,HPLC检测出多种未知组分,而Brevilaterin B、C、D、E均未检测出[图3(a)];添加2-氨基丁酸后,HPLC只能检测出Brevilaterin B和C,其含量也显著降低[图3(b)];而添加其余氨基酸衍生物对Brevilaterin的组分构成几乎无影响。
除添加氨基酸对AMPs的合成有影响外,某些氨基酸的衍生物同样会对AMPs的合成产生重要影响。Traber等[25]发现加入2-氨基丁酸能促进环孢菌素A的合成,加入3-氨基丁酸却抑制了其合成。Kobel等[26]发现添加D/L-α-氨基丁酸可抑制除环孢霉素A外的所有环孢霉素的形成。本研究结果表明:添加2-氧代-3-甲基丁酸能促进BL分泌多种新组分,添加2-氨基丁酸则抑制了Brevilaterin B和C的合成。添加2-氧代-3-甲基丁酸或2-氨基丁酸影响了发酵液中Brevilaterin的组分构成,进而表现出不同的抗菌活性。此外,结合2.3.1中添加氨基酸衍生物对菌体生长情况的影响,发现添加2-氧代-3-甲基丁酸不仅能促进菌体生长,还能产生新的Brevilaterin组分。

图3 不同氨基酸衍生物对Brevilaterin组分构成的影响Fig.3 Effects of different amino acid derivatives on component constitution of Brevilaterin
3 结 论
本研究以BL分泌的Brevilaterin为对象,考察了18种L-氨基酸、9种D-氨基酸和8种氨基酸衍生物对BL发酵液抗菌活性及所产Brevilaterin组分的影响。结果表明:添加L-缬氨酸、L-鸟氨酸盐酸盐、L-甲硫氨酸、D-组氨酸和2-氧代-3-甲基丁酸均能提高发酵液抗菌活性,L-缬氨酸效果最明显;而添加L/D-异亮氨酸、L/D-亮氨酸、D-缬氨酸、D-甲硫氨酸或2-氨基丁酸则相反。此外,这些氨基酸的添加均能改变Brevilaterin的组分构成。添加L-甲硫氨酸后发酵液中只能检测到Brevilaterin B和C,且二者的相对比例也发生了反转;而添加L-缬氨酸和2-氧代-3-甲基丁酸后还能促进BL分泌新的Brevilaterin组分。可见,外源氨基酸的加入既能提高发酵液的抗菌活性,又能改变AMPs的组分构成,研究旨在为未来人工调控微生物合成新型、高效AMPs提供理论依据。

