酶解对猴头菇多糖结构特征及免疫活性的影响
余蕊宏,孙梦珂,雷 博,陈仕雄,张浚文,刘晓盼,任 喆,黄一帆,秦 韬 (福建农林大学 动物科学学院(蜂学学院) 福建省兽医中药与动物保健重点实验室,福建 福州 350002)
猴头菇(Hericiumerinaceus)属担子菌纲、多孔菌目、猴头属,是一种传统的食用菌和药用菌,具有滋补身体、助消化等功效[1]。多糖(polysaccharide)作为猴头菇中的主要活性成分之一,是一类广泛存在于动植物中的天然高分子活性物质[2]。大量研究表明,猴头菇多糖(Hericiumerinaceuspolysaccharide,HEP)具有增强免疫力[3]、抗氧化[4]、降血脂[5]等生理功能,具有较高的药用价值和保健价值。
多糖的生物活性与其结构密切相关,包括相对分子质量、构象、糖链类型等[6]。相对分子质量是影响多糖物理特性和生理活性的主要因素[7],不同相对分子质量的多糖具有不同的结构特征及功能特性,但大相对分子质量的多糖由于结构复杂、水溶性差等缺点,极大地限制了多糖的开发和应用。研究发现,经过降解后的多糖,其相对分子质量和黏度均得到降低,往往表现出更强的生物活性[8]。酶解法是多糖降解的一种常见方法,主要通过改变分子的结构特征来提高其生物活性,具有专一性强、高效性、降解条件温和等优点[9]。目前,国内外研究表明[10-11],酶解修饰不仅可以改变多糖的相对分子质量大小,还可以显著增强其生物活性,但关于猴头菇酶解多糖(enzymatic hydrolysis ofHericiumerinaceuspolysaccharide,EHEP)的生物活性尚不清楚。
巨噬细胞(macrophages)属于免疫细胞,具有识别、吞噬及清除病原微生物和凋亡的机体细胞,是机体抵抗感染的第1道防线[12]。当病原微生物等外源物质侵入机体时,巨噬细胞会产生大量具有生物活性的分子,比如一氧化氮(NO)、活性氧和细胞免疫因子等[13],从而发挥免疫调节作用。鉴于巨噬细胞在机体免疫系统中的重要地位,本研究采用酶解法制备EHEP,以巨噬细胞RAW 264.7为靶细胞,深入研究EHEP对巨噬细胞的生物学功能及其在机体免疫调节中的作用,为酶解多糖的开发与应用奠定理论基础。
1 材料与方法
1.1 试验材料HEP由实验室制备[14](糖含量为81.3%);内切-1,5-α-阿拉伯聚糖酶(10 U/mg)购自Megazyme公司;PBS缓冲液购自Solarbio公司;DMEM培养液和双抗(青、链霉素)均购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;NO检测试剂盒和噻唑蓝(MTT)均购自碧云天生物技术有限公司;二甲基亚砜(DMSO)、脂多糖(LPS)、FITC-dextran均购自Sigma公司;FITC-CD40和FITC-CD86抗体均购自eBioscience公司。
1.2 主要仪器ABT 320-4M电子天平购自科恩公司;真空冷冻干燥机购自CHRiST公司;傅里叶红外光谱仪、Multiskan Mk3酶标仪购自Thermo公司;台式高速离心机购自BECKMAN公司;NovoCyte流式细胞仪购自艾森生物有限公司;二氧化碳恒温培养箱购自西德Haraneus公司。
1.3 EHEP的制备用pH 4.0的缓冲液将内切-1,5-α-阿拉伯聚糖酶配制成质量浓度为5 g/L的酶溶液,同法配制4 g/L的HEP溶液,再按酶溶液:HEP溶液体积比1∶10的比例混匀。静置5 min后,40℃反应1 h,沸水浴10 min后静置1 h,4 000 r/min离心10 min,收集上清液置于100~500 kDa透析袋中透析。24 h后,冷冻干燥,即得EHEP。
1.4 相对分子质量的测定将质量浓度为1 g/L的HEP与EHEP溶液,通过高效凝胶色谱法测定其相对分子质量。色谱条件为:色谱柱选用安捷伦KS-805、KS-804和KS-802三根串联,流动相为双蒸水,流速为1 mL/min,检测器为安捷伦1260 Infinity液相色谱仪配示差折光检测器,柱温为70℃,检测器温度为50℃。
1.5 红外光谱分析称取1 mg的HEP和EHEP样品,分别与100 mg KBr粉末混合,研磨均匀后压片。将制好的压片放入红外光谱仪内进行扫描,扫描范围为4 000~400 cm-1,并对所得的红外吸收图谱进行分析。
1.6 扫描电镜分析取少量HEP和EHEP分别黏在带有导电胶的处理片上,用洗耳球吹去浮样,经喷金处理后,置于扫描电镜的样品室中扫描分析,观察HEP与EHEP的表面形貌。
1.7 原子力电镜分析将样品HEP和EHEP分别配制成质量浓度为10 mg/L的溶液,滴在新剥离的云母片上,经氮气干燥后被置于原子力显微镜上观测。
1.8 HEP和EHEP对RAW 264.7细胞的免疫调节活性
1.8.1RAW 264.7细胞的培养与传代 小鼠巨噬细胞系RAW 264.7采用DMEM完全培养液(含10% FBS、1%双抗)于37℃、5% CO2恒温培养箱中进行培养,待细胞密度达80%以上时,PBS洗涤2次,加入0.25%的胰蛋白酶作用30 s,最后用DMEM完全培养液终止消化,并接种于新的细胞培养瓶中进行传代培养,用于后续试验。
1.8.2MTT法检测RAW 264.7细胞的增殖活性 取对数生长时期的RAW 264.7细胞接种于96孔板中,细胞密度为1×105/mL,于37℃、5% CO2培养箱中培养24 h后,每孔加入含有HEP和EHEP的培养液(终质量浓度为0.391,0.781,1.563,3.125,6.250,12.500,25.000 mg/L),另设空白组。孵育24 h 后,除去上清后,每孔加入10 μL MTT溶液(5 g/L),继续孵育4 h后,弃上清,每孔加入150 μL DMSO,振荡10 min使沉淀完全溶解,最后于酶联免疫检测仪测定490 nm处的D值,并计算细胞增殖率。
细胞增殖率=加药组D值/空白组D值×100%。
1.8.3试验分组 根据1.8.2中RAW 264.7细胞增殖的试验结果,分为以下4组:Blank组、LPS组(1 mg/L)、HEP组(0.391~6.250 mg/L)、EHEP(0.391~6.250 mg/L)。
1.8.4RAW 264.7细胞表面分子CD40和CD86的检测 取对数生长时期的RAW 264.7细胞接种于6孔板中,细胞密度为1×106/mL,于37℃、5% CO2培养箱中培养24 h后,加入含有HEP和EHEP的培养液(终质量浓度为0.391,0.781,1.563,3.125,6.250 mg/L)。孵育24 h后,收集上清液备用,用PBS清洗2次,每孔各加入1 μL FITC-CD40和FITC-CD86,4℃避光孵育30 min后,PBS清洗2次,弃上清,用500 μL PBS重悬后,上流式细胞仪检测。
1.8.5RAW 264.7细胞吞噬功能的检测 参照1.8.4方法接种细胞于6孔板中。孵育24 h后,收集上清液备用,并用PBS清洗2次,每孔加入400 μL FITC-dextran,37℃避光孵育30 min后,加入PBS清洗3次,弃上清,用500 μL PBS重悬后,上流式细胞仪检测。
1.8.6NO的测定 收集1.8.4或1.8.5中各组的细胞上清液,每组取出50 μL上清液转移至另一新的96孔板中,并用完全培养液稀释NaNO2标准品质量浓度为0,10,20,40,60,80,100 mg/L。在各孔中依次加入Griess Reagent Ⅰ、Griess Reagent Ⅱ试剂后,用酶标仪检测540 nm波长处的D值。最后,以NaNO2标准品的浓度为横坐标,D值为纵坐标绘制标准曲线,计算出各组上清液中NO的含量。

2 结果
2.1 HEP和EHEP的相对分子质量分析多糖相对分子质量的大小是影响其生物活性的主要因素之一,不同相对分子质量的多糖具有不同的生物活性,因此采用高效凝胶色谱法测定HEP和EHEP的相对分子质量。葡聚糖标准曲线方程为y=53.9-8.3x+0.53x2-0.015x3+0.000 17x4,将HEP和EHEP的洗脱体积代入到方程中,得到HEP的相对分子质量为4.3×104kDa,EHEP的相对分子质量为1.25×104kDa。
2.2 HEP和EHEP的红外光谱分析红外光谱可用于来鉴定化合物和官能团结构。如图1所示,HEP与EHEP都包含3 600~3 200 cm-1的O-H吸收峰以及3 000~2 800 cm-1和1 410 cm-1的C-H伸缩振动和变角振动特征吸收峰[4],这3种峰均属于多糖的特征峰,表明HEP与EHEP均为多糖类物质。HEP和EHEP分别在1 573.55,1 572.99 cm-1处有吸收峰,可能是有结晶水的存在;在575.85,620.39 cm-1的吸收峰表明HEP和EHEP均具有α-糖苷键。1 200~1 000 cm-1范围出现的吸收峰是由于C-OH的变角振动引起的。与HEP红外图谱相比[4],EHEP在928.03 cm-1处有吸收峰,此峰属于β型吡喃糖伸缩振动峰。
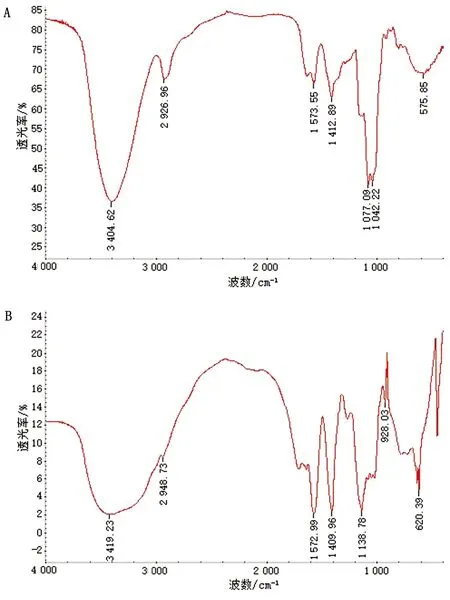
A.HEP红外谱图;B.EHEP红外谱图图1 HEP和EHEP的红外谱图
2.3 HEP和EHEP的扫描电镜和原子力电镜分析扫描电镜和原子力电镜能观察到多糖的微观形貌,进一步分析多糖的结构特征。HEP和EHEP的扫描电镜图如图2A所示,HEP的形态呈块状,菱角分明且表面光滑;EHEP呈不规则的形态,凹凸不平且表面粗糙,同时还出现带裂痕的褶皱形貌。HEP和EHEP的原子力电镜观察结果如图2B所示,两者的空间结构均呈近似纺锤体形状[4],且紧密排列在一起。HEP的高度范围为-10.1~9.5 nm,EHEP的高度范围为-10.3~10.7 nm。

A.扫描电镜图;B.原子力电镜图图2 HEP和EHEP的扫描电镜图和原子力电镜图
2.4 HEP和EHEP对RAW 264.7细胞的免疫调节活性
2.4.1细胞增殖活性 MTT法是一种快速简单检测细胞增殖率的方法,可根据D值来判断细胞的活性,从而间接反映细胞的增殖能力。由图3可知,HEP和EHEP分别在0.391~3.125,0.391~25.000 mg/L质量浓度范围的内细胞增殖率均显著高于空白组(P<0.05),且呈现剂量依赖性,表明0.391~3.125 mg/L HEP和0.391~25.000 mg/L EHEP均可以显著促进RAW 264.7细胞的增殖(P<0.05)。而当HEP的质量浓度增加至12.500,25.000 mg/L时,细胞的增殖率均显著低于空白组(P<0.05)。
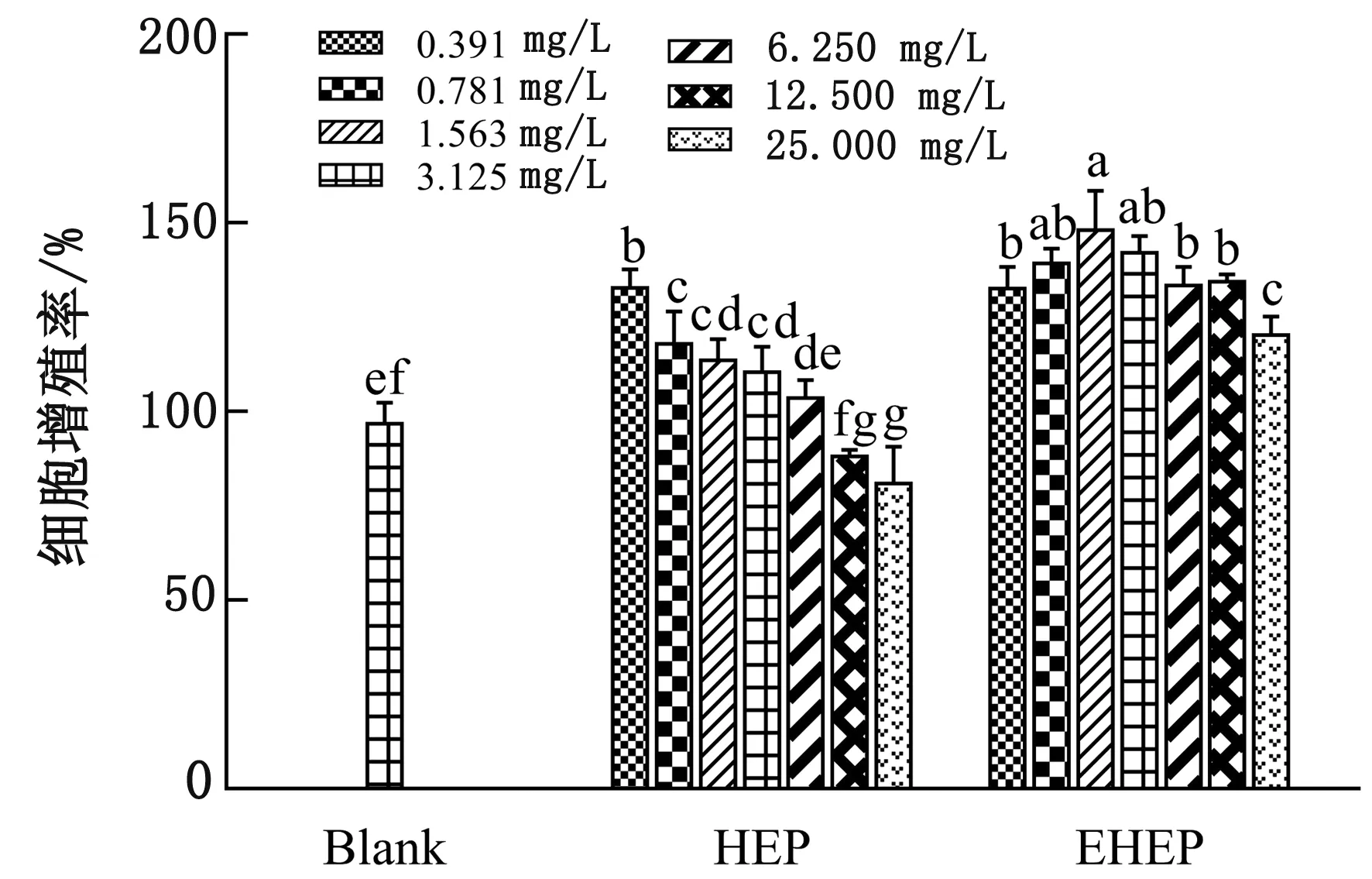
小写字母相同的表示差异不显著(P>0.05),不同的表示差异显著(P<0.05)。下同图3 HEP和EHEP对RAW 264.7细胞增殖的影响
2.4.2细胞表面分子CD40和CD86的表达 CD40和CD86属于免疫球蛋白超家族成员,在刺激T细胞活化的过程中发挥重要作用,其表达量的多少与巨噬细胞的抗原提呈能力有着密切联系。如图4,5所示,HEP和EHEP均可以显著促进RAW 264.7细胞表面分子CD40和CD86的表达(P<0.05),且呈现明显的剂量效应。从图4A,B中可以看出,在0.391~6.250 mg/L质量浓度范围,HEP与EHEP的CD40表达率均显著高于空白组(P<0.05),且EHEP组的CD40表达率显著高于同等剂量下HEP组的表达率(P<0.05),以6.250 mg/L EHEP的CD40的表达率最高,为14.8%。从图5A,B中可以看出,在0.391~6.250 mg/L质量浓度范围,HEP与EHEP的CD86表达率均显著高于空白组(P<0.05),以6.250 mg/L EHEP的CD86的表达率最高,为19.8%。结果表明,与HEP相比,EHEP更能增强RAW 264.7细胞表面分子CD40和CD86表达的能力。

图4 HEP和EHEP对RAW 264.7细胞表面分子CD40表达的影响

图5 HEP和EHEP对RAW 264.7细胞表面分子CD86表达的影响
2.4.3细胞吞噬活性 吞噬能力是衡量巨噬细胞活性的一个指标,活化后的巨噬细胞具有较强的吞噬能力,可通过吞噬侵入的病原体来提高机体的免疫调节作用。由图6可知,HEP与EHEP在0.391~6.250 mg/L 的剂量范围内均能不同程度增强RAW 264.7细胞的吞噬能力。与空白组相比,0.391,0.781,1.563,6.250 mg/L HEP的吞噬率均显著升高(P<0.05);0.391~6.250 mg/L EHEP的吞噬率均显著升高(P<0.05)。与HEP组相比,0.391 mg/L EHEP的吞噬率显著高于HEP组中所有剂量下的吞噬率(P<0.05)。结果表明,EHEP在促进RAW 264.7细胞吞噬活性方面优于HEP。
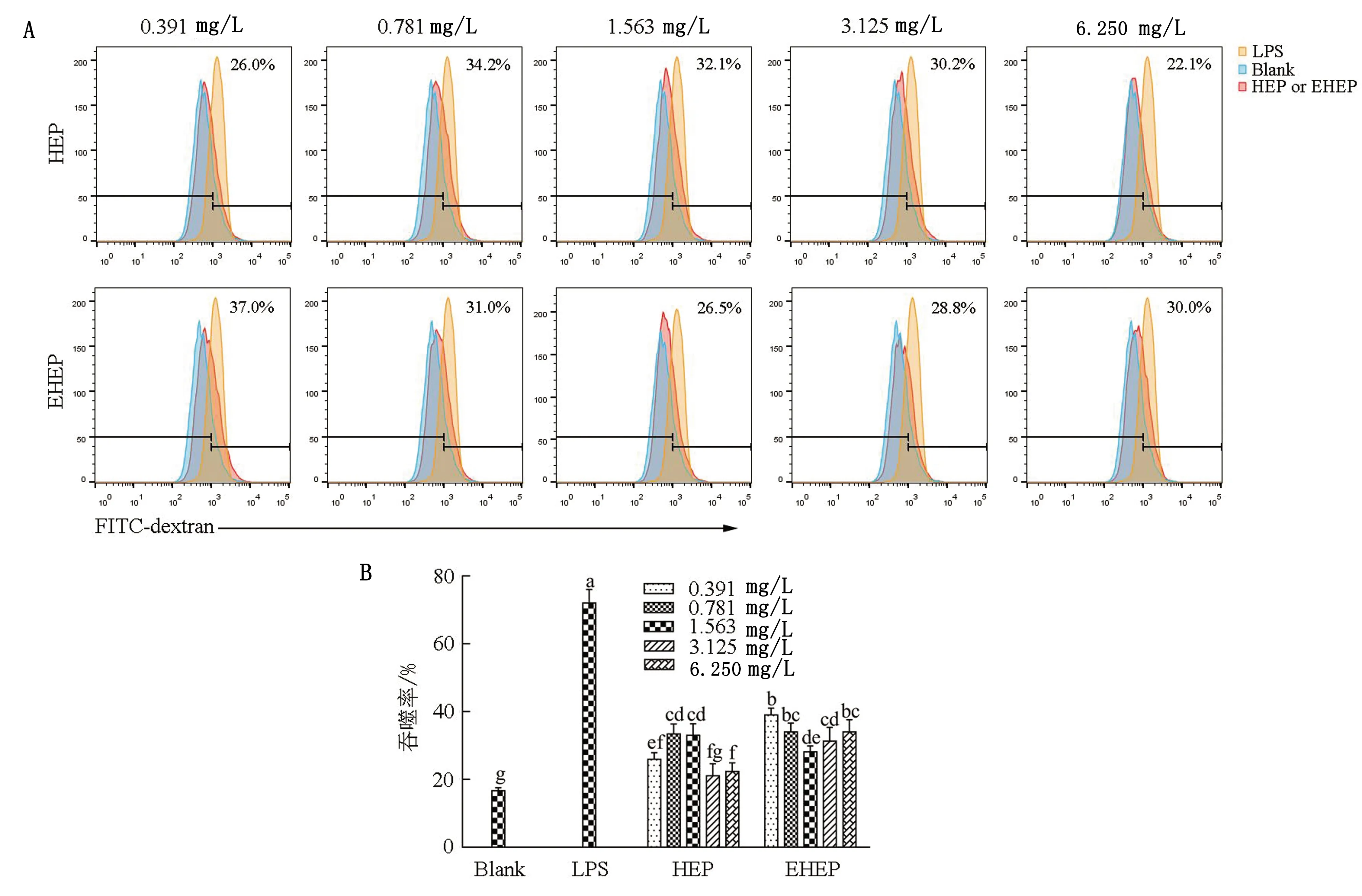
图6 HEP和EHEP对RAW 264.7细胞吞噬功能的影响
2.4.4NO含量 NO即是一种非特异性免疫的免疫分子,也是调节获得性免疫的信使分子,在特异性免疫中发挥重要作用。NO是巨噬细胞发挥吞噬作用的基本条件,其分泌量的多少与巨噬细胞的吞噬能力呈正比。由图7可知,HEP及EHEP在一定质量浓度范围内均可促使RAW 264.7细胞释放NO的量增加,且呈现明显的剂量依赖性。随着质量浓度的增加,HEP对细胞释放NO的量逐渐减少,当HEP的质量浓度增加至3.125,6.250 mg/L时,NO的含量与空白组相比显著降低(P<0.05),而EHEP随着质量浓度的增加对细胞释放NO的量逐渐增多,当EHEP质量浓度增加至6.250 mg/L时,NO的释放量最高,为14.63 mg/L,且显著高于HEP组中所有剂量下的NO含量(P<0.05)。

图7 HEP和EHEP对RAW 264.7细胞生成NO含量的影响
3 讨论
HEP是猴头菇中分离出的一种具有天然活性的物质[15],具有抗氧化、免疫调节、抗肿瘤等[16-18]作用,但其相对分子质量较高,不利于细胞等生物体的吸收[19]。有研究表明[10-11],酶解法降解后的多糖具有较强的生物活性。在本研究中,我们发现EHEP能促进RAW 264.7巨噬细胞分泌NO、CD40和CD86,同时还能增强细胞的吞噬功能,因此可将EHEP作为潜在的免疫增强剂。
众所周知,多糖的结构特征与其生物活性具有密切关系,不同种类的多糖具有不同的结构,因此活性也存在较大的差异。相对分子质量是其具备生物活性的必要条件,多糖具有一定的相对分子质量范围,一般认为相对分子质量在10~500 kDa之间能保持最大活性[20]。若相对分子质量太大,则不利于其跨越细胞膜进入生物体内发挥生物活性作用;若相对分子质量过低,则无法形成产生活性的高级聚合结构[19]。本研究结果显示,采用内切-1,5-α-阿拉伯聚糖酶对HEP进行酶解修饰后,EHEP的相对分子质量为1.25×104kDa。在前期的研究中[4],HEP的相对分子质量为4.3×104kDa,由此可以得出酶解修饰降低了HEP的相对分子质量,这与REN等[11]的研究结果一致。我们推测可能是酶解断裂了HEP的糖链,进一步改变了其空间结构,从而降低HEP的相对分子质量。与HEP的红外光谱相比[4],EHEP在HEP的峰值处均有吸收峰,但在575.85 cm-1处不具有吸收峰,而在928.03 cm-1处具有吡喃环的特征吸收峰,表明酶解对HEP的官能团结构产生了影响。HEP的扫描电镜图显示[4],其形貌棱角分明且表面光滑。在本试验中,EHEP呈现出凹凸不平的褶皱形貌,且表面变得粗糙。HEP属于天然高分子多糖,糖链间通过氢键交联,经过酶解后,导致糖链间氢键交联密度变小,畴结构变大,从而导致表面粗糙度增加,这与报道结果一致[21]。HEP的原子力显微镜图显示[4],HEP的分子链高度为-10.3~10.7 nm,而本研究中EHEP的高度低于HEP,为-10.1~9.5 nm,与秦利鸿等[22]研究结果一致。多糖的生物活性是各级结构之间以及各种理化性质之间相互制约而产生的综合效应[23],AIPIRE等[24]研究表明,乌拉尔甘草多糖是含有α、β糖苷键的多糖,其相对分子质量为1.49×104Da,具有较强的免疫调节作用,这与EHEP的结构特征类似,表明EHEP活性的增强与其各级结构的改变以及相互交联有关。
MTT法可用于检测细胞活性的强弱,细胞的增殖活性与吸光度成正比[25]。因此,确定细胞的安全质量浓度对于后续的研究具有重要作用。在本试验中,0.391~3.125 mg/L HEP和0.391~25.000 mg/L EHEP均可以显著促进RAW 264.7细胞的增殖(P<0.05),为保证试验在同一水平上比较,取0.391,0.781,1.563,3.125,6.250 mg/L 5个剂量考察HEP和EHEP对RAW 264.7细胞的免疫活性作用。
巨噬细胞是机体重要的免疫细胞,主要通过吞噬作用清除侵入体内的病原微生物,在防御感染、自身稳定和免疫监视中都起着重要的作用[26]。研究发现[27],多糖具有增强免疫如活化巨噬细胞的功能,活化的巨噬细胞可分泌NO、CD40和CD86等从而调节免疫作用。NO即是免疫分子又是信使分子,在非特异性免疫和特异性免疫应答中发挥着重要作用。本试验研究结果显示,HEP和EHEP均能促进RAW 264.7细胞NO的释放。与HEP相比,0.391~6.250 mg/L EHEP的NO释放量均显著高于同等剂量下HEP的NO释放量(P<0.05),表明EHEP比HEP更能促进RAW 264.7细胞的活化,这与REN等[28]的研究结果一致。细胞表面共刺激因子在细胞免疫应答中起着重要的作用,而CD分子的活性可以反映出免疫细胞的活化程度,如CD40和CD86。CD40是细胞表面的糖蛋白,主要参与B细胞的生长及分化[29],CD86是CD80的配体,能够和CD80一起调节T细胞的活化,在免疫反应的诱导和调节中起着重要作用[30]。在本试验中,与空白组相比,HEP和EHEP均能促进RAW 264.7细胞表面因子CD40和CD86的表达。6.250 mg/L EHEP的CD40、CD86表达率最高,且显著高于除LPS之外的其他各组(P<0.05)。由此可以得出,EHEP对巨噬细胞的免疫调节作用更强。
吞噬作用是巨噬细胞最重要的功能,可通过吞噬作用将病原微生物清除并维持机体内环境的稳态,其吞噬作用的强弱反映了免疫活性的高低、也可以反映其活化的程度[31]。多糖通过活化巨噬细胞,使其吞噬功能增强,从而调节免疫反应。本研究结果显示,HEP和EHEP均能增强巨噬细胞的吞噬功能,但EHEP表现出更强的吞噬作用,这与CHENG等[32]的研究报道一致。
综上所述,本研究采用内切-1,5-α-阿拉伯聚糖酶对HEP进行酶解修饰,HEP与EHEP作用于巨噬细胞后,EHEP表现出更强的免疫活性,可显著增强巨噬细胞的增殖率,提高细胞表面分子CD40、CD86的表达及吞噬作用,由此可以得出酶解修饰能够显著提高HEP的体外免疫活性,这可能与相对分子质量的降低以及空间结构的变化存在一定的关系[33-34],但其作用机制还有待于深入研究。

