猪伪狂犬病病毒TK/gE/gI缺失株的构建及与Montanide Gel 01佐剂联合免疫效果评价
颜志斌,陈美静,唐 栋,任小波,吴晓燕,纪秋云,刘家齐,何淑菲,琚春梅 (华南农业大学 兽医学院 广东省动物源性人兽共患病预防与控制重点实验室,广东 广州 510642)
伪狂犬病病毒(PRV)属于疱疹病毒科,α疱疹病毒亚科,水痘病毒属[1]。PRV可引起妊娠母猪流产、成年猪的呼吸系统疾病及仔猪的神经系统疾病甚至死亡[2-4]。自2011年以来,在接种了Bartha-K61疫苗的猪群中出现了伪狂犬病(PR)的暴发[5]。经基因组测序研究发现,本轮PR暴发是由新的变异毒株所引起[6]。同时有研究表明,Bartha-K61疫苗不能对新的PRV变异株提供完全有效的保护[7]。因此,迫切需要研发更有效的针对PRV变异株的疫苗以提高猪群的抵抗力。
TK基因是PRV的主要毒力基因,同时也是病毒增殖的非必需基因,缺失后不但可使病毒的毒力大大降低,而且对病毒的增殖特性影响很小[8],因此可以通过缺失TK基因来制备PRV弱毒疫苗。同时,通过添加适当的佐剂,可以使疫苗的免疫效果显著提升。本试验选用的佐剂Montanide Gel 01(MG01)是一种聚合物佐剂,现有研究表明,牛疱疹病毒、大肠杆菌、猪繁殖与呼吸综合征病毒的疫苗与MG01联合使用时,其免疫效果明显增强[9-11]。
1 材料与方法
1.1 毒株与试剂PRV gE/gI双基因缺失突变株rPRV-AH-gE-/gI-为前期研究中所构建[12]。PRV流行毒株PRV-AH[13]、BHK-21细胞、EscherichiacoliDH5α、pEGFP-N1质粒均由华南农业大学兽医学院微生物学教研室保存。限制性内切酶EcoRⅠ、EcoRⅤ、PstⅠ、Hind Ⅲ及pMD18-T均购自TaKaRa公司;转染试剂Lipofectamine 2000 Reagent 购自Invitrogen公司;低熔点琼脂糖购自Sigma公司;病毒DNA提取试剂盒、质粒提取试剂盒、DNA凝胶回收试剂盒、去内毒素质粒提取试剂盒均购自Omega公司;PCR Mix试剂、DNA Marker、无缝克隆试剂盒购自北京擎科生物科技有限公司;DMEM高糖细胞培养基、胎牛血清均购自Gibco公司。
1.2 实验动物4周龄SPF雌性昆明小鼠,购自南方医科大学实验动物中心。
1.3 引物设计以GenBank登录的PRV ZJ01(GI:32187339)基因组为参考序列,用Primer 5.0软件分别设计TK基因的上臂(TK-LA)与下臂(TK-RA)的克隆引物TK-LA-F/TK-LA-R、TK-RA-F/TK-RA-R,及用于TK基因检测的鉴定引物TK-F/TK-R。以GenBank登录的pEGFP-N1(GI:1377911)序列为参考序列,设计出扩增EGFP完整表达盒的无缝克隆引物EGFP-Sosoo-F/EGFP-Sosoo-R(表1)。

表1 PCR引物信息
1.4 重组转移质粒的构建及鉴定分别采用引物TK-LA-F/TK-LA-R、TK-RA-F/TK-RA-R,并以PRV-AH基因组DNA为模板对TK-LA、TK-RA进行PCR扩增。将PCR产物TK-LA与pMD18-T进行连接,得到质粒pMD-TK-LA。将pMD-TK-LA以及PCR产物TK-RA经Pst Ⅰ、Hind Ⅲ双酶切后进行连接,得到质粒pMD-TK-LA-RA。采用引物EGFP-Sosoo-F/EGFP-Sosoo-R,以pEGFP-N1为模板,对EGFP完整表达盒进行克隆。用无缝克隆连接试剂盒将EGFP完整表达盒与pMD-TK-LA-RA进行无缝克隆连接,得到质粒pMD-TK-LA-EGFP-RA(图1A)。将重组转移质粒pMD-TK-LA-RA、pMD-TK-LA-EGFP-RA进行酶切及测序鉴定。
1.5 重组病毒的构建及鉴定采用Lipofectamine 2000 Reagent将pMD-TK-LA-EGFP-RA转染BHK-21细胞中,4 h后将rPRV-AH-gE-/gI-接种已转染细胞,使pMD-TK-LA-EGFP-RA和rPRV-AH-gE-/gI-在BHK-21细胞中进行同源重组。48 h 后收获细胞培养液,再接种于BHK-21细胞中,并进行3~4次的空斑纯化,得到rPRV-AH-TK-/EGFP+/gE-/gI-。将纯化后的rPRV-AH-TK-/EGFP+/gE-/gI-接种于BHK-21细胞中,待细胞病变约90%时收获病毒,并提取病毒DNA。用鉴定引物TK-F/TK-R对病毒DNA进行PCR扩增,将扩增产物进行琼脂糖凝胶电泳检测以及测序鉴定。用上述方法,将pMD-TK-LA-RA与rPRV-AH-TK-/EGFP+/gE-/gI-进行同源重组,空班纯化后得到rPRV-AH-TK-/gE-/gI-,提取病毒DNA进行PCR扩增,然后进行琼脂糖凝胶电泳检测以及测序鉴定。重组病毒rPRV-AH-TK-/gE-/gI-构建图如图1B所示。
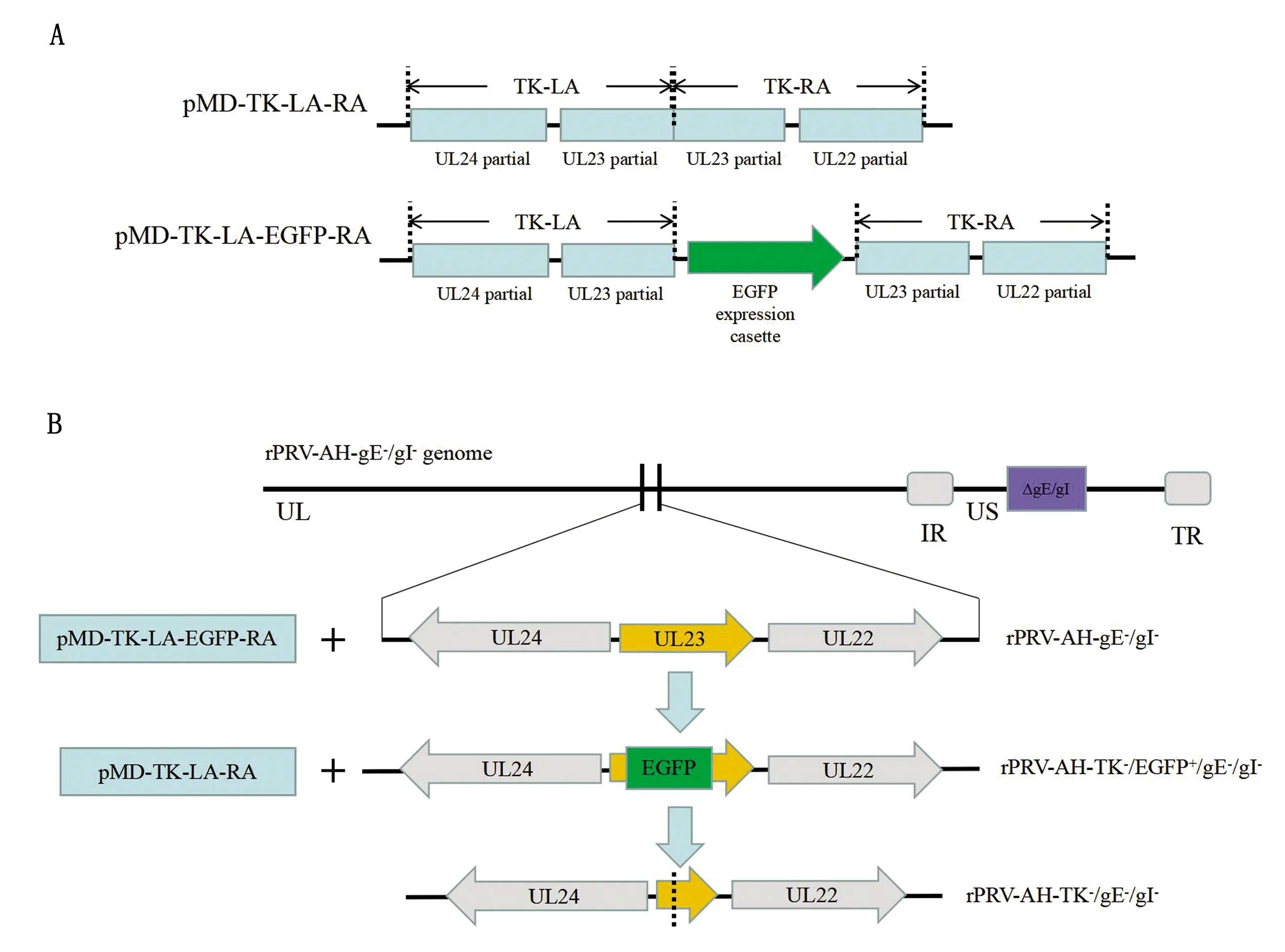
A.质粒pMD-TK-LA-RA与pMD-TK-LA-EGFP-RA的构建;B.重组病毒rPRV-AH-TK-gE-/gI-的构建图1 重组转移质粒与重组病毒的构建图
1.6 重组病毒rPRV-AH-TK-/gE-/gI-的生物学特性
1.6.1重组病毒rPRV-AH-TK-/gE-/gI-的遗传稳定性分析 将rPRV-AH-TK-/gE-/gI-接种于BHK-21细胞中,待细胞病变完全后收获,并接种于新的BHK-21细胞中,如此反复将病毒传代至20代。分别将第1,5,10,15,20代收获的病毒液进行病毒DNA提取,用引物TK-F/TK-R进行PCR扩增,并对PCR产物进行琼脂糖凝胶电泳鉴定。
1.6.2重组病毒rPRV-AH-TK-/gE-/gI-的生长特性测定 将rPRV-AH-TK-/gE-/gI-和PRV-AH以0.01 MOI(multiple of infection)的病毒量接种BHK-21细胞,并于接毒后1,8,16,24,32,40,48,56,64,72 h收获病毒,并对各个时间点的病毒进行滴度测定,用Reed-Muench法计算出TCID50,并根据结果绘制病毒的一步生长曲线。
1.7 动物试验将4周龄昆明小鼠随机分为7组(A~G组),每组8只。A~D组的小鼠分别在后腿肌肉接种106TCID50rPRV-AH-TK-/gE-/gI-、105TCID50rPRV-AH-TK-/gE-/gI-、106TCID50rPRV-AH-TK-/gE-/gI-+MG01、105TCID50rPRV-AH-TK-/gE-/gI-+MG01。E组为商品化弱毒疫苗HB-2000对照组,F组接种DMEM作为未免疫对照组,G组接种DMEM+MG01作为佐剂对照组。A~G组每只小鼠的接种量均为100 μL,MG01佐剂的含量为10%。在试验0,21 d分别对小鼠进行免疫接种。在首免后0,14,28,42 d对小鼠进行采血,并用中和试验检测血清中和抗体水平。在首免后0,2,4,6周分别测量各组小鼠体质量,并计算各组平均体质量。在首免后42 d对小鼠进行PRV-AH强毒攻击,攻毒剂量为106TCID50,攻毒后对小鼠进行14 d的观察,记录小鼠死亡情况并绘制生存曲线。
1.8 统计分析试验数据用GraphPad Prismversion 6.0进行统计分析。通过t检验对不同组别之间的数据进行分析。统计学上显著性分别表示为*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2 结果
2.1 重组转移质粒的鉴定将pMD-TK-LA-RA分别经EcoR Ⅰ、Pst Ⅰ和Pst Ⅰ、Hind Ⅲ双酶切后,进行琼脂糖凝胶电泳,获得片段大小分别为3 829,729 bp和3 428,1 140 bp(图2A),其中729 bp为TK-LA,1 140 bp片段为TK-RA,表明重组转移质粒pMD-TK-LA-RA构建正确。
将pMD-TK-LA-EGFP-RA经EcoR Ⅴ单酶切后,进行琼脂糖凝胶电泳,结果获得片段大小为4 568,1 799 bp(图2B),其中1 799 bp片段为EGFP完整表达盒,表明重组转移质粒pMD-TK-LA-EGFP-RA构建正确。

A.pMD-TK-LA-RA的酶切鉴定(M.DL5000 DNA Marker;1.pMD-TK-LA-RA/EcoR Ⅰ+Pst Ⅰ;2.pMD-TK-LA-RA/Hind Ⅲ+Pst Ⅰ;3.pMD-TK-LA-RA质粒);B.pMD-TK-LA-EGFP-RA的酶切鉴定(M.DL10000 DNA Marker;1.pMD-TK-LA-EGFP-RA;2.pMD-TK-LA-EGFP-RA/EcoR Ⅴ)图2 重组转移质粒酶切鉴定结果
2.2 重组病毒的鉴定重组病毒rPRV-AH-TK-/EGFP+/gE-/gI-、rPRV-AH-TK-/gE-/gI-经空斑纯化后,接种BHK-21细胞,并在荧光显微镜下进行观察。结果显示,rPRV-AH-TK-/EGFP+/gE-/gI-感染细胞发出绿色荧光,而rPRV-AH-TK-/gE-/gI-感染细胞无绿色荧光出现,表明rPRV-AH-TK-/gE-/gI-中已成功缺失EGFP基因(图3)。

a.白光视野;b.紫外光视野图3 重组病毒的荧光鉴定
提取rPRV-AH-TK-/EGFP+/gE-/gI-和rPRV-AH-TK-/gE-/gI-的基因组DNA,并以其为模板,用鉴定引物TK-F/TK-R分别进行PCR扩增,然后进行琼脂糖凝胶电泳,获得条带大小分别为2 159,329 bp(图4),表明rPRV-AH-TK-/EGFP+/gE-/gI-已成功缺失TK基因,并在缺失部位插入筛选标记EGFP基因,rPRV-AH-TK-/gE-/gI-中已成功缺失TK基因和EGFP基因。

M.DL5000 DNA Marker;1.rPRV-AH-TK-/gE-/gI-;2.rPRV-AH-TK-/EGFP+/gE-/gI-;3.PRV-AH;4.BHK-21细胞图4 重组病毒的PCR鉴定
2.3 重组病毒的生物学特性试验取rPRV-AH-TK-/gE-/gI-第1,5,10,15,20代病毒进行DNA提取,并用引物TK-F/TK-R进行PCR扩增及琼脂糖凝胶电泳,结果均获得条带大小为329 bp的片段(图5A),表明重组病毒rPRV-AH-TK-/gE-/gI-具有良好的遗传稳定性。
将rPRV-AH-TK-/gE-/gI-和PRV-AH分别以0.01 MOI接种于BHK-21细胞,接种后于多个时间点收获病毒并进行病毒滴度测定,绘制一步生长曲线。结果显示,rPRV-AH-TK-/gE-/gI-在各时间点上的病毒滴度与亲本毒株PRV-AH相近,经统计学分析无显著性差异(图5B),表明TK基因缺失后,对rPRV-AH-TK-/gE-/gI-的增殖无明显影响。
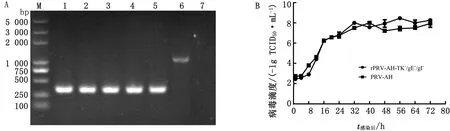
A.rPRV-AH-TK-/gE-/gI-的遗传稳定性检测(M.DL5000 DNA Marker;1~5.第1,5,10,15,20代病毒;6.PRV-AH;7.BHK-21细胞);B.病毒的生长曲线图5 重组病毒rPRV-AH-TK-/gE-/gI-的遗传稳定性及生长曲线
2.4 重组病毒的安全性评价重组病毒rPRV-AH-TK-/gE-/gI-免疫小鼠与其他试验组小鼠在攻毒前均未表现任何临床症状。在首免后0,2,4,6周分别测量各组小鼠体质量,并计算各组平均体质量,结果显示,重组病毒rPRV-AH-TK-/gE-/gI-免疫小鼠与其他试验组小鼠的平均体质量在统计学上差异不显著,表明rPRV-AH-TK-/gE-/gI-作为弱毒疫苗对小鼠是安全的(图6)。
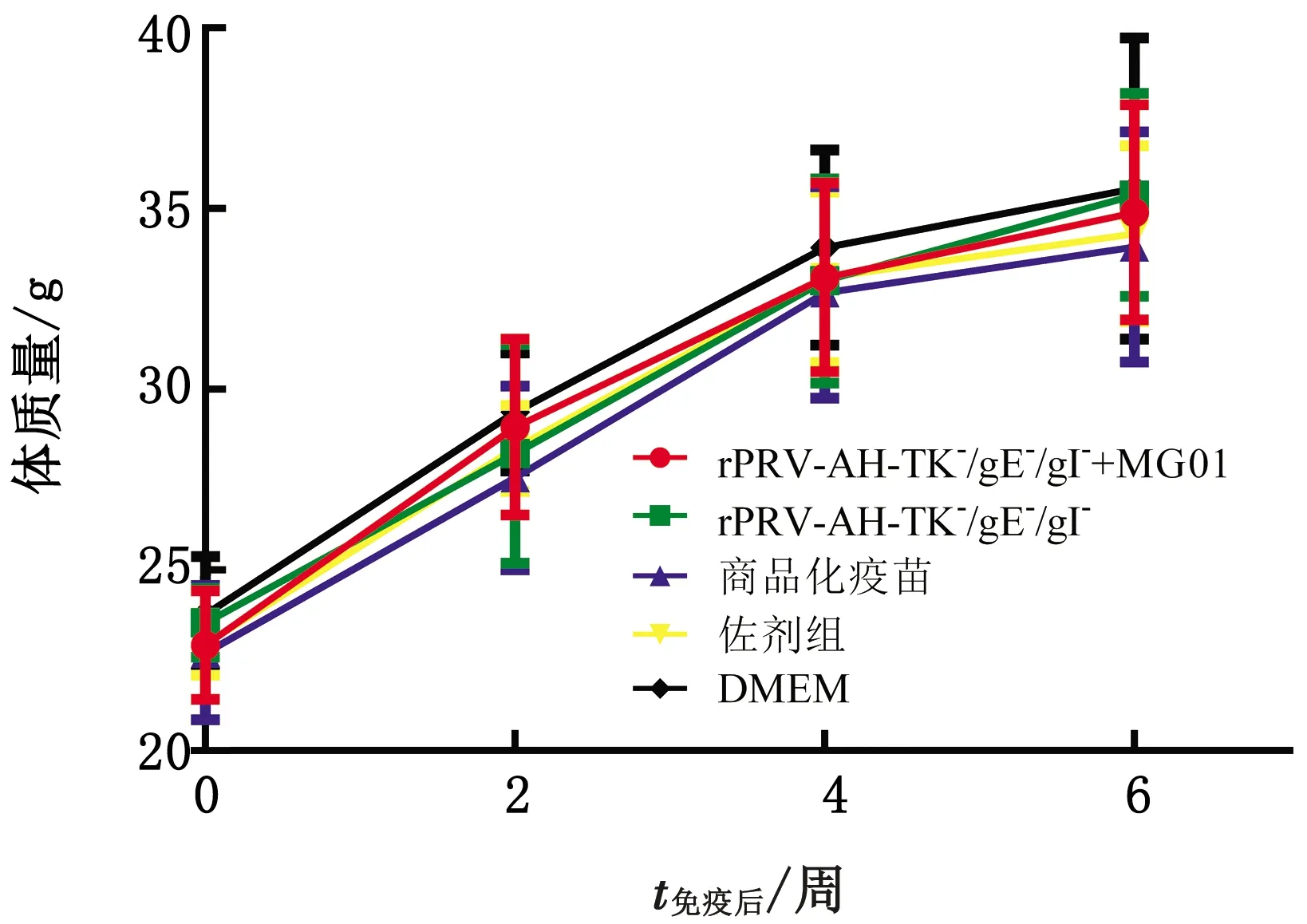
图6 免疫后不同时间各试验组小鼠体质量变化情况
2.5 重组病毒及其与MG01联合免疫效果评价各试验组小鼠中和抗体水平如图7所示。各组小鼠的平均抗体水平在首免后逐渐升高。在首免后42 d时,105TCID50rPRV-AH-TK-/gE-/gI-免疫组抗体水平低于商品疫苗组(P<0.01),而106TCID50rPRV-AH-TK-/gE-/gI-免疫组的抗体水平与商品疫苗组相近。通过与MG01联合免疫,105TCID50rPRV-AH-TK-/gE-/gI-+MG01免疫组的抗体水平与商品疫苗组相近,而106TCID50rPRV-AH-TK-/gE-/gI-+MG01免疫组的平均抗体水平显著高于商品疫苗组(P<0.000 1),约为商品疫苗组的6倍。当免疫剂量为106TCID50时,rPRV-AH-TK-/gE-/gI-+MG01免疫组小鼠的血清抗体水平显著高于rPRV-AH-TK-/gE-/gI-免疫组(P<0.000 1);在免疫剂量为105TCID50时,rPRV-AH-TK-/gE-/gI-+MG01免疫组中和抗体水平略高于rPRV-AH-TK-/gE-/gI-免疫组(P<0.05)。

A~C.分别为首免后14,28,42 d图7 免疫后不同时间各组小鼠血清中和抗体水平检测结果
在首免后42 d,用106TCID50PRV-AH对各组小鼠进行攻毒,攻毒后观察14 d,记录各组小鼠临床症状及死亡时间并绘制生存曲线。结果显示,无论是106TCID50或105TCID50的免疫剂量,在rPRV-AH-TK-/gE-/gI-+MG01联合免疫组,小鼠存活率均为100%。106TCID50rPRV-AH-TK-/gE-/gI-免疫组的存活率为62.5%,而105TCID50rPRV-AH-TK-/gE-/gI-组的存活率仅为12.5%。商品疫苗组的存活率为37.5%,介于106TCID50rPRV-AH-TK-/gE-/gI-免疫组和105TCID50rPRV-AH-TK-/gE-/gI-免疫组之间(图8)。
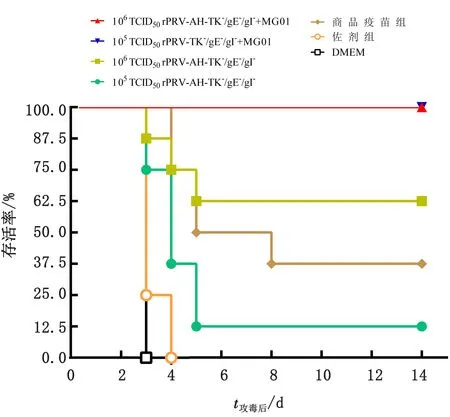
图8 106 TCID50 PRV-AH攻毒后各组小鼠的生存曲线
3 讨论
本研究成功构建了rPRV-AH-TK-/gE-/gI-,结果显示,病毒的TK基因缺失后对其生长特性无显著影响,这也与TK基因的特性一致。从小鼠动物试验结果可以看出,106TCID50rPRV-AH-TK-/gE-/gI-免疫组小鼠无论是中和抗体水平,还是攻毒保护效果均优于105TCID50rPRV-AH-TK-/gE-/gI-免疫组,表明106TCID50rPRV-AH-TK-/gE-/gI-免疫剂量对小鼠的免疫效果更好。在rPRV-AH-TK-/gE-/gI-与MG01联合免疫时,106TCID50免疫剂量诱导的中和抗体水平远高于105TCID50,但两者对106TCID50PRV-AH强毒攻击的保护力均为100%,且均高于rPRV-AH-TK-/gE-/gI-单独免疫组,表明MG01佐剂在提高PRV弱毒疫苗免疫效果方面具有良好的作用,其作用效果与弱毒疫苗免疫剂量密切相关。
综上所述,本研究以PRV变异株为亲本株构建了弱毒疫苗候选毒株 rPRV-AH-TK-/gE-/gI-,并评价了Montanide Gel 01佐剂对rPRV-AH-TK-/gE-/gI-的免疫增强作用效果,研究结果为研制针对PRV变异株的弱毒疫苗奠定了基础,同时结合PRV gE鉴别诊断方法的使用,有利于猪场PR的净化与根除。

