不同程度干旱对温州蜜柑树势和成花生理的影响
黄贝,王鹏,2*,温明霞,吴韶辉,徐建国,2
(1.浙江省柑橘研究所,浙江台州 318026;2.国家柑橘品种改良中心浙江分中心,浙江台州 318026)
柑橘花芽形成是营养生长向生殖生长转变的重要标志[1],这一过程包含形态学、生理学、遗传表达等多方面的复杂变化。柑橘实生苗童期长达3~8年,其间花芽分化受阻,只进行营养生长,但嫁接的枝条经过诱导,次年便可形成花芽,进入生殖生长[2]。花芽是否成功分化直接影响柑橘的挂果量和后期果实品质,对果树大小年的控制有极大的意义。充足的养分积累有利于树势的保持,水分供应是植物生长代谢的物质基础,花芽分化期间需要适当的水肥供应。生产上通过控制水分对果树的发育周期进行调节,柠檬[3-4]、金柑和四季橘[5]在水分调控作用下实现全年多次集中开花,具有可观的经济效益。李文庆等[6]曾在干旱条件下研究砂糖橘花芽分化与形成,发现干旱可以诱导砂糖橘花芽分化提前,且在不同强度干旱处理下花芽萌发率皆高于对照组,开花树比例及成花数量均随诱导时间延长而增加。柑橘花芽生理分化过程伴随着一系列成花相关基因的表达,并受转录因子转录水平和表观调控的影响。同源FLOWERING LOCUS T(FT)基因产物在多数植物体内被认定为“成花素”,NISHIKAWA等克隆了温州蜜柑成花同源基因FT,并在后续实验中验证了FT基因转录水平的高低可以作为评估柑橘花芽分化是否形成和完全的指标[7-8]。PILLITTERI等[9]曾报道甜橙花芽形成末期APETALA1(AP1)转录水平增加明显,并认为AP1蛋白参与甜橙开花器官的发育,因而推测温州蜜柑在花芽形态学形成期间AP1基因转录水平会显著性增加。目前,柑橘干旱胁迫方面的研究大多集中于处理后对树势生理和果实品质的影响,而干旱促进柑橘成花方面的研究还比较少。本实验通过设置多种干旱处理,追踪处理后植株成花状态,检测树体生理参数和成花相关基因FT和AP1的表达量,明确何种处理对温州蜜柑两年生嫁接苗成花诱导效果最好。该研究结果可对干旱调控成花技术的开发及其在柑橘设施生产中的应用提供理论支持。
1 材料与方法
1.1 实验材料与生长环境
选取长势一致的两年生温州蜜柑‘由良’(Citrus unshiu‘Yura’)嫁接容器苗植株并带土移栽入44 cm×33 cm×25 cm 的塑料盆中,于2019 年4 月置于浙江省柑橘研究所实验基地避雨棚内生长,样品随机区组排列。2019 年9 月20 日开始进行干旱胁迫,除水分外,其他栽培管理措施均保持一致。制作切片的腋芽采集时间为2020 年3 月9 日,每个处理组重复取样2 次;用作基因检测和生理指标测定的新梢叶片和茎的采集统一在干旱设定时间结束后上午10:00左右,每组样品重复取样3次,擦净表面污物,立即投入液氮中,带回实验室于-80 ℃条件下保存,备用。
1.2 干旱胁迫程度的确立与保持
干旱处理前正常浇水管理4 个月以恢复树势,实验开始前将参试的盆栽苗浇透,待含水量下降到预设值时开始进行实验。据前人测定,柑橘根系生长适宜的土壤(绝对)含水量为17%~18%[10],本实验根据土壤水分含量不同设对照(CK,土壤含水量为15%~20%)、轻度干旱(12%~15%)、中度干旱(8%~10%)和重度干旱(4%~6%)4 个处理水平,每个处理设置3 个生物学重复。每天上午9:00 用农业环境监测仪(浙江托普云农科技股份有限公司)测定柑橘根围3个不同位置的土壤含水量,并根据每日测定数据和耗水量,定时定量浇水,使之维持在设定的土壤水分波动范围内。实验处理时间为20、30 和40 d,每个处理组设3 个生物学平行实验。不同的干旱处理结束之后,皆对盆栽进行正常的水分管理,使之恢复树势。
1.3 干旱处理结束后对温州蜜柑花芽形态分化、开花及坐果的追踪
2020 年花芽形态学观察从现蕾期持续到盛花期结束,并统计坐果率。
1.4 石蜡切片的制作
经甲醛-乙酸-乙醇(formaldehyde-acetic acidethanol, FAA)固定之后的腋芽用于植物切片的制作[11],染色液为爱氏苏木精染液,切片完成后直接脱蜡、封片,最后用BX43显微摄影机(日本OLYMPUS株式会社)进行观察摄影。
1.5 温州蜜柑生理指标的检测
叶绿素a和叶绿素b的含量用分光光度法测定,检测波长分别为645和663 nm,根据经验公式可计算得叶绿素a和叶绿素b以及总叶绿素含量[12];可溶性糖含量的测定采用蒽酮法[13],检测波长为625 nm;可溶性蛋白质含量的测定采用2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid hydrate disodium salt,BCA)法[14],检测波长为562 nm。以上检测试剂盒均购自江苏科铭生物技术有限公司。
1.6 温州蜜柑FT 及AP1 基因转录水平定量分析
以NCBI网站(https://www.ncbi.nlm.nih.gov/)上登录的柑橘属甜橙(Citrus sinensis)、温州蜜柑、枳(Poncirus trifoliata)的同源cDNA 为模板,结合甜橙基因组数据库序列信息克隆FT和AP1基因的保守区域序列,序列信息见附图1(http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2020.12.251)。再用Premier Primer 软件设计特异性定量聚合酶链反应(polymerase chain reaction, PCR)引物,引物序列信息为:Actin-F,TTCTTTCCTTGTATGCGAGTG;Actin-R,ATAGTCAAGAGCGATGTAAGC。FT-F,CGGCAACTTGGAAGGCAGAC;FT-R,GGAGGT CCCAGATTGTAAAG。AP1-F,TTTCTACTTCCA CAGCCACCTC;AP1-R,CAAAGCATCCAAGGCT ACAC。RNA的提取采用TransZol Up Plus RNA试剂盒,模板反转录采用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒进行,采用实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测试剂盒Perfect Start Green qPCR SuperMix 进行定量检测,以上试剂盒均购自北京全氏金生物技术有限公司;选用β-actin作为内参基因;目的基因的相对表达水平用2-ΔΔCT的方法进行分析[15]。qRT-PCR 扩增程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,39 个循环。扩增结束后于65~95 ℃之间做熔解曲线分析。
1.7 数据统计与分析
采用Excel 2016 对数据进行整理,利用GraphPad Prism 8.0.2 软件对数据进行差异显著性分析,并制图。
2 结果与分析
2.1 土壤水分的维持
干旱期间土壤水分记录如图1 所示。经统计,对照组保持设定水分39 d,轻度干旱组保持设定水分36 d,中度干旱组保持设定水分38 d,重度干旱组保持设定水分39 d,基本满足土壤干旱设定条件。

图1 控水处理期间盆栽土壤绝对含水量Fig.1 Soil moisture of pot plants during the period of controlling the watering
2.2 干旱胁迫对温州蜜柑花芽形态分化的影响
柑橘花芽形态分化时期分为5个过程:初期、萼片期(S期)、花瓣期(P期)、雄蕊期和雌蕊期(ST期)。对不同处理组间腋芽切片显微观察发现,干旱胁迫30 d组形态分化较其他干旱胁迫时间更早,因此,本文只展示干旱胁迫30 d 处理组。如图2 所示,轻度干旱和重度干旱30 d 的腋芽处于花芽分化初期状态,而中度干旱组植株的萼片和花瓣原基显现。继续追踪植株花芽分化情况,2019年4月3日中度干旱胁迫30 d处理组最先露白,花苞萌发且开放最早(图3),花期相比CK组提前9 d,进一步直观证实中度干旱胁迫30 d处理最有利于温州蜜柑花芽分化。
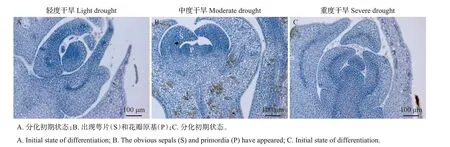
图2 不同程度干旱胁迫30 d组温州蜜柑花芽分化的形态特征Fig.2 Flower bud differentiation’s morphological characteristics of the Satsuma mandarin in different degrees of drought stress for 30 d group

图3 不同程度干旱胁迫30 d组与CK组的温州蜜柑花序发育特征Fig.3 Inflorescence developmental characteristics of the Satsuma mandarin in different degrees of drought stress for 30 d and CK groups
2.3 干旱胁迫对温州蜜柑花枝类型和坐果率的影响
对不同程度干旱胁迫30 d 的温州蜜柑植株在盛花期的花枝类型和二次生理落果后的坐果率进行统计,结果如图4所示:干旱处理后温州蜜柑有叶花枝的比例有所增加,坐果率稍微下降。

图4 不同程度干旱胁迫30 d组与CK组温州蜜柑花枝和坐果率的统计Fig.4 Statistics of flower branches and fruit setting rates of the Satsuma mandarin in different degrees of drought stress for 30 d and CK groups
2.4 干旱胁迫对温州蜜柑茎和叶片生理参数的影响
2.4.1 干旱胁迫对温州蜜柑茎和叶片叶绿素含量的影响
随着干旱胁迫强度的增加和时间的延长,温州蜜柑茎和叶的叶绿素含量变化如图5 所示。其中:轻度和中度干旱胁迫20 d组植株茎中叶绿素a的含量与CK 相比显著下降,其他组叶绿素a、叶绿素b及总叶绿素含量未表现出显著变化(图5A1~A3);所有重度干旱处理组叶片中叶绿素a 含量与CK 相比均有显著升高,而叶绿素b和总叶绿素含量与CK相比无显著性差异(图5B1~B3)。叶绿素a/b的比值可以反映捕光复合体Ⅱ(light harvesting complexⅡ,LHCⅡ)在所有含叶绿素结构中所占的比值,其值升高表明LHCⅡ含量减少。与对照组相比,轻度和中度干旱胁迫20 d,茎中叶绿素a/b的比值明显下降,说明茎中LHCⅡ的占比有所增加,且随着处理时间延长,处理组叶绿素a/b 的值与CK 组持平,无显著性差异(图5A4);叶片中叶绿素a/b的比值在干旱胁迫20 和30 d 组都较CK 组有不同程度的上升,叶片中LHCⅡ的占比减少,说明叶片中叶绿素结构较茎更易受干旱胁迫的破坏(图5B4)。

图5 不同程度干旱胁迫下温州蜜柑茎(A1~A4)和叶片(B1~B4)叶绿素a、叶绿素b、总叶绿素的含量以及叶绿素a/b的比值Fig.5 Chlorophyll a,chlorophyll b and total chlorophyll contents and ratio of chlorophyll a/b in stems(A1-A4)and leaves(B1-B4)of the Satsuma mandarin under different drought stress treatments
2.4.2 干旱胁迫对温州蜜柑可溶性糖与可溶性蛋白质含量的影响
干旱胁迫期间,叶片中淀粉水解为单糖,可溶性糖的增加有利于植物抵抗逆境。茎中可溶性糖含量随着干旱强度和时间的积累有升高趋势,重度干旱处理组与其他处理组相比差异显著(图6A);叶片中可溶性糖含量随着干旱强度和时间的积累而增加,但相对于CK组,稍有下降(图6B)。在干旱胁迫期间,蛋白质合成受阻,分解过程加强,茎中可溶性蛋白质含量为重度干旱胁迫40 d组比CK组显著升高(图6C);叶片中可溶性蛋白质含量变化没有表现出显著性差异(图6D)。

图6 不同程度干旱胁迫下温州蜜柑茎和叶片可溶性糖和可溶性蛋白质的含量Fig.6 Contents of soluble sugar and soluble protein in stems and leaves of the Satsuma mandarin under different drought stress treatments
2.5 干旱胁迫对温州蜜柑成花相关基因转录水平的影响
NISHIKAWA 等[7-8]在温州蜜柑体内克隆出了“成花素”基因FT的3 个转录本,并证实FT基因的表达量可以反映柑橘花芽分化进程。本实验检测了不同干旱胁迫下温州蜜柑茎和叶片中FT基因的相对表达量,结果显示:不同干旱条件下茎中FT的表达量与CK组相比有不同程度上升(图7A),其中在30 d 处理组中,随着干旱强度增加,植株茎中FT的表达量逐步上升,且皆达到显著差异水平;叶片中FT的表达量随着干旱程度和处理时间的延长逐渐上升,处理30 和40 d 组均能够明显诱导FT基因的表达加强,与CK 组相比表达倍数差异在2~12之间(图7B)。但总的来说,植株干旱处理30 d 后,茎中FT基因的表达量比叶片中高2~3 倍。PILLITTERI 等[9]报道甜橙在开花诱导末期AP1转录水平增加明显,并认为AP1参与了开花器官的发育。对干旱处理之后温州蜜柑茎和叶片AP1基因的表达进行定量分析,发现干旱30 d温州蜜柑茎和叶片中AP1基因的表达量明显高于其他处理组(图7C~D)。

图7 不同程度干旱胁迫下温州蜜柑茎(A、C)和叶片(B、D)FT和AP1基因的相对表达量Fig.7 Relative expression levels of FT and AP1 in stems(A and C)and leaves(B and D)of the Satsuma mandarin under different drought stress treatments
3 讨论
3.1 干旱胁迫对温州蜜柑成花生理的影响
石蜡切片显微观察发现,中度干旱胁迫30 d的花芽形态分化最早,开放最早,这一结果与大量研究表明的适度干旱促进柑橘花芽生理分化提前的结果[3]一致。对有叶花枝统计数据分析发现,中度干旱胁迫30 d组有叶花枝数比CK组有一定程度的增加,这一结果与暗柳橙在适度干旱条件下有叶花枝增多的情况相吻合[16]。干旱处理组坐果率没有显著下降,仍在温州蜜柑正常栽培的坐果率范围内。这可能与温州蜜柑是栽培适应性较强的品种有关,同时也说明中度干旱(土壤含水量8%~10%)胁迫30 d是一个促进温州蜜柑花芽提前分化较优的处理手段。
3.2 干旱胁迫对温州蜜柑树势生理的影响
在不同土壤水分条件下对植株进行干旱胁迫,发现随着干旱胁迫强度的增加和时间的延长,温州蜜柑茎中叶绿素a 含量与CK 相比都有不同程度的下降。茎是水分和营养素的运输器官,对水分缺失更为敏感,因而茎中叶绿素含量变化较大;叶片叶绿素a含量与CK相比呈上升趋势,有可能因为植株在干旱条件下对水分的利用更充分[17]。肖玉明等[18]以土壤最大持水量40%对温州蜜柑进行水分胁迫实验,处理结果显示,在10~40 d之间,随着时间的积累,温州蜜柑叶片叶绿素含量升高,40 d以后叶绿素各成分含量呈现下降趋势,这也说明干旱处理时间不宜超过40 d,否则对树势和叶片有较强伤害。叶绿素a/b 的比值在一定程度上与捕光复合体(LHCⅡ)含量成反比。本研究发现,与对照组相比各处理组茎中叶绿素a/b 的比值在干旱早期上升,并最终维持在1.4 左右的水平,与CK 组相当,而在不同干旱条件下叶片叶绿素a/b的比值在干旱早中期皆高于对照组,后期稳定于2.0 左右。这说明植株叶片捕光复合体在减少,通过减少色素和捕光复合体的含量来降低叶片对光能的捕获,降低光合机构受光氧化破坏的风险[19]。由此推断,干旱胁迫30 d 对温州蜜柑的光合生理不会产生严重负面影响。可溶性糖和可溶性蛋白质含量上升,能增加越冬植株碳水化合物的积累,利于树势的维持,从而有助于植株花芽分化和满足翌年植株开花对养分的需求。温州蜜柑经干旱处理后茎中可溶性糖和可溶性蛋白质含量随着干旱时间的延长而增加,这一结论与大量干旱抗性生理研究报道的结果[20-21]一致。叶片中可溶性糖和可溶性蛋白质含量在干旱初期表现为不同程度的下降,可能是因为叶片作为光合器官,且所受的蒸腾拉力较强,叶片变化更为敏锐,但随着干旱处理时间延长和强度增加,植株对干旱胁迫表现出一定的适应性,叶片可以通过内部生理机制调节可溶性糖和可溶性蛋白质含量,以维持中长期干旱条件下的生命活动。总的来说,除了重度干旱条件下茎中叶绿素含量出现显著下降趋势外,轻度和中度干旱处理对植株的生理代谢并未造成严重影响,植株能够通过抗逆调节机制充分应对。
3.3 成花相关基因响应干旱对花芽的诱导
干旱胁迫可诱导柑橘花芽生理分化提前,成花基因FT和AP1转录水平表达量增加。FT的3 条不同转录本保守区域高度一致[7],检测FT相对表达量的总量显示干旱胁迫30 d组茎中FT的表达量最高,这一结果与前人建议以柑橘茎中FT基因相对表达量作为衡量花芽分化程度的结论[8]一致。AP1是植物花芽分生组织建立的重要基因[9],中度干旱胁迫30 d 时其表达量最高,表明该环境条件最有利于温州蜜柑花芽分生组织的建立,从分子水平上进一步验证了中度干旱胁迫30 d 是促进温州蜜柑植株成花的合理选择。
4 结论
本研究综合比较了3个不同干旱胁迫强度与时间的温州蜜柑处理组,发现中度干旱(土壤含水量8%~10%)30 d处理不会对植株树势造成不可逆的伤害,且早花现象最明显;基因表达分析也表明茎中“成花素”FT相对表达量处于较高水平,花芽分生组织特有基因AP1相对表达量达到最大值,说明中度干旱胁迫30 d对温州蜜柑花芽分生组织的形成具有较强的诱导效应。这一结果对温州蜜柑设施栽培生产中应用控水调节开花具有较强的指导意义。

