广西涠洲岛柳珊瑚共附生真菌多样性及其抑菌活性*
陆春菊, 陆玫霖, 刘昕明, 刘永宏,2, 高程海, 徐新亚
1. 广西中医药大学海洋药物研究院, 广西 南宁 530200;
2. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广东省海洋药物重点实验室, 广东 广州510301
珊瑚礁生态系统被称为“海洋中的热带雨林”和“蓝色沙漠中的绿洲”, 是地球上生物多样性最丰富的生态系统之一(赵美霞 等, 2006)。除了鱼类和底栖无脊椎动物, 珊瑚还共生或附生有大量的海洋微生物。海洋微生物与珊瑚宿主共生互利, 协同进化,对于维持珊瑚正常的生理生态功能、抵御珊瑚病害有重要的作用(黄峰 等, 2019)。并且海洋微生物通常具有抗菌、抗肿瘤等多种生物活性, 是新型功能基因和新型活性肽的重要来源, 也是开发新型药物的重要资源(Zhang et al, 2007; Qin et al, 2014;Carroll et al, 2020)。
涠洲岛地处北部湾海域, 是我国最大、最年轻的火山喷发堆积形成的岛屿, 具有热带季风气候。涠洲岛附近海域分布有大量的珊瑚礁, 属于世界珊瑚礁分布的北缘, 分布有底栖生物279种, 鱼类80种(王文欢 等, 2016)。涠洲岛珊瑚共附生微生物多样性的研究较少。高程海等研究了涠洲岛柳珊瑚Anthogorgia caerulea可培养共附生细菌多样性, 获得了90株海洋细菌, 并筛选到5株抑制海洋生物污损细菌和污损生物附生的芽孢杆菌属(Bacillussp.)活性菌株(方燕 等, 2012), 并从该柳珊瑚中分离鉴定了2个亚纲9科9属23种放线菌, 发现其中10株放线菌有较强的生物毒活性(杨小梅 等, 2014)。涠洲岛珊瑚共附生真菌的研究仅有一篇报道。王亚楠(2012)研究了涠洲岛海域的10种柳珊瑚的共附生微生物多样性, 分离了柳珊瑚共附生海洋真菌242株, 细菌82株。青霉属(Penicillium)、枝孢属(Cladosporium)、曲霉属(Aspergillus)是柳珊瑚共附生海洋真菌中分离频率最多的优势属(王亚楠,2012)。本研究考察了涠洲岛珊瑚礁真菌多样性及其抗菌活性。
1 材料和方法
1.1 材料
1.1.1 柳珊瑚样本来源
珊瑚样本采自广西涠洲岛海域, 在水下装入无菌封口袋密封, 置于冰盒中保存, 运输至实验室后用于真菌的分离和鉴定。珊瑚样本由广西中医药大学海洋药物研究院高程海研究员鉴定为网状软柳珊瑚Subergorgia reticulata、Anthogorgiasp.和日本红珊瑚Corallium japonicum。
1.1.2 指示菌种类
指示菌包括两种水产养殖致病菌——无乳链球菌(Streptococcus agalactiaeATCC51487, SA)和海豚链球菌(Streptococcus iniaeATCC29178, SI);两种人类致病菌——表皮葡萄球菌(Staphylococcus epidermidisATCC12228, SE)和耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureusATCC43300, MRSA), 均由华南农业大学海洋学院张晓勇副教授惠赠。
1.1.3 培养基配制
使用的培养基配方如下所示。均经121℃高温高压灭菌30min后使用。
虎红培养基(RBM): 蛋白胨5.0g, 葡萄糖10.0g,KH2PO41.0g, MgSO40.5g, 孟加拉红 0.033g, 琼脂粉 15.0g, 氯霉素0.1g, 人工海水1000mL。
马铃薯葡萄糖琼脂培养基(PDA): 马铃薯提取粉 6.0g, 葡萄糖 20.0g, 琼脂粉 15.0g, 氯霉素0.1g,人工海水1000mL。
查氏琼脂培养基(CDA): NaNO33.0g, K2HPO41.0g, MgSO40.5g, KCl 0.5g, FeSO40.01g, 蔗糖30.0g, 琼脂粉15.0g, 氯霉素0.1g, 人工海水1000mL。
沙氏培养基(SDA): 蛋白胨10g, 琼脂 20g,葡萄糖40g, 氯霉素0.1g, 人工海水1000mL。
真菌2号培养基: 甘露醇20g, 酵母膏3g,MgSO40.3g, 谷氨酸钠10g, 葡萄糖10g, KH2PO40.5g, 麦芽糖20g, 人工海水1000mL。
LB培养基: 胰蛋白胨10g, 酵母提取物5g, 氯化钠10g, 水1000mL, 调节pH至7.4。
1.1.4 真菌分离培养
柳珊瑚样品在超净工作台中用75%乙醇淋洗1次后, 再用无菌海水淋洗3次, 在研钵中剪碎, 研磨成匀浆, 得到样品原浆。用无菌海水按1:5、1:10、1:100的比例稀释后, 分别吸取100μL稀释液加入RBM、CDA、PDA、SDA培养基平板中, 用无菌涂布棒涂布均匀后, 封口, 放入28℃恒温培养箱中培养。在培养过程中, 反复用灭菌竹签挑取单菌落接种于PDA培养基上, 纯化菌株。
1.1.5 真菌鉴定
在超净工作台中从培养平板上刮取一定量菌丝体和孢子, 放入无菌的2mL离心管中, 密封后送至昊天(广州)生物公司进行ITS-rDNA测序。PCR扩增使用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)。所有测序结果使用seqman软件分析剪切, 在NCBI通过序列比对引擎BLAST, 将测序得到的基因序列与GenBank数据库中序列进行比对分析。结合形态学观察和序列比对结果对真菌进行排重, 将排重后真菌的基因序列上传到GenBank, 获取登录号。基于MEGA-X软件中的邻接法(Neighbor-Joining, N-J)构建柳珊瑚共附生真菌的系统发育树(Kumar et al, 2018)。
1.1.6 真菌发酵液粗提物制备
将纯培养所得菌株接种于真菌2号培养基中,28℃, 180r·min-1震荡培养7d。等体积乙酸乙酯浸泡,40kHz超声提取20min, 真空抽滤, 静置分层, 弃去水层, 乙酸乙酯层减压浓缩后得到提取物。提取物用二甲基亚砜(dimethyl sulfoxide, DMSO)溶液溶解,配置成20mg·mL-1的样品液, 备用。
1.1.7 抑菌活性筛选
采用96孔板法测定样品对表皮葡萄球菌、无乳链球菌、海豚链球菌3种指示菌的抑菌活性。活化后的指示菌接种于LB培养基, 30℃, 180r·min-1震荡培养至对数生长期, 调整菌悬液浓度为每毫升含有106个菌落形成单位(colony forming units, CFU)。用移液枪吸取195μL菌悬液, 加入96孔板, 再加入5μL样品液,摇匀密封后, 于30℃培养箱中培养24h, 使用酶标仪于600nm条件下测定OD值。以初浓度为1mg·mL-1的青霉素G为阳性对照; 同时设置阴性对照和空白对照, 每个样品设置3个平行样。样品抑菌活性结果用抑制率表示。抑制率=(空白值-样品值)/空白值×100%。
1.1.8 抗生物膜活性筛选
采用结晶紫染色法测定抑制耐甲氧西林金黄色葡萄球菌和表皮葡萄球菌生物被膜形成活性。活化后指示菌接种于LB培养基, 30℃, 180r·min-1震荡培养至对数生长期, 调整菌悬液浓度为106CFU·mL-1。用移液枪吸取195μL菌悬液, 加入96孔板, 再加入5μL各浓度样品液, 摇匀密封后, 于培养箱中培养24h。倾去菌液, 水洗2遍, 60℃烘干。加入0.5%结晶紫200μL, 染色30min。倾去结晶紫溶液, 水洗2遍, 60℃烘干。加入30%乙酸200μL溶解, 静置30min后于酶标仪540nm波长测定OD值。样品抑菌活性结果用半数最小抑菌浓度表示。半数最小抑菌浓度为抑制50%受试菌所需最小抑菌浓度(50%minimal inhibitory concentration, MIC50)。样品抗生物被膜活性结果用半数效应浓度(median effect concentration, EC50)表示。
2 结果和分析
2.1 可培养真菌的分离结果
采集广西北部湾涠洲岛海域10株柳珊瑚, 对柳珊瑚新鲜组织样本进行共附生真菌的分离纯化, 得到191株可培养共附生海洋真菌(表1), RBM培养基分离得到60株真菌, 数量最多, 占总分离菌株33.03%。
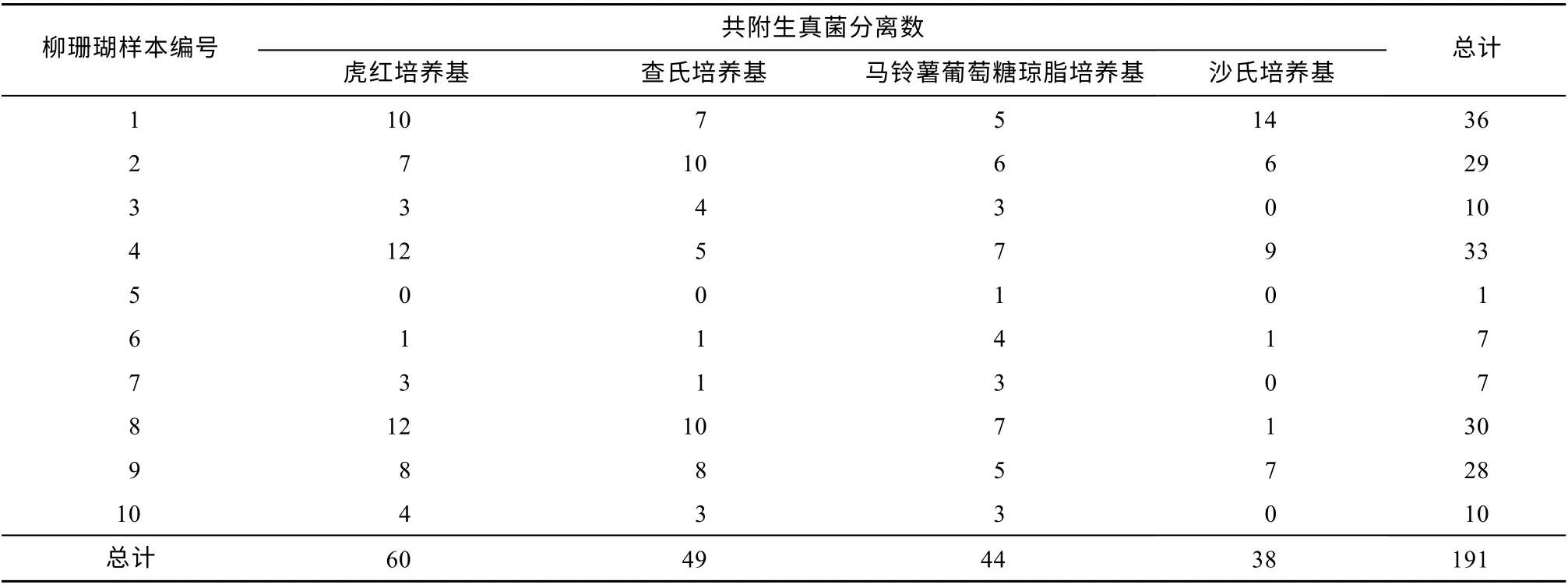
表1 10株柳珊瑚共附生真菌的分离数量Tab. 1 Numbers of isolates from the 10 gorgonians
2.2 可培养真菌的多样性
从10株柳珊瑚共计分离得到191株纯培养真菌,形态学结合ITS序列比对排重后得到26个种属共附生海洋真菌(表2), 基于N-J法构建系统发育树(图1)。菌株的ITS序列经 BALST检索, 均能找到相似度97%以上的匹配序列。基于ITS序列比对分析, 26种真菌分布于子囊菌门的5目6属: 散囊菌目(Eurotiales)的曲霉属(Aspergillus)和青霉属(Penicillium)、格孢菌目(Pleosporales)的链格孢属(Alternaria)、枝孢菌目(Capnodiales)的枝孢菌属(Cladosporium)、假毛球壳目(Trichosphaeriales)的黑孢霉属(Nigrospora)和肉座菌目(Hypocreales)的(Parengyodontium)。有18种为曲霉属真菌, 表明曲霉属(Aspergillus)为广西北部湾柳珊瑚可培养共附生真菌的优势属, 占总菌株种类的69.23%, 次优属为枝孢菌属(Cladosporium)。

图1 基于N-J法对26株柳珊瑚共附生真菌的ITS-rDNA序列构建系统发育树Fig. 1 Neighbor-Joining tree based on fungal ITS-rDNA sequences of 26 fungal isolates
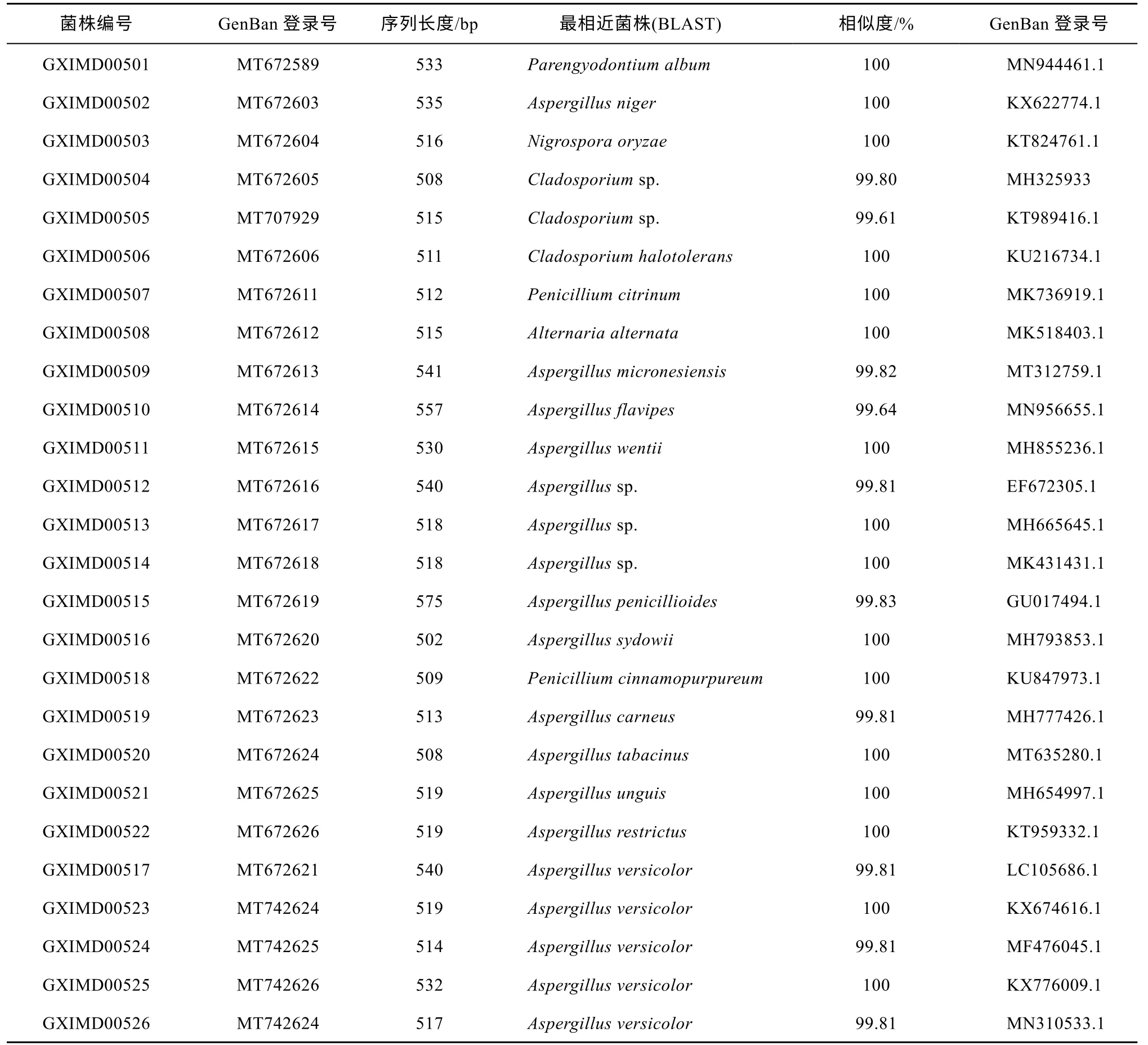
表2 基于ITS序列分析鉴定的柳珊瑚共附生真菌Tab. 1 Identification of fungal strains isolated from gorgonians based on DNA analysis of the ITS region
2.3 抑菌活性筛选
26株柳珊瑚共附生真菌进行液体发酵, 制备乙酸乙酯粗浸膏, 进行抑菌活性筛选, 在浓度为400μg·mL-1时, 发现有11种真菌至少对一种指示菌具有抑制作用, 占菌株总数的42.31% (表3)。其中菌株Penicillium citrinumGXIMD00507,Penicillium cinnamopurpureumGXIMD00518和Aspergillus unguisGXIMD00521对3种指示菌具有较好抑制作用, 抑制率高于75%。
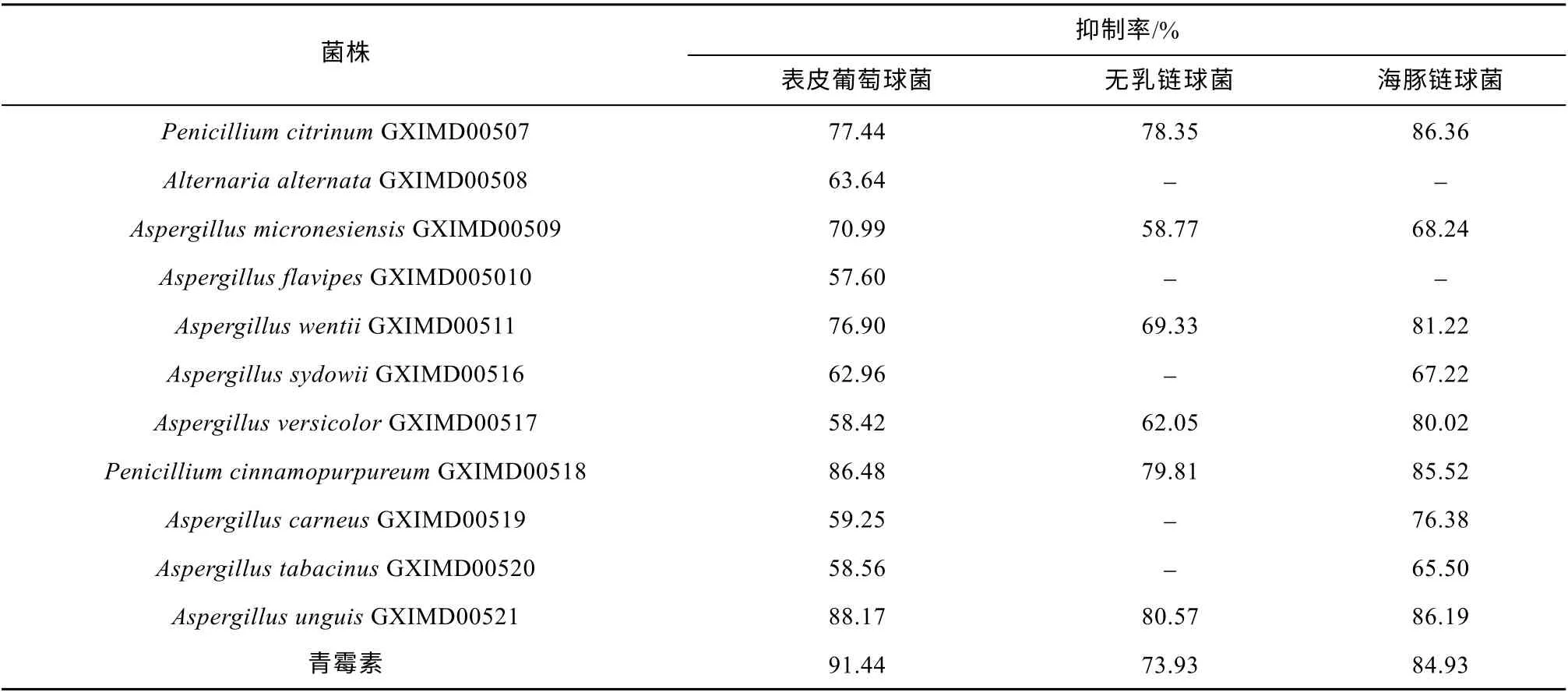
表3 真菌发酵液乙酸乙酯提取物抑制细菌活性实验结果Tab. 3 Antibacterial activities of ethyl acetate (EtOAc) extracts from fermentation broth of the gorgonian-derived fungal strains
2.4 抗生物被膜活性筛选
26株海洋真菌发酵液乙酸乙酯提取物进行抗细菌生物被膜实验(表4), 发现有7株真菌对表皮葡萄球菌表现出抗生物被膜活性, 占菌株总数的27%,EC50浓度范围为40.3~155μg·mL-1。菌株P.cinnamopurpureumGXIMD00518和A. carneusGXIMD00519有抗MRSA生物被膜形成活性, EC50值分别为105.4μg·mL-1和117.4μg·mL-1。
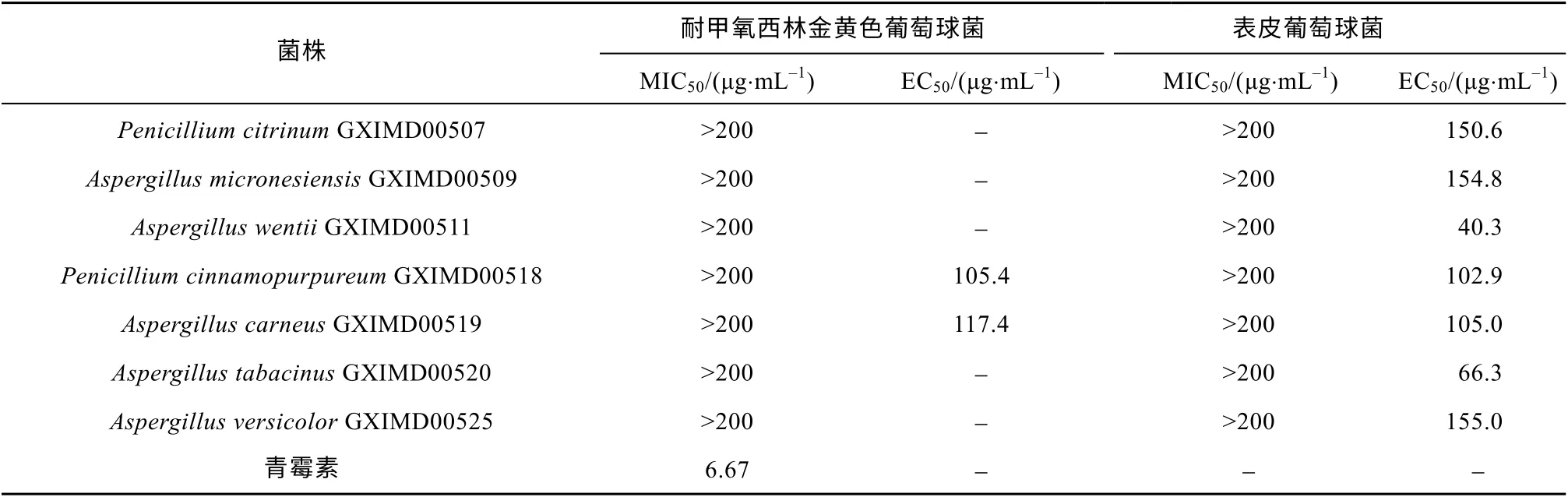
表4 真菌发酵液乙酸乙酯提取物抗生物被膜活性实验结果Tab. 4 Anti-biofilm activities of EtOAc extracts from fermentation broth of the gorgonian-derived fungal strains
3 讨论
本研究首次于广西北部湾海域分离得到Parengyodontium属真菌, 丰富了对该海域海洋真菌多样性的认识。P. album, 是一种重要的蛋白酶产生菌(Ren et al, 2020), 曾用名Engyodontium album,2016年Tsang等将其转移到新属Parengyodontiumgen. nov., 确立新名称为Parengyodontium album。该菌株曾从厦门市集美区红树林海泥中分离得到(傅奇 等, 2020), 黄艳冰等(2018)在南海海域叶状蔷薇珊瑚也曾分离到该菌株, 进一步从其发酵产物中发现的苯并二氢吡喃酮类化合物对MRSA具有较好的抑制作用。
无乳链球菌又叫B群链球菌(GBS), 属芽孢杆菌纲Bacilli、乳杆菌目Lactobacillales、链球菌科Streptococcaceae、链球菌属Streptococcus, 是一种人类、牲畜和鱼类共患病致病菌。人源性无乳链球菌可寄生于母体生殖道, 并可引起婴儿感染。还可引起产后感染、菌血症、心内膜炎、皮肤软组织感染、骨髓炎。鱼源性无乳链球菌传染性强, 致死率高, 罗非鱼是最敏感的宿主, 感染后死亡率高达80%, 造成巨大经济损失; 药物是防控无乳链球菌的主要手段,但其对常用抗生素如青霉素、红霉素和大环内酯类抗生素的敏感性不断下降(苏友禄 等, 2019; 张行 等,2020)。Kong等(2018)自一株海绵来源真菌Aspergillus fumigatusHNMF0047分离得到的螺戊酸, 以及两个新的螺戊酸衍生物16-O-propionyl-16-O-deacetylhelvolic acid 和 6-O-propionyl-6-O-deacetylhelvolic acid抑制无乳链球菌的MIC值分别为8μg·mL-1、16μg·mL-1和2μg·mL-1, 均强于阳性对照妥布霉素的MIC值(32μg·mL-1)。可见, 海洋天然产物是发现防控无乳链球菌药物的潜在资源。而本研究发现菌株P. citrinumGXIMD00507、P. cinnamopurpureumGXIMD00518和A.unguisGXIMD00521对无乳链球菌具有良好的抑菌活性,可为开发抗无乳链球菌的新型抗菌药物提供参考。
海豚链球菌属芽孢杆菌纲Bacilli、乳杆菌目Lactobacillales、链球菌科Streptococcaceae、链球菌属Streptococcus, 具有感染宿主广、传染性强、死亡率高等特点。海豚链球菌可以感染30多种鱼类, 导致其发病, 严重威胁到水产养殖业的健康发展(罗晓雯 等, 2018)。本研究有5株真菌对海豚链球菌的抑制率达到80%以上, 菌株A. sydowiiGXIMD00516也表现出抑制活性。Liu等(2017)曾从海绵共附生真菌A. sydowiiJ05B-7F-4中分离到抑制海豚链球菌的活性化合物ViolaceolⅡ和Cordyol E。
细菌生物被膜(biofilm, BF)是多个细菌黏附于非生物或生物表面。分泌多聚物基质并将自身包裹其中形成的一种有组织的细菌集团。生物被膜的形成可以增强细菌的耐药性, 生物被膜内细菌较其浮游状态对抗生素的耐药性可提高100~l000倍(Jin et al, 2014);临床上, 人类65%~80%的疾病是由生物被膜造成的(Ding et al, 2019)。MRSA生物被膜一旦生成, 传统的抗MRSA感染用药如万古霉素和利奈唑胺等很难将其清除。许多天然产物被证明具有破坏细菌生物被膜或使生物被膜对抗菌药物敏感的活性作用, 有望开发成更高药理活性的抗生物被膜药物(Melander et al,2020)。海洋环境因其特殊的物理和化学条件, 几乎每一类海洋生物都表现出分子的结构特异性, 表现出丰富的生物活性。从海绵中分离出的二萜类化合物Darwinolide, 抑制MRSA的MIC值为132.9μmol·L-1,抗MRSA生物被膜EC50值为33.2μmol·L-1(von Salm et al, 2016)。本研究发现两株柳珊瑚共附生真菌P.cinnamopurpureumGXIMD00518和A. carneusGXIMD00519发酵液粗提物有抗MRSA生物被膜形成活性, EC50值分别为105.4μg·mL-1和117.4μg·mL-1,有开发有效抗MRSA生物被膜形成药物的前景, 值得对其次级代谢产物进行探索。
表皮葡萄球菌是条件致病菌, 进入人体后, 通过黏附生成生物被膜, 可导致败血症, 已上升为医院感染率排名的前4位(张青 等, 2003)。本研究发现有11种具有抑菌作用的柳珊瑚共附生真菌均能抑制表皮葡萄球菌, 菌株P. cinnamopurpureumGXIMD00518和A. unguisGXIMD00521对表皮葡萄球菌的抑制率分别为86.84%和88.17%, 并有7种真菌对表皮葡萄球菌表现出抗生物被膜活性, 占菌株总数27%, EC50浓度范围为40.3~155μg·mL-1。

