黑美人马铃薯结合态和游离态多酚氧化酶的酶学性质研究
刘 辉,卢 扬,李 俊,范士杰,王立新,王 辉,*
(1.贵州省农业科学院生物技术研究所,贵州 贵阳 550006;2.贵州省农业生物技术重点实验室,贵州 贵阳 550006;3.贵州省毕节市农业技术推广站,贵州 毕节 551700)
多酚氧化酶(Polyphenol oxidase,PPO)含有铜离子,广泛分布于动物、植物、真菌和细菌中[1]。在有氧条件下,PPO先将单羟基酚氧化成邻二酚,再将邻二酚氧化成邻醌,最后聚合成褐色素[2]。一般认为,PPO在植物细胞内存在游离态(Soluble PPO,sPPO)和膜结合态(Membrane-bound PPO,mPPO)两种形式,且这两类同工酶间的性质差异较大[3-5]。当细胞膜结构受到破坏,mPPO便游离出来,从而使PPO酶活力显著提高,引起果蔬褐变,造成变色、变味、软化及营养下降等不良后果,导致果蔬的市场价值降低[6-7]。
由于mPPO的存在,使PPO的酶活力问题研究起来十分复杂。目前,国内外已经开始对膜结合态PPO进行研究,并且取得了较好的研究结果。如Zaini等[8]通过非离子型去污剂Triton X-114、热诱导相分配技术、硫酸铵沉淀法及琼脂糖凝胶层析等技术,成功地从蛇皮果中分离纯化出膜结合态多酚氧化酶,并对它的酶学特性进行了研究;Liu等[3]通过硫酸铵沉淀法及DEAE Sepharose Fast Flow阴离子交换法对苹果膜结合态PPO进行了纯化,并研究了其三维结构,同时与苹果的游离态PPO的性质进行了比较,发现它们在一定pH值及温度范围内的酶活力有差异,膜结合态PPO酶活力要显著高于游离态,且反应的最适底物也不一致。在马铃薯PPO的研究中,为降低马铃薯块茎发生的酶促褐变,探究其PPO的性质,对马铃薯PPO进行分离和性质研究受到广泛关注。目前,对游离态PPO的分离纯化及性质研究较多,如孟雅等[9]采用硫酸铵分级沉淀法、凝胶层析法及分级沉淀和层析相结合的方法对马铃薯PPO进行了纯化,并研究了其在不同工艺条件下的酶活力变化。对马铃薯膜结合态PPO的研究仍属空白,且尚无可靠的分离纯化方法,对其性质更是缺乏系统的了解。课题组前期已经完成了大西洋马铃薯sPPO与mPPO酶学性质的研究[10],但是不同品种(系)马铃薯块茎酶促褐变程度不同,且不同品种(系)马铃薯PPO分离方法及酶学性质也存在差异[11-12]。黑美人马铃薯是我国自主培育出的彩色优质马铃薯新品系,因其富含花青素,所以具有抗氧化作用[13]。该品种由贵州省生物技术(马铃薯)研究所从国际马铃薯中心引进,并已经成为贵州省冬作区的主要栽培品种之一。本试验以黑美人马铃薯为原料,分别提取sPPO和mPPO粗酶,并对两种酶进行酶学性质研究,为进一步了解PPO性质和提升特色马铃薯资源优势提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
黑美人马铃薯块茎,为贵州省生物技术研究所提供的新鲜马铃薯。
磷酸氢二钠、聚乙烯吡咯烷酮、邻苯二酚、间苯二酚、焦性没食子酸、亚硫酸钠、抗坏血酸、绿原酸等均为分析纯,购自国药集团化学试剂有限公司。
1.1.2 仪器与设备
FA2104电子天平,上海舜宇恒平科学仪器有限公司;Infinite M200 Pro NanoQuant酶标仪,瑞士Tecan Group Ltd;UV-2550紫外分光光度计,日本岛津公司;TGL-20台式高速冷冻离心机,四川蜀科仪器有限公司;A11基本型分析研磨机,艾卡(广州)仪器设备有限公司;HH-1恒温水浴锅,常州市金坛区环宇科学仪器厂;SB-5200DTS超声波清洗机,宁波新芝生物科技股份有限公司;UPT-II-10T超纯水机,西安优普仪器设备有限公司。
1.2 方法
1.2.1 马铃薯PPO粗酶液提取方法
马铃薯PPO粗酶液提取参考苹果[3,14]和梨[5]PPO的提取方法。将200 g马铃薯洗净、切块,加入0.05 mol/L、pH值为6.8的预冷磷酸氢二钠-柠檬酸缓冲溶液(含2%的交联聚维酮(PVPP)),料液比1∶1(g/mL),经研磨机研磨搅碎,4℃下,10 000 r/min离心20 min,上清液即为sPPO粗酶液。沉淀用5倍体积去离子水冲洗干净,按固液比1∶2(g/mL)加入磷酸氢二钠-柠檬酸缓冲溶液、0.15%Triton X-100匀浆,室温下超声(超声功率为360 W)处理10 min并静置1 h;4℃下11 000 r/min离心15 min。置于冰箱30 min,然后35℃水浴保温15 min。25℃离心15 min,上清液即为mPPO粗酶液。
1.2.2 马铃薯PPO特征吸收波长的确定
利用紫外分光光度计测定特征波长[15]。以邻苯二酚为底物,用0.05 mol/L的磷酸缓冲液(pH 6.8)配制成底物溶液,取2.5 mL底物溶液,加入0.5 mL PPO粗提液,混匀,在25℃下对混合液进行波长扫描,确定特征吸收波长。
1.2.3 PPO酶活力测定
以邻苯二酚为底物分别测定马铃薯sPPO和mPPO的酶活力。PPO酶活力测定方法如下:用磷酸缓冲液(0.05 mol/L,pH 6.8)配制邻苯二酚(0.01 mol/L)底物溶液[15]。将0.3 mL酶液与2.5 mL上述缓冲液混合后,加入0.2 mL底物溶液开始反应。用分光光度计测定反应液1 min内在特征吸收波长下的吸光度变化值(A1)。对照煮沸10 min的相应酶液的吸光度值(A0)。在测定条件下吸光度值改变0.001所需的酶量为一个酶活单位(U)。

式中:t为反应时间,min;M为粗酶蛋白的质量,mg。
1.2.4 PPO蛋白浓度测定方法
以考马斯亮蓝法进行蛋白含量测定。取10μL酶液于酶标板中,依次加入10μL磷酸盐缓冲液(0.05 mol/L,pH 7.2)、200μL G250染色液(0.01%),室温下反应10 min,置于酶标仪中于595 nm下测定吸光度值。以牛血清蛋白(BSA)为标样制作蛋白标准曲线。
1.2.5 pH值对PPO酶活力的影响
依照“1.2.3”的方法测定PPO酶活力,其中酶反应缓冲液分别选定pH值为3.0、4.0、5.0、6.0、7.0和8.0的0.05 mol/L柠檬酸-磷酸盐缓冲液[3]。将测得的最大单位酶活力值记为100%,计算其他反应pH值下的PPO相对酶活力。
1.2.6 反应温度对PPO酶活力的影响
先将缓冲溶液和底物溶液分别置于温度为20、25、30、35、40、45、50、55、60、65、70℃水浴槽中预热10 min,然后迅速加入0.3 mL酶液,混匀,分别测定酶活力。将测得的最大单位酶活力值记为100%,计算其他反应温度下的PPO相对酶活力。
1.2.7 底物对PPO酶活力的影响
以邻苯二酚、间苯二酚、绿原酸和焦性没食子酸溶液为底物,在底物浓度分别为10、20、30、40、50 mmol/L条件下测定酶活力。
1.2.8 PPO动力学常数测定
依照“1.2.3”的方法对PPO酶活力进行测定,其中反应底物分别选用反应体系中终浓度分别为4、12、16、20、24、30 mmol/L的邻苯二酚、焦性没食子酸溶液,作反应底物浓度与单位酶活力的双倒数图,根据斜率公式计算米氏常数(Km)和最大反应速度(Vmax)值。
1.2.9 抑制剂对PPO酶活力的影响
分别以乙二胺四乙酸二钠(EDTA-2Na)、亚硫酸钠、抗坏血酸、草酸、植酸、柠檬酸、Na+、K+、Ca2+、Mg2+、Cu2+和Mn2+为抑制剂,依照“1.2.3”的方法对PPO酶活力进行测定(以上抑制剂终浓度均为1.00 mmol/L),将未加抑制剂的酶样品单位酶活力值记为100%,计算添加不同浓度抑制剂的PPO相对酶活力。
1.2.10 PPO热稳定性测定
依照Zhou等[5]的方法略作修改后进行测定。将sPPO和mPPO粗酶提取液分别置于30、40、50、60℃水浴锅中保温10 min后立即冷却至室温,依照“1.2.3”方法对PPO酶活力进行测定。将未经热处理的酶样品单位酶活力值记为100%,计算添加不同温度下PPO残留酶的相对酶活力。
1.2.11 数据处理
所有数据进行3次重复试验,结果以x¯±s表示。使用SPSS 18.0对数据进行方差分析和显著性检验。
2 结果与分析
2.1 黑美人马铃薯sPPO和mPPO粗酶液的制备
黑美人马铃薯PPO经提取后,分别得到sPPO和mPPO粗酶液。经测定,两种粗酶液的蛋白浓度分别为(5.51±0.01)mg/mL和(0.30±0.01)mg/mL。由于邻苯二酚最大吸收波长为277 nm,且在可见光区无吸收,故从图1可知,sPPO和mPPO的最大吸收波长分别为403 nm和406 nm。周向军等[16]研究也发现,黑美人马铃薯PPO的最大吸收波长为413 nm,与本研究结果相似。一些研究中,PPO最大吸收波长为420 nm,推断跟不同马铃薯品种的PPO性质不同有关,或者与粗提液中同工酶的作用有关,也可能由于PPO与底物反应产生的产物存在差异[3,7,16]所致。

图1 黑美人马铃薯mPPO与sPPO的波长扫描图Fig.1 Wavelength scanning charts of mPPO and sPPO in black beauty potatoes
2.2 pH值对黑美人马铃薯PPO粗酶活力的影响
不同pH值对马铃薯sPPO和mPPO粗酶活力的影响见图2。如图2A所示,当pH值为7时,sPPO和mPPO的相对酶活力均达到最大;当pH值为8时,sPPO和mPPO相对酶活力分别为50.54%±0.28%和72.31%±0.58%,均极显著低于pH7时的活力(P<0.01);当pH值小于7时,sPPO和mPPO相对酶活力均随pH降低而减小,但sPPO的相对酶活力高于mPPO,表明sPPO在酸性条件下比mPPO更稳定。李瑜等[17]测得马铃薯中薯5号、中薯6号和费乌瑞它的PPO粗酶最适pH值为5.5,而王清等[18]测得甘农薯1号和甘农薯2号的PPO粗酶最适pH值分别为5和5.5。以上马铃薯PPO最适pH值均小于等于5.5,而在本试验中,黑美人马铃薯sPPO和mPPO粗酶的最适pH值均为中性,与以上报道存在明显差异,这表明不同品种马铃薯PPO最适pH值存在差异性。用绝对酶活力进一步对sPPO和mPPO的酶活力进行比较,结果如图2B所示,在测试的所有pH值下,mPPO的绝对酶活力均高于sPPO。类似的结果也发生在红富士苹果[3]和梨[5]的PPO中,推测跟两种PPO在三维结构上存在酶的基团重排、同工酶或不同的酶活性中心相关[3,19]。
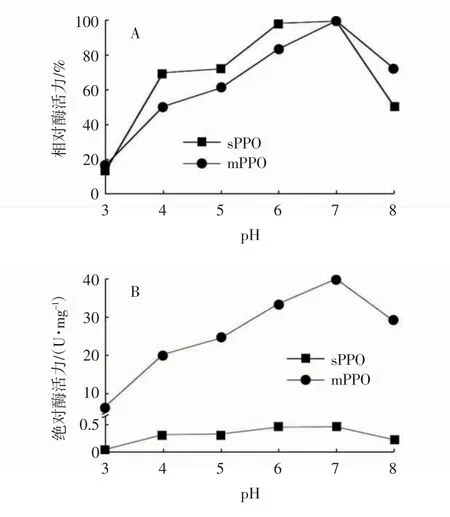
图2 pH对马铃薯sPPO和mPPO粗酶活力的影响Fig.2 Effects of pH on sPPO and mPPO activities in potato
2.3 反应温度对黑美人马铃薯PPO粗酶活力的影响
不同反应温度对马铃薯sPPO和mPPO粗酶活力的影响如图3所示。从图3A可知,sPPO和mPPO的最适反应温度分别为25℃和30℃;当反应温度为20~70℃时,sPPO和mPPO粗酶的相对酶活力均呈现先增大后减小的变化趋势,其中,当温度为20℃时,sPPO和mPPO的相对酶活力分别为97.13%±0.56%和96.43%±0.42%,当温度升至70℃时,sPPO和mPPO的相对酶活分别降为26.55%±0.56%和27.41%±0.84%。此外,温度为25~70℃时,mPPO的相对酶活力比sPPO高,表明mPPO比sPPO更耐受高温。王清等[18]报道,马铃薯品种Favorita和Snowden块茎的PPO最适反应温度为25℃;张洪等[20]和李瑜等[17]均报道马铃薯PPO最适反应温度为30℃,表明不同品种马铃薯的块茎多酚氧化酶最适反应温度不一致。而在本试验中,黑美人马铃薯sPPO和mPPO粗酶的最适反应温度略有不同,绝对酶活力存在差异(如图3B所示),造成这种差异性的原因在于sPPO和mPPO所处的环境不一样,导致酶活性中心与环境中底物的结合能力受影响[3,21]。
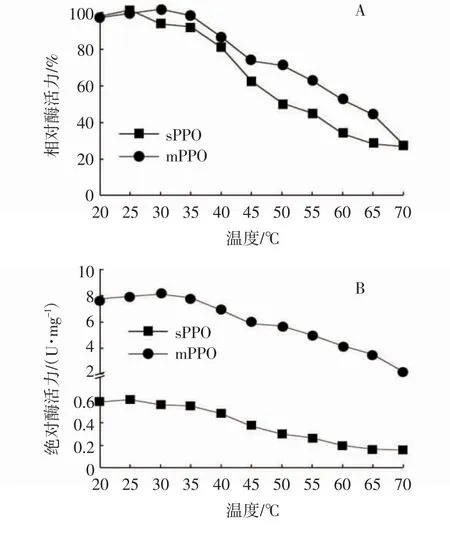
图3 温度对马铃薯sPPO和mPPO粗酶活力的影响Fig.3 Effects of temperatures on sPPO and mPPO activities in potato
2.4 底物对黑美人马铃薯PPO粗酶活力的影响
分别以不同浓度的邻苯二酚、间苯二酚、绿原酸和焦性没食子酸为底物和sPPO、mPPO粗酶进行反应,对马铃薯两种PPO粗酶的酶活力进行测定。结果表明,以绿原酸和间苯二酚为底物进行反应时均未检测到酶活力,说明绿原酸和间苯二酚不是测定马铃薯PPO酶活力的底物。相关研究发现间苯二酚也不适合作为测定勐库大叶种茶树PPO酶活力的底物[22]。如图4所示,当以邻苯二酚和焦性没食子酸为底物时mPPO酶活力均大于sPPO。当邻苯二酚浓度为10 mmol/L时,sPPO和mPPO的酶活力均较低,分别为5.57 U/mg和17.07 U/mg;当焦性没食子酸浓度为10 mmol/L时,sPPO和mPPO的酶活力分别为4.19 U/mg和18.97 U/mg。Batista等[23]报道了苹果PPO对邻苯二酚催化活力最高,这和本试验结果一致。Liu等[5]报道以邻苯二酚为底物时,桃sPPO的酶活力高于mPPO,这和本试验结果差异较大,这表明sPPO和mPPO对不同底物的亲和力不同。刘芳[19]的研究表明,不同的底物具有单酚、双酚、多酚等不同的结构,同时甲基(-CH3)的数量和位置对底物特异性的决定性具有重大影响。因此,马铃薯sPPO和mPPO与某一底物间的亲和力与自身同工酶构成及底物结构有关。

图4 马铃薯sPPO和mPPO粗酶在不同底物下的酶活力Fig.4 Enzymatic activities of sPPO and mPPO on different kinds of substrates
2.5 黑美人马铃薯PPO粗酶动力学常数
分别以邻苯二酚、焦性没食子酸为底物,以双倒数作图法测定黑美人马铃薯sPPO和mPPO粗酶的动力学常数。如表1所示,以邻苯二酚为底物时,sPPO粗酶Km值为39.423 mmol/L,Vmax为0.019 mmol·L-1·min-1,mPPO粗酶Km值为35.291 mmol/L,Vmax为0.290 mmol·L-1·min-1;以焦性没食子酸为底物时,sPPO的Km值为205.896 mmol/L,Vmax为0.008 mmol·L-1·min-1,mPPO的Km值为205.067 mmol/L,Vmax为22.321 mmol·L-1·min-1。说明sPPO和mPPO存在较大的底物亲和性差异。结果表明,sPPO对邻苯二酚的亲和性和最大反应速度均大于焦性没食子酸;而与焦性没食子酸相比,mPPO的亲和性和最大反应速呈现相反趋势。这表明sPPO和mPPO对底物具有不同选择性,而这种差异可能会影响马铃薯褐变过程。
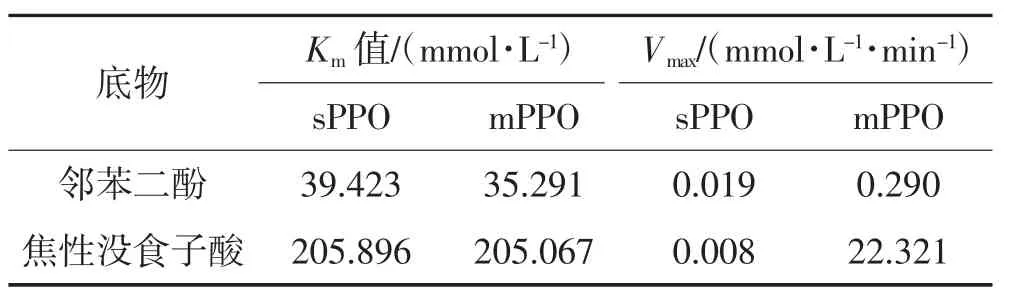
表1 黑美人马铃薯sPPO和mPPO动力学常数Table 1 Kinetic constants of sPPO and mPPO from black beauty potatoes
2.6 抑制剂对黑美人马铃薯PPO粗酶活力的影响
由图5可知,抗坏血酸和亚硫酸钠对sPPO和mPPO的酶活力抑制作用最强,其中,sPPO均已检测不到酶活力,而mPPO的相对酶活力分别为0.84%±0.36%和1.46%±0.18%。张洪等[20]报道100 mg/kg亚

图5 不同抑制剂对马铃薯sPPO和mPPO粗酶活力的影响Fig.5 Effects of different inhibitors on sPPO and mPPO activities in potatoes
?硫酸钠、150 mg/kg抗坏血酸能有效地抑制PPO的活力,这和本试验结果一致。此外,植酸、草酸、柠檬酸和EDTA显示出对sPPO和mPPO酶活力不同程度的抑制,其中,草酸对mPPO酶活力抑制较强,相对酶活力为61.96%±1.10%;而柠檬酸对sPPO酶活力抑制较强,相对酶活为81.49%±0.30%。Liu等[3]报道,柠檬酸对红富士苹果sPPO的半数抑制浓度(IC50)为90.0 mmol/L,大于植酸和EDTA,这和本试验结果一致;但是,EDTA会激活红富士苹果mPPO的酶活力,这和本试验结果正好相反。各金属离子对sPPO和mPPO酶活力的影响不一,其中Na+、K+和Mg2+对sPPO和mPPO酶活力影响不大,Mn2+、Ca2+和Cu2+可显著抑制sPPO和mPPO的酶活力,且对mPPO的影响要大于sPPO,这可能是由于不同PPO同工酶的蛋白质结构不同,使得各抑制剂的作用效果存在差异[21,24]。
2.7 黑美人马铃薯PPO粗酶的热稳定性
由图5可知,随着温度升高PPO粗酶酶活力逐渐降低,sPPO和mPPO在60℃时失活最明显。但在相同温度下,mPPO比sPPO更容易丧失酶活力。有研究报道,梨[5]和苹果[3]的mPPO均比sPPO的温度稳定性低,这和本试验结果一致。研究表明,苹果mPPO在转运至叶绿体中后,叶绿体基质中多肽酶会将mPPO中的一段小肽切除,从而形成成熟的sPPO,因而mPPO是sPPO的不成熟前体[21]。这可能是马铃薯mPPO和sPPO热稳定性存在差异的原因之一,但需要更多的证据支持。

图6 马铃薯sPPO和mPPO粗酶热稳定性Fig.6 Thermostability of sPPO and mPPO in potatoes
3 结论
本文对黑美人马铃薯sPPO和mPPO酶学性质进行了研究。结果表明:黑美人马铃薯sPPO和mPPO的最佳吸收波长分别是403 nm和406 nm。和其他品种的马铃薯PPO相比,黑美人马铃薯sPPO和mPPO粗酶的最适反应pH值和最适反应温度差异均较大。sPPO和mPPO在酸性条件下酶活力均较低,和sPPO相比,在试验pH值和温度条件下,mPPO的绝对酶活力均高于sPPO;抗坏血酸和亚硫酸钠对PPO的酶活力抑制作用较强,且对sPPO的抑制作用要大于mPPO。因此,在黑美人马铃薯加工过程中,要重点考虑mPPO对酶促褐变的影响。

