难熔金属含氧酸盐短流程熔盐电解制备金属单质及合金的研究进展
赵国立,许 莹,蔡艳青,宋 潘,夏朋昭
(1.华北理工大学材料科学与工程学院,河北唐山 063000;2.华北理工大学冶金与能源学院,河北唐山 063000)
难熔金属一般指熔点高于1 650 ℃(如钛、铬、钒、钨等)并具有一定储量的金属。难熔金属可以和其他元素形成合金,称之为难熔金属合金。难熔金属具有很多的优点,比如高温强度较好,耐腐蚀性能好,这使得它们在冶金工程、化工等传统领域有着重要的应用[1]。尤其是随着近年来科学技术的快速发展,难熔金属广泛应用在国防军事、航空领域、3D 打印技术等方面,成为供不应求的高端金属材料,各产业对其需求量越来越大。
在钢铁及有色金属合金方面难熔金属主要用作添加剂。比如在钢铁行业中钒用于合金添加剂,用以细化钢的组织和晶粒,使得晶粒粗化温度升高,钢的强度和韧性也会得到改善。金属铬会以单质铬或者铬铁的方式与钢铁形成合金,作为不锈钢的主要添加元素之一,用以提高钢的硬度、机械性能和耐腐蚀性能,金属铬还用于高温合金、精密合金及电阻合金的制备等。
钛是一种银白色金属,具有延展性、可塑性、易加工成形、低温韧性、断裂韧性、导热系数低及温度适应范围广的优点,而且纯度越高,塑性越大,强度越低;在常温下,金属钛可在溶解于任何浓度的氢氟酸和含有氟离子的酸中,与无机酸不发生反应,但是能够在热盐酸和热硝酸中溶解;500 ℃以下,钛及钛合金具有非常稳定的特性,但是,钛金属的化学性质在高温下极具活性,并且会与氧、氮、碳、氢和其他元素发生剧烈反应,并在高温下与大多数耐火材料发生反应[2]。钛具有耐腐蚀性强的性质,它具有与氧气、氮气和其他气体相互作用的能力,一些钛和其合金易于在金属表面上形成致密的氧化物和氮化物保护膜,以获得优异的耐腐蚀性,而且这种与气体作用的能力除了氢气外是不可逆的。由于钛及其合金具有种种优点,使它逐渐广泛应用于汽车行业、体育器械、医用器材、轻工等行业,成为仅次于铁、铝的“第三金属”[3]。
但是上述难熔金属的提取过程难度较大,在工业上制备难熔金属用的是热还原法,这种方法工艺复杂,能源消耗大,附属产物污染环境。熔盐电解法是一种新的制备难熔金属的工艺,比如FFC、OS、USTB、SOM 等,这些熔盐电解技术用到的原料一般是难熔金属的氯化物或者氧化物,这些难熔金属的氯化物或氧化物制备过程比较复杂,能耗大并且会污染环境,它们是由难熔金属的原生矿物经焙烧、浸出后首先获得对应的含氧酸盐,再将含氧酸盐中间相分解、锻烧、氯化、分离后最终获得此类原料。除此之外,以氯化物为原料的熔盐电解过程还存在产生的废料污染大、腐蚀性强、步骤复杂等问题;另外,由于金属氧化物在熔盐中的溶解度小,电解过程动力学差、制备效率低。所以,找到短流程、清洁、高效的熔盐电解制备难熔金属的新方法是目前急需解决的难题。
1 难熔金属工业制备方法
目前,难熔金属的工业生产方法基本采用热还原法。
1.1 金属钒
金属钒的制备方法包括钙热还原法、铝热还原法和镁热还原法。钙热还原法和铝热还原法采用钒的氧化物为原料,镁热还原法采用钒的氯化物为原料[4-7]。反应方程式见式(1)~(3)。
钙热还原法:

铝热还原法:

镁热还原法:

1.2 金属铬
金属铬的制备方法有铝热法和电解法。铝热法主要以三氧化二铬为原料,化学反应见式(4);电解法以铬铵矾中的硫酸铬或者铬酐为原料,化学反应见式(5)~(6)[8]。
铝热法:

电解法:

或:

1.3 金属钛
金属钛的制备方法有镁热还原法(Kroll 法)[9]和钠热还原法(Hunter 法)[10],主要化学反应见式(7)~(8)。

难熔金属的工业生产方法主要是热还原法,这种传统的工业生产方式使难熔金属的制备具有以下缺点:生产成本高昂、大规模生产困难、产品杂质含量高、工序和生产设备复杂、能源消耗大等。因此,急需开发难熔金属冶炼新工艺。
2 氧化物和氯化物的熔盐电解法
用于制备难熔金属的工业方法除了具有上述的缺点外,在分离过程中还会出现产物与金属的分离困难以及热利用率低等缺点,而熔盐电解法制备金属用电子作为还原剂,不需要引入其他还原金属杂质,也无需考虑还原金属再生的问题,因此,熔盐电解法比金属热还原法生产难熔金属更有优势。熔盐电解法研究的是直流电通过熔盐电解质时熔盐中各化学组分发生变化的过程,与水溶液相比,熔盐具有的优势更多,比如扩散系数大、黏度低、分解电压范围宽、离子电导率高、对电解原料的溶解度高、电极反应快、过电压低等。下文阐述几种熔盐电解比较具有代表性的方法:FFC、OS、USTB、SOM、液态金属做阴极制备合金等。
2.1 FFC 法
FFC 熔盐电解技术是由英国剑桥大学的Fray Derek J.等在CaCl2熔盐中对其制备的纯金属钛进行阴极脱氧实验时发现的一种熔盐电解方法。这种方法最初是为了除去金属钛中的杂质氧,进而使得钛材的纯度得以提高,后来研究者们发现这种技术可以直接电解固体TiO2制备海绵钛,于是将其以三名发明者(Fray Derek J.,Fathing Tom W.和Chen George Zheng)的姓名命名为FFC 法[11]。
FFC 法是一种制备钛金属的新方法,已经研究了近20年。FFC 熔盐电解法的具体操作方法:阳极选择石墨棒,阴极选择TiO2,熔盐电解质选择CaCl2,在800~900 ℃的温度和2.8~3.2 V 的槽电压下进行电解,并通入氩气进行保护,电解完成后冷却至室温,取出。在实验过程中TiO2阴极中所含的O 变为O2-,O2-与阳极上的C 反应生成CO 或者CO2。随着TiO2阴极中O 含量的减少,阴极产物逐渐变为低价的钛氧化合物,直至纯金属钛。
整个电脱氧过程反应见式(9)~(10)。

近年来,国内外学者对FFC 法的阴极脱氧机理进行了大量研究后,发现FFC 法的阴极脱氧是一个比较复杂的过程,二氧化钛在逐级还原的过程中伴随着一系列副反应。比如Schwandt 等[12]根据脱氧还原过程中热力学和动力学特性以及物相变化的特点,推导出了Ti02脱氧还原过程的路径:TiO2脱氧还原的第一阶段产物是钛的低价氧化物TixOy和CaTiO3,见式(11)~(14);第二阶段产物主要是CaTi2O4,见式(15);第三阶段是第二阶段产物CaTi2O4的分解和TiO 的形成,见式(16);第四阶段是TiO 继续脱氧形成Ti—O(钛氧固溶体) ,见式(17)。
第一阶段:

第二阶段:
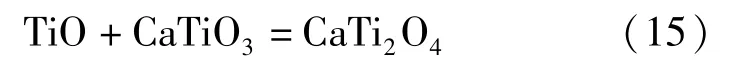
第三阶段:
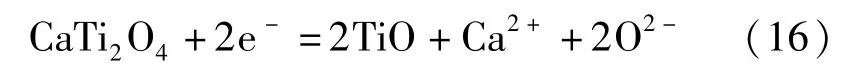
第四阶段:

FFC 方法提出后,引起了钛冶金学家的广泛关注,并将该方法拓展至V、Cr、Si、Ta、Nb 等的制备。FFC 法的应用性极其广泛,适用于各种加工难、活性高的金属。也可以通过将各种氧化物混合烧结,得到固态阴极后直接电解脱氧制得传统工艺无法合成的合金,同时还可以避免传统方法造成的氧化、偏析等问题。在此基础上,Ma 等[13]、Chen 等[14]采用FFC 法对高钛渣进行电解后得到了产物金属钛和TiC/SiC 合金。由于FFC 法是固态阴极直接脱氧,因此可以先将氧化物原料预成型,然后直接脱氧得到一定形状的产品,极大降低了金属和合金产品后续的成型和加工费用。
FFC 工艺虽然有上述优点,但是仍然存在以下问题:①电流效率低;②阴极产物含有杂质;③阴极产物易含有尚未完全还原的低价氧化物,导致电解产品中的氧钙含量极高;④在熔盐电解质中易生成碳酸根,在阴极上会发生还原反应导致碳含量升高;⑤TiO2阴极本身并不导电,当它失去氧离子形成低价钛氧化合物时才会导电,因此还需要考虑如何使阴极中的氧原子在电解开始时就离子化的问题:⑥TiO2阴极中的O 在电解时进入熔盐而留下钛,如何控制电解电压使得熔盐中的杂质元素(C 和Ca 等)不在阴极还原也是一个难点。
2.2 OS 法
2002年,One 和Suzuki[15]在日本京都大学设计了一种钙热还原制备钛的工艺方法,称为OS 法。它的原理是电解熔盐中的CaO 首先得到金属钙,再与TiO2发生钙热还原得到金属钛。在该方法中,石墨作为阳极材料,金属铁网或不锈钢网作为阴极材料,溶有金属Ca 的CaCI2熔盐作为电解质,使电解槽的温度在1 150~1 190 K 之间,使电解电压介于CaO 的分解电压1.66 V 和CaCI2的分解电压3.2 V之间(一般选择3.0 V),然后TiO2粉末从电解槽上方加入,在阴极附近TiO2被Ca 还原生成金属钛并沉积到电解槽底部,还原产生的CaO 又被电解生成Ca,实现了金属钛的连续生产。阴极反应机理见式(18)~(21);阳极反应机理见式(22)~(23)。
阴极:

阳极:

OS 法与FFC 法采用相似的电解槽和相近的电解电压,并且阳极选择的都是C 棒。区别是FFC 法用块状TiO2和导线连接作阴极,因此阴极中的氧必须穿过阴极表层才能去除;在OS 法实验中,TiO2以粉末状从阴极上方加入,二者之间无需导线连接,氧不需要长距离的扩散,利于其转移。显然OS 法的能耗较FFC 更小,也更加环保,但是它也面对着一些问题,比如设备和工艺比较复杂,钛与盐难分离,还原得到金属Ti 的效率较低等问题。
根据近年来的研究发现,OS 法的阴极区域会出现中间产物CaTiOx,它的出现制约着金属钛的制备。在OS 法基础上,研究者们进行了钙蒸汽还原(PRP 工艺)[16]、钙镍合金还原(EMR 工艺)[17]、CaH2合金还原(MHR 工艺)[18]等。犹他大学的Fang 等[19]进行了熔盐中镁热还原二氧化钛用氢辅助制备金属Ti 的研究,并对氢辅助下的脱氧机理和热力学等做出了解释。上述研究所面临的挑战仍是金属钛及其合金制备效率低的问题。
2.3 USTB 法
北京科技大学朱鸿民等[20]发现一种以可溶性阳极为原料制备金属钛的新方法,称之为USTB 法。这种方法包括可溶性阳极材料TiO-mTiC(0≤m≤1)的制作和熔盐电解制取金属钛两个步骤。采用TiO2碳热还原制备可溶性阳极,也可以选择TiO2与TiC 混合烧结,具体方法:将TiO2和碳粉或者TiC 在300~1 000 kg/cm2的压力下压制成型,随后在1 273~1 673 K 和小于100 Pa 的真空条件下烧结4 h,得到具有良好导电性的可溶性阳极。电解实验过程以TiO-mTiC 做为阳极,钢棒做为阴极,NaCI/KCl 作为熔盐电解质,并在1 073 K 下进行电解实验。在实验过程中,TiO-mTiC 可溶性阳极中的钛离子溶解进入NaCI/KCl 熔盐,到达钢棒阴极后发生还原反应生产金属钛,与此同时,阳极放出CO 和CO2,阳极气体的组成取决于制备的阳极材料中碳和氧的含量。该电解过程中发生的化学反应见式(24)~(25)。
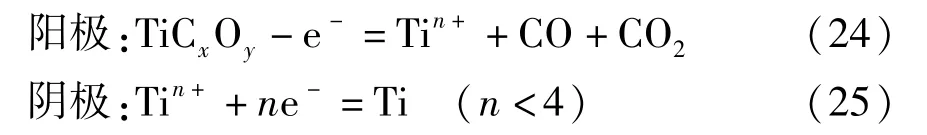
USTB 法是借用电解制备金属的思路,在制备钛的机理上和FFC 法、OS 法有着明显的不同。USTB 法最大的特点是钛源是阳极,这使得阴极产物不像FFC 法和OS 法那样会含有大量的氧,且不会引入熔盐中Fe、Si、Mg、Al 等金属杂质[21];该方法克服了FFC 法中以TiO2为阴极时导电性差的缺点,并以导电性良好的TiCxOy作为可溶性阳极,在阴极上电解得到高纯度的金属钛,使电流效率明显提高。该方法得到的金属钛纯度可达到99.9%,是目前制备金属钛及其合金较有发展潜力的方法之一。
USTB 法目前存在的问题:钛离子在阴极的沉积过程会受到阳极溶解速率的影响,TiO-mTiC 经高温烧结后成型,是密实的块状半导体固溶体,在熔盐中溶解速率缓慢,影响了钛离子的沉积速率,限制了电极产能;若要实现大规模生产,必须增加固体阳极的尺寸,这将会增加成型难度,增大氧化物的还原阻力,降低其高温热稳定性和物化性质均一性等。
2.4 SOM 法
固体透氧膜法(SOM)[22]是21世纪初兴起的一项绿色环保、节能高效的提取冶金技术,由波士顿大学U.B.Pal 教授提出,并进行了由氧化镁直接提取镁的研究。发生的化学反应见式(26)~(27)。

SOM 法是通过控制O2-的流动,在电场作用下使O2-迁移到阳极,从而实现对金属氧化物的电解。由于在熔盐中加了一层固体透氧膜,阳离子只会在阳极析出,所以参与电解反应的物质只有氧化物;非氧离子无法透过固体透氧膜进入阳极附近,在进行电解实验时就算电压超过了熔盐的分解电压,熔盐也不会发生分解。利用此技术特点,SOM 法延伸到了处理钛精矿和含钛高炉渣制备合金TiFe 和Ti5Si3
[23-24],还用来电解含钛收尘渣和钛铁渣来制备钛及钛合金[25]。
固体透氧膜由于其电子电导有限,电解时产生的背景电流也会受到限制,这显著提高了电解时的电流效率。与此同时,SOM 法不存在FFC 法的“熔盐中不能有比要制备金属的析出电位更高的金属离子”的限制。
2.5 液态金属做阴极制备合金
当使用固态阴极进行熔盐电解制备金属时,由于金属的熔点比熔盐的电解温度要高得多,所以这种类型的方法制备的金属大多以粉末状沉积在阴极,导致高熔点金属的电解提取过程无法连续进行,也无法获得密实的块状金属,还极易诱发阴极产物的二次反应,使得电解过程中电流效率降低,熔盐损失增加。
熔盐电解制备合金的方法主要有电解共沉积法、阴极合金化法和液态金属阴极法[26]。当阴极选择液态金属时,在阴极上生成的金属能够与液态金属形成合金。用这种方法制备的合金可以使金属的活性降低,合金的污染和溶解损失减少,并且能够在较低温度制备高熔点金属合金。
目前北京科技大学的焦汉东等[27]利用此方法制备的合金有以下几种。
1)在NaCl-KCl 共晶盐体系中,TiCl3作为钛源,金属锡作为液态阴极,制备钛锡合金(Ti6Sn5)。
2)在NaCl-KCI-KF-K3TiF6的体系中,采用液态锡和液态铅电极制备钛锡合金(Ti6Sn5)和钛铅合金。
3)在LiF-NaF-KF-K2TiF6体系中,在液态锡和液态铋电极上制备出了钛锡合金和钛铋合金。
4)在CaO-Al2O3-MgO-TiO2熔体中,采用液态铁做阴极,从而获得钛铁合金。
使用液态金属做阴极时,沉积出来的金属在液态阴极内部具有更好的扩散条件,因此也更容易得到合金相。与固态惰性阴极相比,液态金属阴极可以使沉积金属的活度降低,使沉积金属在未达到其理论沉积电位之前发生去极化作用,从而得到与液态金属阴极形成的合金。
电解实验中沉积金属的电极电位由式(28)计算[26]。

式中:EElectro为阴极沉积金属的电极电位,V;η为过电位,V;ERA+/RA为电活性物质的平衡电极电位,V;aRA+(solution)为熔盐中活性物质的活度;aRA(in-liquid-metal)为液态金属阴极中沉积金属的活度。
使用固态金属阴极时沉积金属的活度为1,而使用液态金属阴极制备合金时,电解体系的沉积金属能与之形成合金,导致aRA(in-liquid-metal)小于1。故采用液态金属阴极时,会导致金属的还原电位正向移动,使金属离子的电沉积加快,从而起到去极化作用。
由于液态阴极有着去极化的作用,可用此方法提取含钛高炉渣中的钛元素,采用铁作为阴极时,含钛高炉渣中所含的硅要比钛先在铁阴极上发生去极化电沉积。若想要钛和硅元素在铁阴极上发生共沉积,就得适当增大阴极电流密度,在该电流密度下用恒电位电解可以得到钛-铁-硅三元合金;采用直流电解的方法可以使硅元素首先还原,然后钛在硅表面发生去极化沉积,得到钛-硅二元合金[27]。
适当的液态阴极也能起到抑制杂质进入电解产物的作用,比如:在电解实验温度下,Zn、Sn、Pb 等低熔点金属与目标金属Cr 易形成合金[28],但它们与C 无法形成,用此类金属做液态阴极时,就可以促进熔盐中铬酸根()在阴极上的电沉积,同时抑制的沉积,从而达到除碳的目的。
用液态阴极制备合金除这些优势以外,它还能够和沉积金属形成液态合金,从而达到合金与熔盐的液-液分离,使电解产物得以在线收集,对难熔金属含氧酸盐在熔盐中的电沉积连续化操作具有重要的指导意义。
该技术目前存在的问题主要是液态阴极的选择问题,具体包括以下内容:①液态阴极能够既强化目标金属电解,又抑制杂质的沉积;②液态金属通过与沉积金属的合金化实现去极化作用,所以选择的液态阴极应该易与沉积金属形成合金;③所选择的阴极不能与杂质形成合金,最好对杂质具有排斥作用,从而达到去除杂质的目的。
3 含氧酸盐的熔盐电解
上述熔盐电解法的原料是氧化物或者氯化物,这类原料属于冶金流程的中下游产物,制备困难,并且在电解中会产生有毒气体。为了避免此类情况,以冶金流程中第二步得到的难熔金属含氧酸盐为原料进行熔盐电解来制备金属及合金,这样可以大幅缩短流程,且不会产生有毒物质污染环境。另外,难熔金属含氧酸盐属于离子型盐类,它能够与熔盐形成共晶体系,在电解过程中具有优异的动力学条件,可有效避免传统熔盐电解法中氧化物原料在熔盐中溶解度小的问题。故以难熔金属含氧酸盐为原料进行熔盐电解制备金属及合金符合短流程绿色冶金的原则。
在熔盐电解制备金属及合金时,如果被电解物质直接做固态阴极,会出现大块阴极成型困难,物化性质不均一、导电性能差、电解产物的烧结现象严重等问题;如果被电解物质溶于电解质中,就要考虑被电解物质在熔盐中的溶解度,以及和熔盐的平衡电位问题。
难熔金属含氧酸盐在熔盐中的溶解度越大,越有利于熔盐电解过程中沉积金属离子在熔盐中的扩散,就越能够得到更大的极限扩散电流密度和实现更高的电流效率。如Kim 研究了在CaCl2熔盐中CaWO4的溶解度,发现二者可形成简单共晶体系,并在CaWO4含量为4%时形成共晶点,且CaWO4的溶解度会随着熔盐温度的升高而升高[29];Clark 发现CaCl2-CaCrO4也可以形成简单的共晶体系,表明了CaCrO4在CaCl2熔盐中也会有一定的溶解度[30];肖巍研究发现SiO2在CaCl2熔盐中转变为CaSiO3后,其在CaCl2熔盐中的溶解度有了显著的提高[31];李运刚发现SiO2在KCl-NaCl-NaF 熔盐中转变为Na2SiO3之后,能够提高SiO2在熔盐中的溶解度[32],说明离子型含氧酸盐在熔盐中的溶解度要远远高于氧化物[33-36]。
氯化物与氟化物是熔盐电解过程中最常见的体系,如工业中常用氯化物熔盐体系电解提取碱金属、碱土金属和稀土金属,用氟化物熔盐体系进行铝电解[37]。对于周围环境的腐蚀性来说,氯化物熔盐体系要低于氟化物,因此,当原料在这两种熔盐体系中的溶解度都满足电解要求时,一般选择对环境腐蚀性较小的氯化物体系。难熔金属含氧酸盐在不同熔盐中的溶解度决定了沉积金属离子向电极表面扩散的难易程度,是选择熔盐体系的重要依据[38]。在熔盐中的溶解度越大,沉积金属离子越容易扩散至电极表面,在电解时就越能够达到更大理论电流密度和电流效率,在电极单位面积上沉积的金属也就越多,这也是保证电解能够连续稳定运行的前提。
难熔金属含氧酸盐标准平衡电位越正,在电解过程中就越容易得电子发生还原反应沉积出金属,热力学驱动力也越大。表1 是常见金属及非金属含氧酸盐的标准平衡电位,以CaCl2的标准平衡电压(3.214 V)为基础,将Ca2+/Ca 的标准平衡电位定为0 V,Cl2/Cl-的标准平衡电位定为3.214 V,就可计算出其他盐类相对于Ca2+/Ca 的标准平衡电位。由表1 可知,Cr、V、Mo、Co 和W 的含氧酸盐平衡电位较正,热力学驱动力也大,这些金属的含氧酸盐较易得电子还原为金属;Ti 和Zr 含盐酸盐的标准平衡电位较其他金属的含氧酸盐较负,热力学驱动力也较小,因此较难得电子发生还原反应沉积金属;除Zr 的含氧酸盐外,其他金属含氧酸盐的标准平衡电位都正于Ca2+/Ca,它们对应的阳极氧化反应也远小于Cl2/Cl-的平衡电位。因此,对这些金属的含氧酸盐进行电解时,熔盐中的碱金属不会发生还原反应在阴极沉积出金属,氯离子也不会在阳极析出氯气,进而从电位的角度证明了难熔金属含氧酸盐熔盐电解制备金属时氯化物和氟化物可作为稳定的熔盐体系[39]。

表1 不同金属含氧酸盐的标准平衡电位
电解槽示意图如图1所示,电解槽中的熔盐在进行不同含氧酸盐电解时可换为最适宜其电解的熔盐。电化学实验中的测试装置采用VersaSTAT 4 电化学工作站。整个实验装置包括电阻炉装置、气体处理装置、数据测试装置,采集和记录数据用计算机来进行。在进行电解实验时,由于电流会随着电极没入熔盐的深度而变化,故所采集到的电流一般采用电流密度来表示,它的计算方法可由公式J=I/S计算得到,I为实验时的电流,S为阴极面积,在进行实验时可自行测得。

图1 电化学实验电解槽示意图
4 典型难熔金属含氧酸盐的电化学行为
现介绍比较典型的V、Cr、Ti 的含氧酸盐在电解过程中发生的电化学行为。
4.1 钒酸盐
钒含氧酸盐的熔盐电解过程由沉积金属离子在电极表面的扩散和还原两步组成。根据文献结果可知[39],NaVO3在NaCl-CaCl2熔盐中,800 ℃条件下溶解度为6%。因此,采用NaCl-CaCl2熔盐可使钒含氧酸盐在电极表面进行扩散。与此同时,钒含氧酸盐的还原过程中是先还原为钒的低价氧化物,然后再进一步还原为金属钒。
金属钒是一种高价态-多变价的元素,钒含氧酸盐在纯NaCl 熔盐中还原为低价氧化物后,由于这种中间相的溶解度极低,难以扩散至电极附近继续还原为金属钒。但如果NaCl 熔盐中引入CaCl2,中间相向电极扩散的动力学条件会得到改善,它的还原深度也会大大增加。其原因是:在纯NaCl 熔盐中引入Ca2+后,在电解过程中生成的中间相会由V2O3转化为CaV2O4,CaV2O4在NaCl-CaCl2熔盐中的溶解度比V2O3要大得多(CaV2O40.6%,V2O30.15%),也比V2O3要更容易扩散至电极附近,因而可以深度还原得到金属单质。所以NaVO3以CaCl2-NaCl 混合熔盐为电解质,在800 ℃、3.0~3.2 V 的槽电压下进行电解会得到钒单质。
钒酸盐也可用液态金属阴极的方法来制备VM 合金,关键是找到合适的阴极,即易与钒形成有低共熔点的固溶体,且该阴极难与C 形成固溶体。
4.2 铬酸盐
铬酸盐与钒含氧酸盐电解还原过程相似,在氯化物熔盐中具有良好的溶解性。同样遵循分步还原历程,先生成低价氧化物中间体,然后还原为金属。Ca2+也会加深其还原深度,促进低价氧化物的还原[40],强化向电极表面的迁移,具体过程为:中间相Cr2O3转变为CaCr2O4,CaCr2O4在熔盐中具有比Cr2O3更好的溶解度,更容易扩散至电极表面,使得还原动力学条件得以改善,进而实现中间产物的深度还原。
铬酸盐也可用液态金属阴极的方法制备合金,阴极可选择与Cr 固溶度好的Zn 和Sn[41],用液态金属阴极制备铬合金,金属Cr 会进入液态金属阴极内部,杂质C 停留于阴极界面,实现金属Cr 与杂质碳的分离。铬酸盐可与Zn、Sn 形成Cr-Zn、Cr-Sn 合金,除此之外,也可用固体氧化膜的方法从铬的复合矿中直接制备金属或者合金。
4.3 钛酸盐
以钛酸盐中最为常见的钛酸钙来说,它的理论分解电压远低于氯化物或者氟化物熔盐[42],这两类熔盐都有可能作为熔盐电解钛酸钙的电解质,实现它的电化学还原。但是钛酸钙在氯化物熔盐中溶解度较差,要沉积的钛离子难以扩散至电极表面,故钛酸钙的熔盐电解过程不能选择氯化物作为其熔盐体系。据文献结果可知,CaTiO3在氟化物熔盐Na3AlF6-10%AlF3中的溶解度为2.4%,它能够很好地溶解钛酸钙,钛离子在氟化物熔盐中易扩散至电极表面附近,实现钛离子的深度还原,动力学条件良好。CaTiO3在Na3AlF6-10%AlF3熔盐中的电解过程中发生的化学反应见式(29)。

但上述反应并不是一步到位的,与其他难熔金属含氧酸盐一样遵循分步还原步骤,先还原为钛的低价氧化物,再进一步还原为单质,具体过程是:。在具体实验中,只要在钛酸盐的标准平衡电位之上对其施加电压,钛酸盐就可以在Na3AlF6-10% AlF3熔盐体系中制备出钛单质。
在OS 法的基础上,TiO2的电解还原过程中会有中间相钛酸钙(CaTiO3)的产生,且CaTiO3的生成量随着CaCl2添加量的增加而增加。据文献[43-47],TiO2的钙热还原过程为:TiO2→Ti4O7→Ti3O5→Ti2O3→TiO→Ti。发生的主要化学反应见式(30)~(37)。
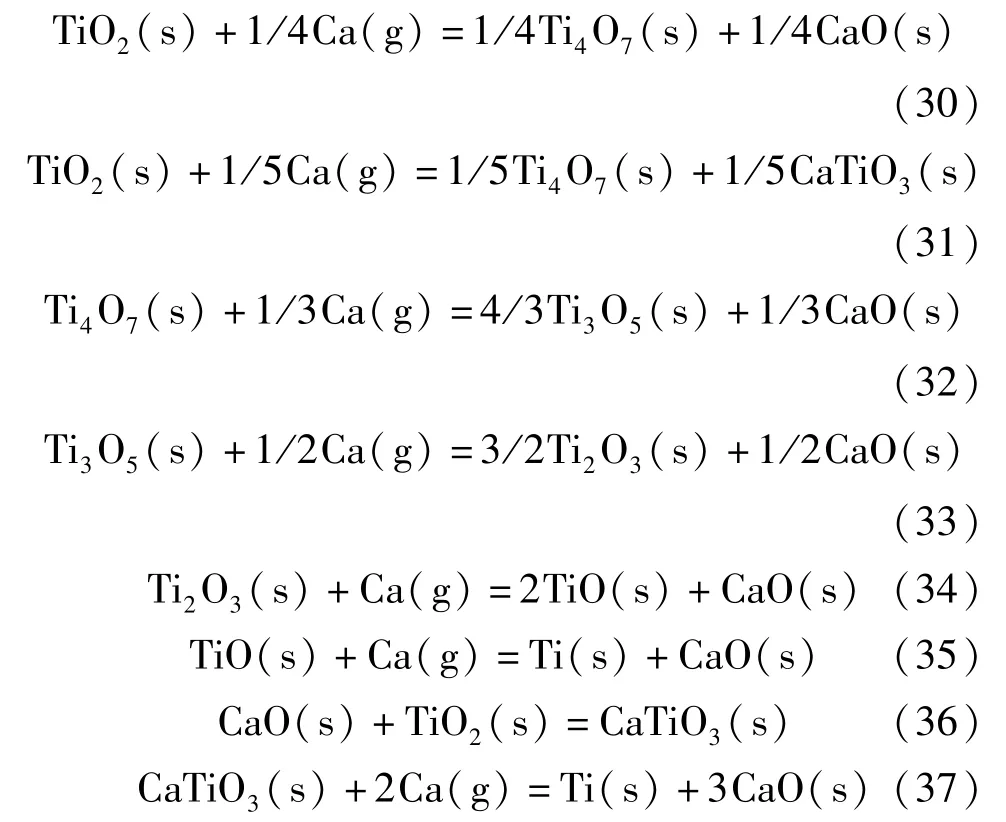
采用HSC6.0 软件以TiO2转变成Ti4O7为例,对最终TiO 和CaTiO3还原生成Ti 进行热力学分析。据图2 可知,反应式(30)的ΔG大于反应式(31)的ΔG,表明在TiO2在还原过程中更容易生成中间相CaTiO3;反应式(37)的ΔG远远小于反应式(35)的ΔG,说明CaTiO3更容易与单质钙发生还原反应生成金属钛[48]。

图2 反应式(30)~(31)和反应式(35)~(37)的ΔG 与T 的关系
除了OS 法之外,在以氧化物为原料,采用FFC法电脱氧制备硅、钛的过程中也发现,会有中间相CaSiO3和CaTiO3等含氧酸盐的生成,说明难熔金属含氧酸盐作为原料制备金属单质存在可能性,但这种方法是固态电脱氧过程,存在着固态电极的弊端,难以实现大规模生产。
由上述分析可知,钛酸钙可以作为熔盐电解制备钛的钛源,原因如下:钛酸钙在氟盐体系中具有一定的溶解度(Na3AlF6-10%AlF3,2.4%);相较于钛的氧化物来说钛酸钙更易生产金属钛;钛酸钙为离子型的晶体,在熔盐中比较容易扩散到电极附近,实现高效电解;也可用液态金属做阴极,但需选择合适的金属,如Fe、Sn、Si 等,形成Ti-M 合金,但这种方法都选择钛的氯化物作为钛源,钛酸盐是否可作为原料还有待研究。
5 结论
目前熔盐电解制备金属及合金的工艺大多是以金属氧化物或氯化物为原料。氧化物在熔盐中溶解度小,还原动力学差;氯化物虽然溶解度较好,但其制备过程复杂,腐蚀性强,污染环境。本文提出以难熔金属含氧酸盐作为原料熔盐电解短流程制备金属的新过程,具有如下优点。
1)难熔金属含氧酸盐接近原生矿物,以此为原料可大幅缩短工艺流程,还能够避免氧化物原料制备过程中产生的污染,且难熔金属含氧酸盐熔盐电解制备金属的过程不产生有害气体,保护环境。
2)难熔金属含氧酸盐为易溶解离子型化合物,能够与熔盐电解质结合形成共晶体系,利于电解过程中离子的迁移扩散,有望实现高效电解,提高电流效率。
3)难熔金属含氧酸盐的理论分解电压远小于氯化物和氟化物熔盐,在电解过程当中不会发生氯化物和氟化物熔盐的分解。
4)以难熔金属含氧酸盐为电解原料溶解将其在熔盐中制备其对应金属时,可避免FFC 法中电解原料做固态电极时电解产物中氧含量过高、某些杂质(C 等)依附于固体颗粒难以去除等问题,减少后续除杂步骤。
5)对于实用性的金属电化学冶金技术,必须要求原料为溶解态,难熔金属含氧酸盐在氯化物或者氟化物熔盐中的溶解度比其金属氧化物在熔盐中的溶解度更好,符合短流程高效制备金属的原则。

