内镜黏膜下剥离术治疗表浅食管鳞癌的价值分析
王晨晖,杜浩杰,许国强
食管癌在世界癌症发病率中排名第七,死亡率中排名第六[1],是男性与癌症相关死亡的第六大主要原因[2]。我国食管癌新发病例和死亡病例分别约占全球总数的54%以及56%[1]。内镜下根除治疗,主要是内镜下切除(ER),在90%以上的T1a食管癌(即癌症仅限于黏膜固有层M2 或黏膜肌层M3)中的应用可实现完全根除[3],其中内镜黏膜下剥离术(ESD)是主要的治疗方法。近期的研究表明ESD 对于食管癌患者的治疗具有重要价值[4-7]。鉴于此,本文探讨分析ESD 治疗表浅食管鳞癌(SESCC)的价值,现报道如下。
1 资料与方法
1.1 一般资料 收集2012 年11 月至2020 年12 月于浙江大学医学院附属第一医院住院治疗的SESCC患者186 例,根据手术方法分为ESD 组和外科手术组。纳入标准:(1)术前胃镜结合活检病理学检查诊断为SESCC;(2)接受ESD治疗或外科手术治疗;(3)术后标本送检组织病理学诊断食管鳞癌,肿瘤限于黏膜、黏膜下层。排除标准:(1)临床资料缺失及病理组织学资料不完整;(2)不能配合、不能耐受、术中生命体征不平稳;(3)无复查临床资料或失访;(4)合并有其他系统的严重疾患,影响预期寿命。
1.2 方法 外科手术治疗主要包括经食管裂孔食管癌切除术与经胸食管癌切除术,具体术式的选择根据患者情况、病灶部位与特点决定。ESD 手术包括标记、黏膜下注射、黏膜切开、黏膜下剥离及创面处理等步骤。
1.3 观察指标 收集并记录两组年龄、性别、住院时间及费用等基本信息,术前超声内镜检查、胸部(食管)CT、腹部超声检查等数据,病灶大小、肿瘤距门齿距离、病理诊断结果(包括浸润深度与分化程度等)、治疗方式与经过、手术并发症等资料。术后进行门诊或电话定期随访,末次随访时间截止为2021 年1 月或者患者死亡。将患者接受治疗后至末次随访或者复发时间定为无复发生存时间。
1.4 统计方法 采用SPSS 20.0 进行统计分析,计量资料以均数±标准差表示,采用t 检验;计数资料采用2检验;生存分析使用Kaplan-Meier 方法与Log-Rank 检验,使用COX 回归风险模型分析变量与预后结局之间的关系。P <0.05 为差异有统计学意义。
2 结果
2.1 两组一般情况比较 两组性别、年龄、肿瘤数目、肿瘤位置及术后食管狭窄率差异均无统计学意义(均P >0.05);两组原发灶长径、浸润程度、分化程度、住院费用、住院时间、术中出血量及术后感染率差异均有统计学意义(均P <0.05)。见表1。两组无复发生存率差异无统计学意义(Log Rank P >0.05),见图1。

图1 ESD 组与外科手术组无复发生存曲线

表1 两组基线资料比较
2.2 ESD 组不同水平切缘性质临床特征分析 根据水平切缘阴阳性分组,进行临床特征分析。水平切缘阳性组年龄大于阴性组(P<0.05),其余浸润程度、分化程度、并发症及病灶大小差异均无统计学意义(均P >0.05)。见表2。
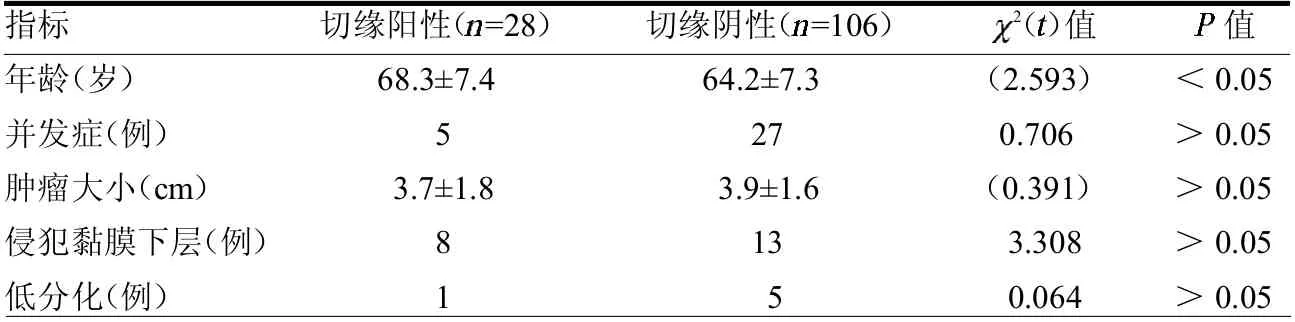
表2 ESD 组不同水平切缘性质临床特征比较
2.3 ESD 组生存情况及影响因素分析 ESD 组术后3、5 年无复发生存率分别为94.3%、88.0%,中位随访时间24 个月。手术水平切缘、肿瘤浸润程度、病灶大小、并发症情况、性别及年龄皆不影响无复发生存率(均Log Rank P >0.05),肿瘤分化程度为中、低分化患者的无复发生存率低于高分化患者(Log Rank P<0.05)。见图2。
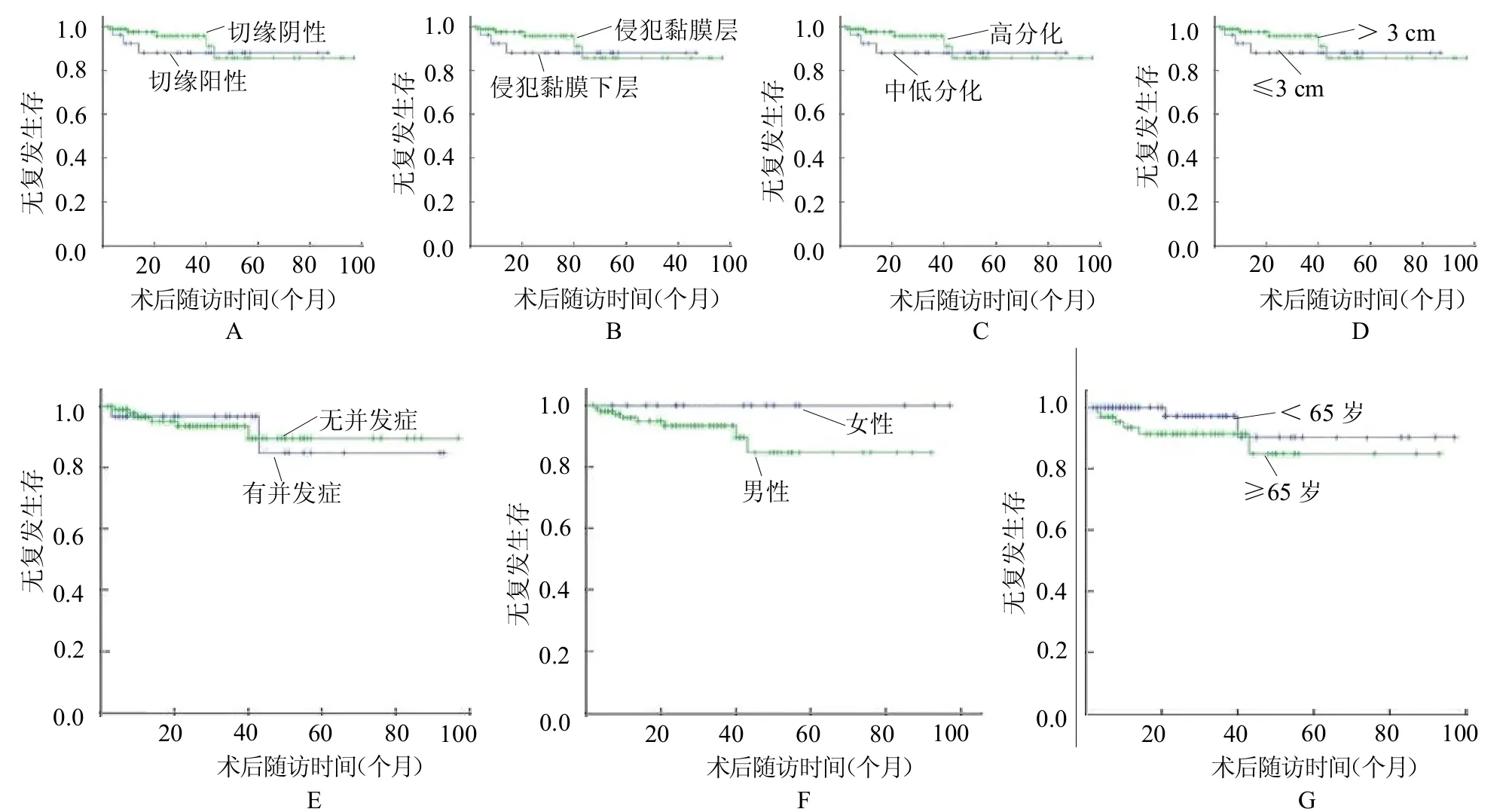
图2 ESD 组无复发生存曲线图
2.4 影响ESD 治疗患者预后生存多因素分析 手术切缘性质、年龄、性别、肿瘤浸润程度、肿瘤大小及并发症与无复发生存率无关,肿瘤分化程度是影响ESD术后患者无复发生存率的独立危险因素(P <0.05),见表3。

表3 影响ESD 治疗患者预后生存多因素分析
2.5 外科手术组淋巴结转移情况 52例外科手术患者中4 例(7.7%)诊断为N1 期,3 例(5.8%)诊断为N2 期。根据淋巴结是否转移分为阳性组和阴性组,两组原发病灶长径差异有统计学意义(P<0.05),两组性别、分化类型、年龄、肿瘤部位及浸润程度差异均无统计学意义(均P >0.05),见表4。超声内镜(EUS)对淋巴结肿大检出率为14.8%(8/54),而CT 为16.8%(19/113)。7 例淋巴结转移患者中,术前检查EUS 发现4 例,CT 检查发现5 例。

表4 外科手术组淋巴结转移阳性患者的临床特征分析
3 讨论
食管癌侵袭性强、恶性程度高,早诊早治是挽救食管癌患者生命的关键。食管切除术仍然是食管癌首选治疗方式,但因手术破坏食管生理结构,患者术后生活质量明显下降[8]。ESD 作为重要的内镜下切除方式,已在治疗早期胃肠道肿瘤方面取得重要发展,但在SESCC 中的应用仍存在争议[9]。故本研究分析了SESCC的特点,并探讨ESD 的治疗价值。
本研究男女比例约7∶1,肿瘤好发于中下段食管,多见于61 ~70 岁人群,平均年龄65 岁,3 年与5 年无复发生存率分别为94.3%与88.0%,与既往研究报道相符[10]。ESD 治疗组预后生存方面,提示手术切缘性质、肿瘤浸润程度、病灶大小、并发症情况、性别及年龄皆不影响SESCC 患者的无复发生存率,而肿瘤分化程度是ESD术后患者复发的独立影响因素(HR=4.654,95%CI:1.110~19.523,P=0.036),与国外文献研究相符[11]。
外科手术淋巴结清扫后病理结果显示,SESCC存在淋巴结转移情况,这类患者是ESD 治疗的禁忌,对术后病理提示肿瘤浸润黏膜下层超过200 m、低分化、脉管阳性需追加外科根治手术或根治性放疗,这体现了术前准确评估淋巴结转移情况的重要性。本研究发现EUS 对淋巴结肿大检出率为14.8%,而CT 为16.8%,其中有2 例术前行胸部CT 检查时发现异常肿大淋巴结,行EUS 引导下的细针穿刺活检术(EUS-FNA)对可疑淋巴结进行了活检,病理诊断阴性排除了淋巴结的转移,为治疗方式的选择提供了参考。虽然SESCC 病灶较小,食管CT 检查对其具有较高的漏诊率,需要结合内镜结果进行综合考虑,但仍建议将CT作为食管癌分期和检查的一部分[12],因其对于淋巴结与侵犯转移病灶的提示作用不容忽视。52 例外科手术治疗组中切缘阳性率仅1.9%,但其术后并发症较为多见,共48.1%的患者术后出现并发症,包括感染、出血、气胸、狭窄、术后肺不张、手术切口皮下积液及心律失常等。外科手术治疗患者3 年累积无复发生存率为80.7%。同时,本研究证实了ESD具有创伤小、恢复快、并发症少、住院时间短、经济效益高的优点。外科手术组无复发生存率较ESD 治疗组稍低,这可能是由于外科手术组肿瘤分化程度低于ESD 治疗组(P<0.001)导致,与前面所发现的肿瘤分化程度是患者复发的独立影响因素相一致。
综上所述,ESD 的疗效与外科手术治疗相当,且具有微创、感染风险小、并发症少、恢复快、住院周期短及经济效益高等优点,但需术前、术后精准评估淋巴结转移风险。

